1.分子间作用力
经验告诉我们,液氮汽化、干冰的升华都需要吸收能量;而许多气体凝聚为液体,甚至凝结为固体需要足够低的温度,这些都说明分子间存在着某种作用力,可以把分子聚集在一起,这种分子和分子之间的作用力称为分子间作用力。1837年,荷兰物理学家范德华首先对分子间作用力进行了研究,因此分子间作用力又被称为范德华力。分子间作用力比化学键要弱得多。

图5-11 干冰升华

图5-12 范德华(J.D.Vander Waals)
分子间作用力的范围较小。固态时分子间作用力较大,液态次之,而气态时分子间作用力很小。
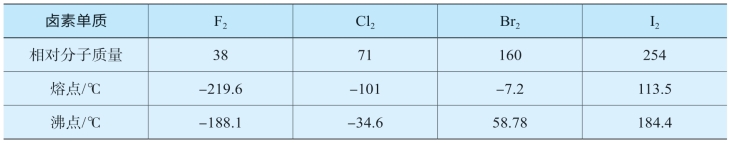
分子间作用力的大小对物质的熔点、沸点、溶解度等物理性质都有一定影响。分子间作用力越大,物质的熔、沸点就越高,这是因为物质熔化或汽化需要吸收能量克服分子间作用力。一般来说,组成和结构相似的物质,随着相对分子质量的增大,分子间作用力也增大,熔、沸点也随之升高。表5-7中卤素单质的熔、沸点就证明了这一点。
表5-7 卤素单质的熔点和沸点
2.氢键(https://www.xing528.com)
经过研究发现,有些氢化物的熔、沸点递变规律与以上规律不完全相符。例如,H2O的相对分子质量虽然比同类型的H2S要小,但熔、沸点却比H2S要高得多,这说明H2O分子间除了范德华力以外,还有一种比范德华力更大的分子间作用力,我们称之为氢键。
表5-8 某些氢化物的沸点

观察思考
表5-8中的数据有何反常之处?
在H2O分子中,由于O原子吸引电子的能力强,共用电子对强烈地偏向O原子,使H原子几乎成为裸露的带正电荷的原子核,这样它就可以与另外一个分子中的O原子产生较强的静电作用形成氢键。由于氢键属于一种特殊的分子间作用力,它比化学键弱得多,所以一般用……表示。
当氢原子与吸引电子能力很强的元素(如F、O、N)的原子结合时,它能与另一分子中吸引电子能力很强的原子之间产生静电引力,这种静电引力叫作氢键。除了H2O分子间可以形成氢键外,NH3分子之间、HF分子之间也可以形成氢键。
正是由于某些氢化物分子间存在氢键,增大了分子间的吸引力,当它们的分子汽化时,除了克服范德华力外,还必须破坏氢键,需要消耗更多的能量,使得它们比只有范德华力的同类物质的熔、沸点要高。

图5-13 水分子氢键示意图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




