目前已经发现的元素有116种,根据元素周期律,我们把电子层数目相同的各种元素,按照原子序数递增的顺序从左到右排成横行;把不同横行中最外层电子数相同的元素按照电子层数递增的顺序由上而下排成纵行,这样可以得到一个表,我们称之为元素周期表。元素周期表是元素周期律的具体表现形式,它反映了各种元素性质的递变规律,是我们学习化学、认识物质性质和变化规律的重要工具。
(一)元素周期表的结构
1.周期
元素周期表有7个横行,每个横行为一个周期,依次用1、2、3、4、5、6、7表示。同周期的元素有相同的电子层数,周期的序数就是该周期元素具有的电子层数。第1周期所含元素最少,只有2种元素,2、3周期都含有8种元素,这三个周期我们称之为短周期;第4、5、6、7周期所含元素较多,分别为18、18、32、32种,称为长周期。
除第1周期外,在同一周期中从左到右,各元素原子最外层电子都是从1个逐渐增加到8个。除第1周期从气态元素氢开始,其余各周期的元素都是从活泼金属元素开始,逐渐过渡到活泼的非金属元素,最后以稀有气体元素结束。
第6周期中,从57号镧(La)到71号镥(Lu)共15种元素,原子结构和性质极为相似,合称为镧系元素。同样,第7周期中,从89号锕(Ac)到103号铹(Lr)共15种元素,合称为锕系元素。为了不使元素周期表的横行过长,将镧系元素和锕系元素另列于元素周期表的下方。

图5-8 元素周期表
2.族
元素周期表中共有18个纵行,一般每一纵行为一族(只有第8、9、10三个纵行为一族),共分为16个族。
由短周期元素和长周期元素共同构成的族,叫作主族。元素周期表中共有7个主族,分别用ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA表示,主族元素的族序数与该族元素原子的最外层电子数相同。每个主族又有一个名称:第ⅠA族,叫作“碱金属族”;第ⅡA族,叫作“碱土金属族”;第ⅢA族,叫作“硼族”;第ⅣA族,叫作“碳族”;第ⅤA族,叫作“氮族”;第ⅥA族,叫作“氧族”;第ⅦA族,叫作“卤素族”。0族是稀有气体元素,化学性质非常不活泼,通常情况下不发生化学变化,其化合价为零。
完全由长周期元素构成的族,叫作副族。元素周期表中共有7个副族,分别用ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB表示。副族元素位于元素周期表的中部,又叫作过渡元素。过渡元素都是金属元素。第Ⅷ族包括第8、9、10三个纵行,全部都是过渡元素。
(二)元素周期表中元素性质的递变规律
元素周期表是根据元素性质的周期性变化排列而成的,因此,从元素周期表,我们就可以更加系统地认识元素性质变化的规律性,能够更好地学习和掌握元素的性质。
1.主族元素的金属性和非金属性的递变
元素的金属性和非金属性通常是指其原子在化学反应中失去和得到电子的能力。金属性是指金属原子失去电子形成阳离子的性质;非金属性是指元素的原子获得电子形成阴离子的性质。我们可以从元素的单质跟水或酸反应置换出氢的难易或者元素最高价氧化物的水化物(氢氧化物)碱性的强弱,来判断元素金属性的强弱;从元素最高价氧化物的水化物酸性的强弱或者跟氢气反应生成气态氢化物的难易,来判断元素非金属性的强弱。
在同一周期中,各元素的原子核外电子层数虽然相同,但从左到右,核电荷数依次增多,原子半径逐渐减小,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强(稀有气体除外)。所以,从左到右,元素的金属性逐渐减弱,如Na>Mg>Al;非金属性逐渐增强,如P<S<Cl;金属的最高价氧化物对应的水化物酸性逐渐减弱,如NaOH>Mg(OH)2>Al(OH)3;非金属的最高价氧化物对应的水化物酸性逐渐增强,如H3PO4<H2SO4<HClO4(高氯酸)。
同一主族中的元素,从上到下随着电子层数逐渐增多,原子半径逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强,即同主族元素从上到下各元素的金属性逐渐增强,非金属性逐渐减弱。所以,非金属的最高价氧化物对应的水化物酸性逐渐减弱;金属的最高价氧化物对应的水化物碱性逐渐增强。例如,第ⅠA族元素金属性,Li<Na<K,碱性LiOH< NaOH<KOH。第ⅤA族元素非金属性,N>P,酸性HNO3> H3PO4。
综上所述,将主族元素的金属性和非金属性的变化规律概括于图5-9中。如果沿着周期表中硼、硅、砷、碲、砹跟铝、锗、锑、钋之间画一条折线,折线的左边是金属元素,右边是非金属元素,左下方是金属性最强的元素,右上方是非金属性最强的元素。由于元素的金属性和非金属性没有严格的界限,位于折线附近的元素,既表现出某些金属性质,又表现出某些非金属性质。

图5-9 主族元素金属性和非金属性的递变(https://www.xing528.com)
想一想
什么元素的金属性最强?什么元素的非金属性最强?它们分别位于周期表的什么位置?
2.元素化合价的递变
元素的化合价与原子的电子层结构有密切关系,特别是与最外层的电子数目有关,有些元素的化合价还与原子的次外层或倒数第三层的部分电子有关。我们把能够决定化合价的电子,即参加化学反应的电子称为价电子。主族元素的最外层电子都是价电子。
表5-5 各主族元素的价电子数和化合价的关系
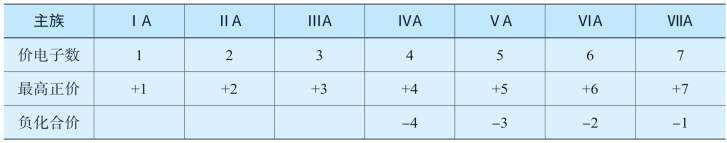
从表5-5可以看出,主族元素存在如下关系:元素的最高正化合价等于它所在主族的族序数(O、F除外),非金属元素的最高正化合价和它的负化合价绝对值的代数和等于8。
O族元素非常稳定,化合价为0;副族元素的化合价比较复杂,在这里不作讨论。
元素的性质是由原子结构决定的。元素性质、原子结构和元素在元素周期表中的位置三者之间存在着密切的关系,我们可以根据元素的原子结构,来推断它在周期表中的位置及性质。
(三)元素周期表的应用
元素周期律和元素周期表,揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面,都有重要意义。
运用元素周期律和元素在周期表中的位置及相邻元素的性质关系,可以推断元素的一般性质,预测和发现新元素,寻找和制造新材料等。例如,在门捷列夫编制周期表的时候,当时还有许多元素没有发现,他根据元素周期律,在周期表中预留出许多位置,并根据空格周围元素的性质,预言了几种未知元素的性质,以后这些元素陆续被发现了,根据实验测得的这些元素的性质与门捷列夫所预言的非常相似。
元素周期表对工农业生产具有重要的指导意义,因为周期表中位置靠近的元素性质相近,这样为人们寻找新材料提供了一定的线索。例如,农药多数是含Cl、P、S、N、As等元素的化合物,这些元素都位于周期表的右上角;半导体材料都是周期表里金属与非金属交界处的元素,如Ge、Si、Ga、Se等;过渡元素对许多化学反应有良好的催化性能,人们努力在过渡元素(包括稀土元素)中寻找各种优良催化剂;钛、钽、钼、钨、铬等过渡金属,具有耐高温、耐腐蚀等特点,它们是制作特种合金的优良材料。另外,还可以利用元素周期表寻找某些矿物,如原子量较小的元素在地壳中含量较多,原子量较大的元素在地壳中含量较少;碱金属一般是强烈的亲石元素,主要富集于岩石圈的最上部等。
拓展阅读
门捷列夫和元素周期表
1869年,俄国化学家门捷列夫在批判和继承前人工作的基础上,对大量实验事实进行了订正、分析和概括。他总结:元素的性质随着相对原子质量的递增而呈现周期性的变化,这就是元素周期律。他还根据元素周期律编制了第一张元素周期表,把已经发现的63种元素全部列入表里。他预言了类似硼、铝、硅等未知元素的性质,并为这些元素在表中留下了空位。他在周期表中也没有完全按照相对原子质量数值由小到大的顺序排列,并指出了当时测定某些元素的相对原子质量数值有错误。
1875年,法国化学家德布瓦博德朗发现了第一个待填补的元素,定名为镓。1879年,瑞典化学家尼尔森发现了第二个待填补的元素,定名为钪。1886年,德国化学家文克勒又发现了第三个待填补的元素,定名为锗。这三个元素的性状都和门捷列夫的预言几乎完全相符。门捷列夫由于发现元素周期律,闻名于全世界,光荣地担任了世界上一百多个科学团体的名誉会员。
门捷列夫的兴趣非常广泛,他对物理学、化学、气象学、流体力学等,都有许多贡献。但他的生活却十分简朴,衣服式样常常落后别人十年以至二十年,但他毫不在乎,他说:“我的心思在周期表上,不在衣服上。”
门捷列夫年过七旬后,积劳成疾,双目半盲,但他仍然每天清早开始工作,一口气写到下午五点半,饭后又接着写作。1907年2月2日清晨5时,门捷列夫因心肌梗塞逝世,时年73岁。当时,他面前的写字台上还放着一本未写完的关于科学和教育的著作,在他临去世时,手里还握着笔。长长的送葬队伍,达几万人之多。队伍前面,既不是花圈,也不是遗像,而是几十位学生抬着的大木牌,牌上画着化学元素周期表——他一生的主要功绩!
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




