在元素周期表中,把元素按照核电荷数由小到大的顺序排列起来并给它们编号,这个序号我们称之为元素的原子序数。显然,元素的原子序数在数值上与该元素原子的核电荷数相等。表5-4中的18种元素就是按照原子序数的顺序排列的。通过对1~18号元素的研究,可以帮助我们认识元素之间的内在联系和元素性质变化的规律。
议一议
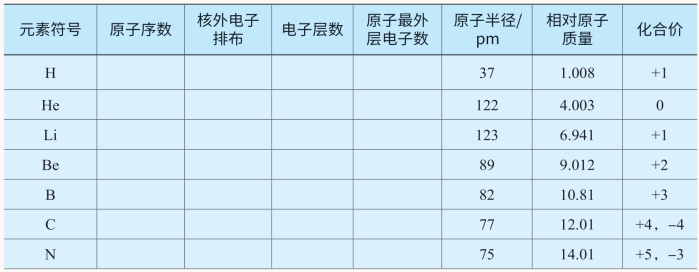
下表是1~18号元素的部分信息,相互交流讨论完成表中所缺内容。
表5-4 1~18号元素的相关性质
(续表)
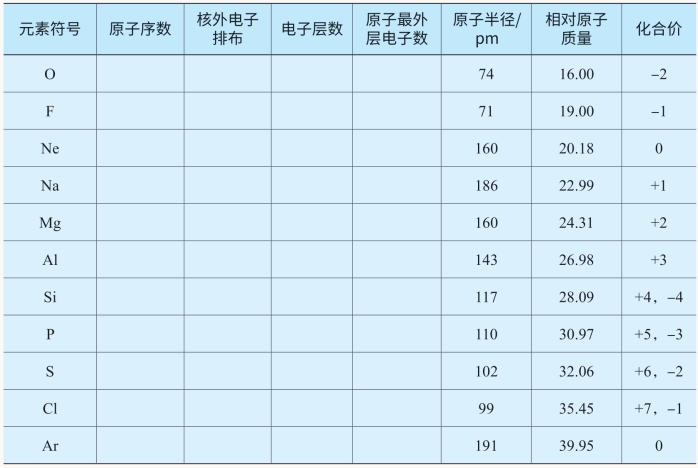
对表中的各项内容进行分析比较,能不能发现其中的规律呢?
从表5-4中可以看出,部分元素的各种数据及主要性质呈现周期性变化,下面分别进行描述:
1.核外电子排布的周期性变化(https://www.xing528.com)
1~2号元素,只有一个电子层,电子由1个增加到2个,达到稳定结构。3~10号元素,原子核外都有两个电子层,而最外层电子由1个增加到8个,达到稳定结构。11~18号元素,原子核外有三个电子层,最外层电子也是从1个增加到8个,达到稳定结构。如果对18号以后的元素继续分析,我们会发现同样的变化规律,即随着原子序数的递增,元素原子的核外电子排布呈周期性变化。
2.原子半径的周期性变化
除稀有气体外,从锂到氟,随着原子序数的递增,原子半径由大逐渐变小;从钠到氯,随着原子序数的递增,原子半径也是由大逐渐变小。再比较锂和钠、铍和镁等,可以发现,最外层电子数相同的情况下,电子层数越多,原子半径越大。由此我们发现,随着原子序数的递增,元素的原子半径呈周期性变化。
3.元素主要化合价的周期性变化
从表5-4可以看出,原子序数由3~9或者11~17,元素的最高正化合价均从+1价依次递增至+7价(氧、氟例外),非金属元素的最低负价从-4价依次递变至-1价。同样,如果对18号以后的元素继续分析,也可以发现相似的变化。可见,元素的化合价随着原子序数的递增呈现周期性变化。
通过以上讨论,我们可以得到以下结论:元素的性质随着元素原子序数的递增而呈周期性变化,这个规律我们称之为元素周期律。
查一查
元素周期律理论经历了哪些发展过程?
元素周期律的发现是继原子-分子论之后,近代化学史上的又一座光彩夺目的里程碑,它所蕴藏的丰富和深刻的内涵,对以后整个化学和自然科学的发展都具有普遍的指导意义。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




