
图4-3 用小刀切割金属钠
1.钠的物理性质
金属钠很软,可以用小刀切割,切开外皮后,可以看到钠具有银白色的金属光泽。钠的密度为0.97 g/cm3,比水略小,因而能浮在水面上。钠的熔、沸点较低,熔点为97.81℃,沸点为882.9℃。此外,钠还具有良好的导电和导热性。
2.钠的化学性质
钠原子的最外电子层上只有一个电子,在化学反应中很容易失去最外层的电子成为+1价阳离子,因此,钠的化学性质非常活泼,能与氧气等许多非金属和水等发生反应。
(1)与氧气的反应。
金属钠光亮的切面暴露在空气中,逐渐失去光泽而变暗。这是因为钠与空气中的氧气发生反应生成白色的氧化钠。反应的化学方程式为
![]()
加热时,钠与空气中的氧气剧烈反应,钠燃烧,火焰呈黄色,生成淡黄色的过氧化钠。反应的化学方程式为
![]()
常温下,钠除了能与氧气直接化合外,还能与卤素、硫等多数非金属单质直接化合。例如,![]()

图4-4 钠在空气中燃烧
(2)与水的反应。
金属钠与水剧烈反应,放出大量的热,使钠熔化成小球,反应后生成了氢氧化钠和氢气,反应的化学方程式为
![]() (https://www.xing528.com)
(https://www.xing528.com)

图4-5 钠与水的反应
因为钠易与空气中的氧气、水蒸气等发生反应,所以,在实验室中通常将钠浸入煤油中或密封于石蜡中保存,以隔绝空气和水。
资料在线
碱金属
钠位于元素周期表中的第ⅠA族,除氢以外的锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种元素都是典型的金属元素,它们的氧化物溶于水后呈强碱性,因此称为碱金属。
碱金属单质的化学性质非常活泼,常温下即可与空气中的氧气发生反应,在加热条件下会发生剧烈燃烧,而且遇水会快速反应生成氢气并放出大量的热,甚至会引燃氢气而发生爆炸。
表4-2 碱金属的原子结构

表4-3 碱金属的主要物理性质
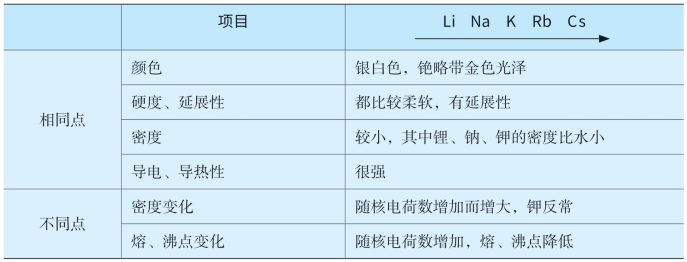
表4-4 碱金属的化学性质

3.钠的存在与用途
钠的性质很活泼,在自然界中以化合态形式存在。钠的化合物在自然界里的分布很广,主要以氯化钠、碳酸钠、硫酸钠、硝酸钠等形式存在。工业上金属钠是由电解氢氧化钠或氯化钠而制得的。
钠在冶金、化工、制药、印染等工业中有广泛的用途。钠和钾的合金在常温下呈液态,是原子核反应的导热剂;钠是一种很强的还原剂,可把钛、锆、铌等金属从它们的熔融卤化物中置换出来;钠在人体中也扮演了重要角色,成年人平均体内含钠60 g,同钾一起分别储存于细胞内外,起着维持细胞渗透压和酸碱度平衡的作用,并且维持神经和肌肉的正常运动,若钠缺乏或过量都会引起某些疾病。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




