氮占地壳总量的0.03%。空气中含量最多的气体就是氮气,约占空气体积的78%。氮是构成动植物体内蛋白质的重要元素。氮和氮的化合物,如氨、硝酸、氮肥、炸药以及蛋白质、核酸等在工业生产、国防和生命科学研究等领域中都有重要的用途。
读一读
自然界中氮的循环
氮是动物、植物和原生生物体(真菌、细菌)的重要组成元素,也是维持高等动植物生命活动的必需元素,因此,氮的循环涉及地球上生物圈的方方面面。
在自然界中,大豆、蚕豆等豆科植物根部的根瘤菌把空气中的氮气转变为硝酸盐等含氮的化合物。植物的根从土壤中吸收的铵根离子和硝酸盐,经过复杂的生物转化形成各种氨基酸,氨基酸最后转化为蛋白质。动物以植物为食物而获得植物蛋白,并将其转化为动物蛋白。动植物遗体中的蛋白质被微生物分解成NH4+、 NO3- 和NH3,又回到土壤和水体中,被植物再次吸收利用。另外,在放电条件下,空气中少量的氮气与氧气化合成氮的氧化物,这些氮的氧化物随降水进入土壤和水体。
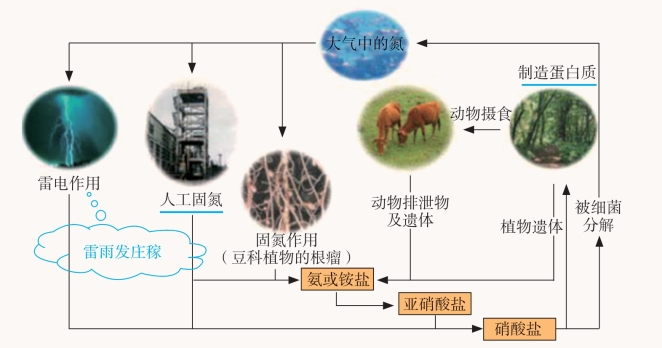
图3-23 氮在自然界中的循环示意图
影响氮在自然界中循环的另一个方面是人类的活动。人们通过化学方法把空气中的氮气转化为氨,再根据需要把氨转化成各种含氮化合物(氮肥、硝酸等)。某些含氮化合物进入土壤、大气和水体中进行转化。化石燃料燃烧、森林和农作物的枝叶燃烧所产生的氮氧化合物通过大气进入陆地和海洋,参与氮的循环。
1.氮气的物理性质
氮气在常温下是无色、无味的气体,不能供人类及动物呼吸。氮气密度比空气略小,在100 kPa、-195.8℃时变为无色液体,-209.86℃时变为雪状固体。氮气在水中的溶解度很小,通常状况下,1体积水大约只溶解0.02体积的氮气。
工业上所用的氮气,通常以空气为原料,将空气液化后,利用空气中液态氮的沸点比液态氧低的特点而分离制得。
2.氮气的化学性质
氮分子中两个氮原子以共价三键相互结合,因此,氮分子在通常状况下很稳定,既不可燃、不助燃,也很难参加化学反应。但在高温或一定条件下反应能力增强,能与氢气、氧气、金属等物质发生化学反应。
(1)氮气与氢气反应。
在高温、高压和催化剂作用下,氮气、氢气直接化合生成氨。工业上利用这个反应来合成氨。

(2)氮气与氧气反应。(https://www.xing528.com)
在放电条件下,氮气能和氧气直接化合生成无色的一氧化氮。
![]()
一氧化氮与氧气反应生成二氧化氮。
![]()
二氧化氮是红棕色、有刺激性气味的有毒气体,其密度比空气大,易溶于水。二氧化氮溶于水后生成硝酸和一氧化氮。
![]()
在雷雨天,氮气经过一系列反应生成的硝酸随雨水降落,与土壤中的无机盐结合生成氮肥。据估算,每年因雷雨而渗入大地的氮肥约有4亿吨。
资料在线
信使分子——一氧化氮
1998年的诺贝尔生理学或医学奖颁发给三位教授,分别是罗伯特·佛契哥特(Robert F.Furch gott)、路易斯·路伊格纳洛(Louis J.lgnarro)和费瑞·慕拉德(Ferid Murad)。他们获奖的主要研究成果与化学有极大的关系。他们发现一氧化氮在人体的血管系统内具有传输信号的功能。一氧化氮能让体内某部位的信号传送到另一部位。例如,血管接收到放松和扩张的信号后,血压就会降低。这项发现已应用于开发治疗心血管疾病的药物。
一氧化氮一向被视为大气污染物,但人们没有想到的是,这种简单的、普通的分子竟然在生命过程中有如此重要的功能。这是否能给人们一些有益的启示呢?
3.氮气的用途
大量的氮气在工业上主要用于合成氨、制硝酸等,它们是制造氮肥、炸药的原料。氮气可用作焊接金属的保护气;氮气或氮、氩的混合气体可用来填充灯泡,以防止钨丝的氧化和减慢钨丝的挥发,使灯泡经久耐用;充氮可以保存粮食和水果等,在高氮低氧的环境下,使害虫缺氧死亡,同时能使种子、果实处于休眠状态,减缓重新代谢,从而延长粮食、水果等农副产品的保存和保鲜时间。
液氮冷冻技术在高科技领域中也得到广泛应用。例如,在超导研究中常用液氮制造低温环境。近代医学上用液氮来保存待植的活性器官,用液氮做冷冻剂来治疗某些疾病。

图3-24 氮的用途
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




