表2-2列出了0℃、101 kPa(标准状况)时H2和O2的密度,以及1 mol这两种气体的质量,并计算出了相应的体积(提示:体积=质量/密度)。
表2-2 H2和O2的密度、摩尔质量、摩尔体积
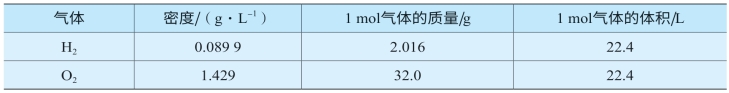
从以上表格可以看出,在标准状况下,1 mol H2和O2的体积都约为22.4 L。不仅仅这两种气体在标准状况时的体积约为22.4 L,大量的科学实验表明,其他气体也是如此。由此,我们可以得出一个结论:在标准状况下,1 mol 任何气体所占体积都约为22.4 L。
单位物质的量的气体所占的体积叫作气体摩尔体积,符号为Vm,单位为L·mol-1。
在标准状况下,气体摩尔体积约为22.4 L·mol-1。物质的量(n)、气体的体积(V)和气体摩尔体积(Vm)之间存在着如下关系:
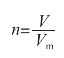
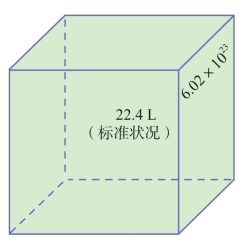
图2-3 标况下的1 mol气体体积大小示意图
根据此式,可以得知:在标准状况下,33.6 L氧气的物质的量为1.5 mol,2 mol O2的体积为44.8 L。
为什么在相同的温度和压强(标准状况)下,1 mol任何气体所占的体积都大致相同呢?
我们知道,物质体积的大小取决于构成这种物质的粒子的数目、大小和粒子之间的距离这三个因素。
1 mol 任何物质中的粒子数目都是相同的,即约为6.02×1023。因此,在粒子数目相同的情况下,物质体积的大小就主要取决于构成物质的粒子的大小和粒子之间的距离。
对于气体来说,粒子之间的距离(一般指平均距离)远远大于粒子本身的直径,所以,当粒子数目相同时,气体的体积主要取决于气体粒子之间的距离。而在相同的温度和压强下,任何气体粒子之间的距离都可以看成是相等的。因此,同温、同压下粒子数目相同的任何气体都具有相同的体积。
我们也可以说,在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。这就是阿伏伽德罗定律。
观察思考
1 mol 任何物质的固体、液体体积是否相同?怎样计算1 mol 固体、液体的体积?(https://www.xing528.com)

图2-4 不同状态下粒子之间的距离
练一练
1.决定一定量气体的体积大小的主要因素是( )。
A.气体分子的大小
B.气体分子的相对分子质量
C.气体分子间的平均距离
D.气体分子的数目
2.标准状况下,两种气体所占的体积不同,其原因是( )。
A.气体性质不同
B.气体分子的大小不同
C.气体分子间平均距离不同
D.气体的物质的量不同
查一查
搜集有关科学家阿伏伽德罗的信息及阿伏伽德罗常数是怎样计算出来的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




