出生后受电离辐射照射,当达到一定剂量后可引起急性放射病、慢性放射损伤等,电离辐射除可以引起上述全身损伤外,还可因局部受到外照射和放射性核素进入体内选择性的蓄积在某些器官或组织,以及进入或排出途径引起局部放射损伤。
(一)皮肤的电离辐射效应
局部放射损伤是指身体局部受到超过阈剂量的射线照射后发生的辐射损伤效应,其损伤变化主要发生在受照局部组织,全身也会有相应的反应。局部辐射损伤比全身辐射损伤发生的概率高得多。局部损伤通常虽无生命危险,但其迁延性效应可导致严重的身体残疾。
皮肤放射损伤是最常发生的局部放射损伤。受照皮肤基底组织的进行性病理反应是局部辐射损伤的典型特征。
皮肤分为表皮和位于表皮下方的由结缔组织构成的真皮,表皮是典型的阶层型组织,其干细胞为表皮的基底细胞,经过分化成熟形成角化层,人类表皮厚度从40~50μm(躯干)到370μm(手指);由基底细胞分化到角化层需17天左右,照射后最早出现的皮肤变化是红斑,可在暂时消退后再次反复出现;随红斑之后可以出现脱毛、干性脱屑、湿性脱屑和表皮坏死;大剂量照射后出现皮肤脱屑的时间(照射后2~3周)与从基底细胞分化到角化层所需的时间大体一致。皮肤照射的远期效应为表皮、汗腺、皮脂腺及毛囊萎缩,真皮纤维化,血管扩张,皮肤溃疡和皮肤癌等。
受到重视的皮肤放射损伤主要是接受穿透力较低的β射线和低能量X射线的外照射。因为穿透力较高的X射线和γ射线照射时,更重要的损伤是发生在深部器官而不是体表。较小面积皮肤接受β辐射粒子污染时可以成为“热粒子”使局部组织受到较高剂量的照射。β射线照射形成的辐射剂量取决于该粒子的能量和组织深度。皮肤的靶组织位于不同深度,加之损伤效应受照射面积和剂量分割而不同,因此很难给出可以适用于不同照射条件的皮肤损伤阈剂量。X射线或γ射线在面积10cm2引起皮肤红斑的剂量在一次短时间照射时为6~8Gy,多次分割照射时大于30Gy。
皮肤的远期效应,例如真皮萎缩和皮肤溃疡,主要是深部组织受到照射损伤的结果,其机制比较复杂,涉及表皮细胞缺失和真皮结缔组织与血管的损伤。为准确评价这些效应,应该考虑300~500μm深度的剂量。ICRP第60号出版物给出分次照射时,5年后出现血管扩张和真皮萎缩的阈剂量为30~40Gy。职业照射的皮肤确定性效应年当量剂量限值,在任何1cm2面积和7mg/cm2质量厚度下为0.5Gy,终身接受剂量将累积到20Gy。
表6-9 皮肤辐射损伤临床表现的出现时间及受照剂量
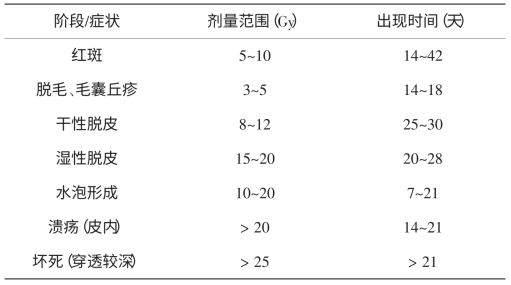
表6-10 急性放射性皮肤损伤分度诊断标准(GBZ106—2002)

表6-11 慢性放射性皮肤损伤分度诊断标准(GBZ106—2002)

表6-12 β辐射或低能X射线照射后手局部损伤的临床表现及受照剂量

注:(a)只限手指;(b)整个手。
(二)性腺的电离辐射效应
睾丸的生精干细胞是精原细胞,人类的精原细胞经精母细胞、精子细胞分化生成精子,完成一个发育周期大约需要10周;从刚刚产生的精母细胞发育到精子则需要46天。精原细胞对电离辐射非常敏感,照射后几个小时就会出现坏死;精母细胞和精子细胞很不敏感,只要不超过3Gy就不会引起明显的变化,此时这些细胞可以继续分化成熟,精子数在受照后大约46天内变化不大,这是精母细胞成长所需的时间,在此之后精子数目将迅速下降。1Gy照射经大约10周出现精子缺乏,0.15Gy照射经过相似时间后出现精子数目减少;精子的耐受性最高,3Gy照射也不会出现精子的形态学变化。
睾丸受照可以出现不育,但是只要有足够精原细胞存活,就可以通过增殖使生育能力恢复;一次短时间照射引起暂时性不育的参考阈剂量为0.15Gy,引起男性永久性不育的睾丸参考阈剂量为3.5Gy(一次短时间照射)和2.0Gy/年(高度分割和迁延照射)。
在女性生殖细胞中,卵原细胞与男性精原细胞相对应,卵母细胞与精母细胞相对应。卵巢中所有的卵原细胞均在胚胎期发育到卵母细胞,女婴出生后不久卵母细胞就进入休止期,形成初级卵泡,不再进行分裂。从青春期起,每月有一些初级卵泡发育成熟和排卵;出生后卵巢内不再有干细胞。
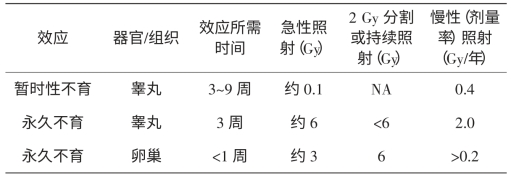
像睾丸一样,卵巢中的卵母细胞的辐射敏感性低于胚胎期的卵原细胞,因此,出生后卵巢对辐射的耐受力高于睾丸,一次短时间照射引起暂时性不育的阈剂量为0.65~1.5Gy,永久性不育的阈剂量为2.5~6.0Gy,由于卵母细胞随年龄增长而减少,所以造成永久性不育的阈剂量随年龄的增长而降低。ICRP给出的放射性不孕症阈剂量见表6-13。
表6-13 放射性不孕症阈剂量
(三)眼晶状体的电离辐射效应
X射线、γ射线、中子及高能β射线等电离辐射,无论是局部的急性或迁延照射,还是全身的急性或迁延照射,都可能诱发眼晶体混浊。眼晶状体是由晶状体上皮产生的晶状体纤维所构成,晶状体细胞不断缓慢分裂迁移,持续终身。辐射诱发白内障的确切机制尚不清楚。基因组损伤导致细胞分裂、转录的改变和晶状体纤维细胞分化异常,而不是细胞死亡,被认为是突出的损伤。有理论认为,晶状体上皮前赤道区域内分裂或分化异常的细胞能够发生迁移,主要迁移到后极,在此转变为不透明的晶状体纤维细胞。单一晶状体上皮细胞或纤维细胞的辐射损伤可能导致晶状体透明度的微小局灶改变。早期认为这些微浑浊的积累和融合会产生数群损伤的晶状体纤维细胞,这些细胞可形成更大的晶状体缺陷,最终导致临床可检出的浑浊。也有人认为放射性白内障的形成可能取决于含受损基因组的晶状体上皮细胞的存活、分裂和分化潜能。因此,对于这种分裂和分化中的晶状体上皮细胞,辐射诱导且未修复的DNA损伤可能是白内障形成的至关重要的第一步。当晶状体细胞的损伤识别和修复能力受损时,就可能使白内障形成的危险性增高,与细胞周期检测点控制相关的基因的杂合性、DNA损伤识别和修复也可能与放射性白内障的发生有关。
目前,尚无单个受损细胞可引起白内障的报道,这可能是无阈值的随机性效应的标志的直接证据。然而,有证据显示细胞分裂和增殖在白内障形成中的重要性。有报道称,在白内障患者的晶状体上皮细胞中微核(细胞分裂受损的标志)的发生率增加。动物研究结果表明,如果上皮细胞的细胞分裂被完全抑制,或者对分裂的上皮细胞进行辐射屏蔽,则不发生放射性白内障。对放射性白内障的形成可合理推测如下:晶状体中单个上皮母细胞发生初始损伤,通过细胞分裂和分化造成晶状体纤维细胞的成群缺陷。
ICRP 2007年建议书对已导致视力障碍的白内障的阈剂量估计值分别为:单次短时照射总剂量5Gy(美国国家辐射防护与测量委员会(NCRP)1989年给出的值为2~10Sv);分割多次照射或迁延照射总剂量大于8Gy(年剂量率大于0.15Gy/年);可检出的晶状体浑浊对应的阈值则低一些,分别为:0.5~2Gy/年、5Gy/年和大于0.1Gy/年。上述数据主要源于对原子弹爆炸幸存者和放射治疗患者的早年研究,这些研究一般随访时间短,未考虑潜伏期随剂量降低而延长这一重要因素,晶状体早期变化的检测缺乏足够的灵敏度,而且剂量在数个戈瑞以下的研究对象相对很少。流行病学研究使用多种自我报告、晶状体浑浊或白内障手术的病历记录存在相当程度的异质性,晶状体浑浊评分体系也各不相同。此外,不同临床医师和调查者之间,对放射性白内障的精确临床定义,以及经过足够的时间,是否所有可检出的晶状体变化都将导致视力障碍的白内障的认识也存在诸多差异。电离辐射引起晶体混浊的潜伏期长短相差很大,最短6个月,最长35年,平均2~4年。年龄越小,潜伏期越短;剂量越大,潜伏期越短。低LET辐射急性照射引起足以损害视力的眼晶体混浊(白内障)阈剂量(ED0)为2~10Gy,高LET辐射急性照射的阈剂量(ED0)为1~2Gy。对于长期照射的剂量阈,所知较少,但对多年照射,一般认为略高于0.15Gy·a-1。(https://www.xing528.com)
动物模型和受照人群的新数据显示,低于1Gy的剂量可诱发晶状体浑浊。更为精细的晶状体损伤评分体系的应用,更长时间的随访,以及更多可利用的低剂量受照数据,才能推导出更低诱发晶状体损伤的阈值。
对于晶状体浑浊或白内障,辐射诱发某一给定观察终点的效应,分次照射所需总剂量往往高于单次急性照射剂量。但是,总剂量较低的情况下,白内障潜伏期可能长达20年以上,低剂量率不能降低发病率。当前对职业和环境受照队列的流行病学证据提示,分割照射和迁延照射的阈剂量并不高于急性照射的阈值。因此,ICRP 118号出版物建议,出于辐射防护目的,对于急性照射、分割多次照射或迁延照射,或者多年中每年以分割多次照射或慢性照射接受剂量时,辐射诱发白内障的阈剂量均取0.5Gy,而不考虑剂量率。
(四)其他器官的损伤效应
不论是大剂量急性全身意外照射还是大剂量局部放疗照射,都可以引起体内其他重要功能系统,例如消化、呼吸、循环、泌尿、神经系统器官的损伤,出现相应的功能障碍,这些器官的损伤进展缓慢,机制复杂,既有照射引起的实质细胞、支持细胞和成纤维细胞损伤及减少的结果,也与照射时该器官出现的血管损伤及营养障碍有关,放射治疗时有可能使单一器官或少数器官受到超过阈值的很大剂量的照射。
需要关注的是甲状腺放射性损伤,电离辐射以内和(或)外照射方式作用于甲状腺或/和机体其他组织所引起的原发或继发性甲状腺功能或(和)器质性改变,统称为放射性甲状腺疾病。放射性甲状腺疾病分为五类:急性放射性甲状腺炎、慢性放射性甲状腺炎、放射性甲状腺功能减退症、放射性甲状腺良性结节、放射性甲状腺癌(随机性效应)。放射性甲状腺疾病发生对象可以职业照射的工作人员,也可以是非职业受照人员。放射性甲状腺疾病可以发生于放射性落下灰、核电站事故、原子弹爆炸、急性事故性放射病、131I治疗甲状腺疾病、职业性电离辐射照射等情况。
急性放射性甲状腺炎是指甲状腺短期内受到大剂量急性照射后所致的甲状腺局部损伤及其引起的甲状腺机能亢进症。
慢性放射性甲状腺炎是指甲状腺一次或短时间(数周)内多次或长期受射线照射后,导致的自身免疫性甲状腺损伤。慢性放射性甲状腺炎又称慢性放射性淋巴性甲状腺炎,内外照射皆可诱发。发病机制可能与自身免疫反应有关,具有抗原性的甲状腺球蛋白和微粒体漏出,导致体内产生自身抗甲状腺抗体所致。
放射性甲状腺功能减退症是指甲状腺局部一次或短时间(数周)内多次大剂量受照或长期超剂量限值的全身照射所引起的甲状腺功能低下。甲状腺组织受到电离辐射直接作用后,诱发甲状腺功能性或器质性损害而出现甲状腺功能低下,称为放射性原发性甲状腺功能减退,表现为三碘原氨酸(T3)、甲状腺素(T4)值降低和促甲状腺激素(TSH)值升高。电离辐射作用到下丘脑、垂体间接引起甲状腺功能减退,称放射性继发性甲状腺功能减退症,表现为血清T3、T4增高及TSH值降低;促甲状腺激素释放激素(TRH)兴奋试验,延迟反应病变在下丘脑,低弱反应或无反应病变在垂体。
放射性甲状腺良性结节是指甲状腺组织受到大剂量或长期超剂量限值的照射后诱发的结节性病变。
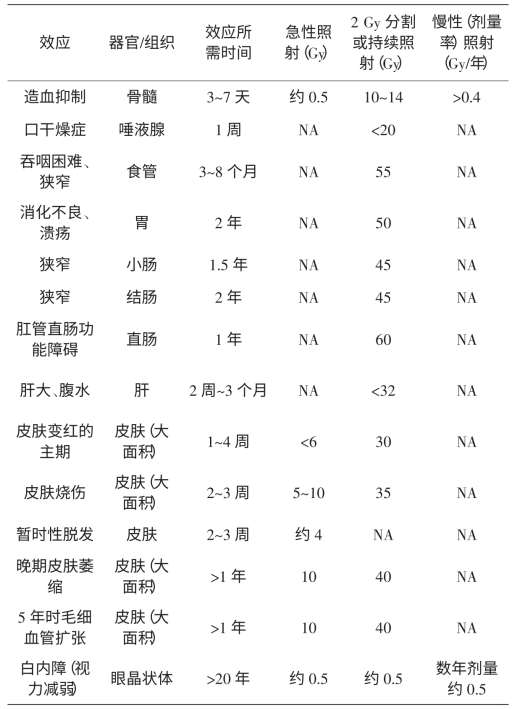
ICRP第118号出版物认为甲状腺放射性疾病危险度与照射剂量、年龄和性别有关,女性和高年龄组危险增大,常见原因是颈部外照射和131I摄入。实验发现狗长期暴露于γ射线外照射(2.4~3.8Gy)可导致甲状腺功能减退症。临床放射治疗的量效关系为单次照射≥10Gy/次,或分次照射18Gy可引起甲状腺功能减退;累积照射≥0.3Gy可引发甲状腺炎(潜伏期1年上);≥0.2Gy 10年以上的照射可发生良性甲状腺结节;受照4年以上,有可能诱发甲状腺癌,这些数据来源于日本核武器损伤人群调查、切尔诺贝利事故调查、医疗照射调查和动物实验结果。电离辐射诱发的甲状腺癌属于随机性效应,须做病因概率(PC)计算进行病因判断。ICRP第118号出版物给出了其他器官产生确定性效应的近似吸收剂量阈值(表6-14)。
表6-14 产生确定性效应的近似吸收剂量阈值
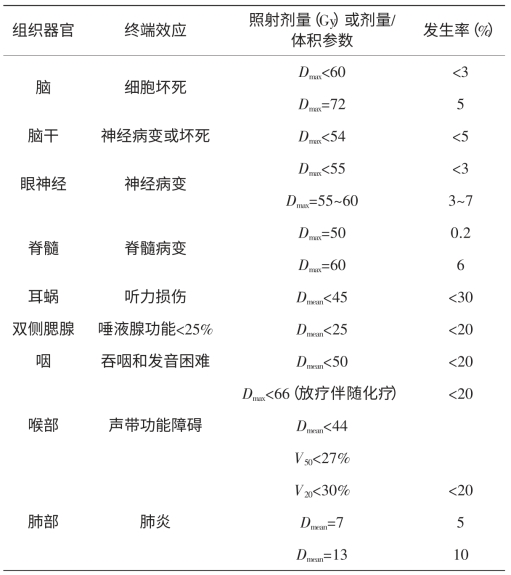
由于不同组织的敏感性不同,ICRP最新给出造血器官抑制的急性阈值剂量为0.5Gy,肠道急性照射的阈值剂量为6Gy(在6~9天死亡);眼晶状体和心血管系统的迟发效应阈剂量(无论是急性照射、分次照射还是慢性照射)均为0.5Gy,ICRP第118号出版物给出的器官辐射效应的阈剂量列于表6-15~17中。
表6-15 不同器官的辐射效应阈剂量(Gy)
续表

注:Dmax代表最大器官剂量,Dmean代表平均器官剂量,Dx代表最小剂量到器官最高剂量的x%,Vx代表被照射的器官体积。
表6-16 成年人急性或分次照射效应(1%发病率)的阈剂量
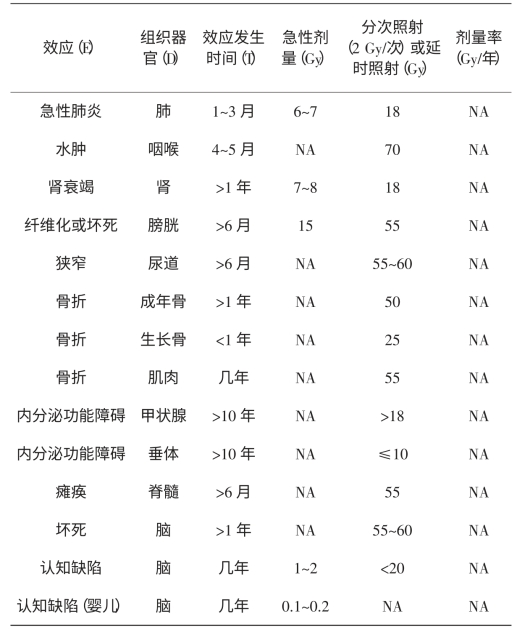
表6-17 成年人急性或分次照射死亡效应(1%死亡率)的阈剂
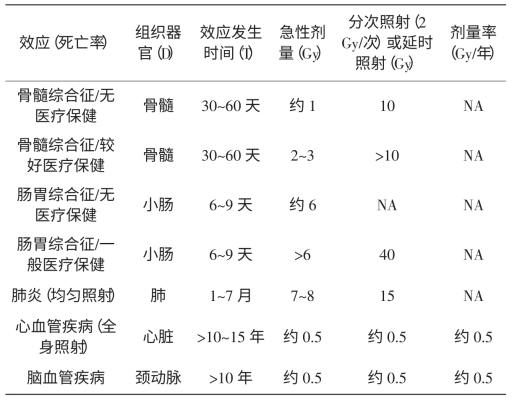
注:NA代表不可用。以上表中数据均来自2012年ICRP第118号出版物。
(五)电离辐射对寿命影响研究
长期以来人们一直关注电离辐射对寿命是否有影响,1945年日本原子弹爆炸后对93 000名原子弹爆炸幸存者和27 000名未接受电离辐射照射者进行终生对照研究,这是目前国际上研究人群最多的辐射流行病学调查之一,按照受照者接受的不同个人剂量,进行流行病学研究定出寿限和死亡原因进行比较,未发现明显的寿命差异不同。
但动物研究发现,小鼠受照后寿命缩短与受照剂量相关,每0.87Gy照射寿命可缩短约5%。日本平屿邦猛也报道,小鼠一次接受1Gy照射,可使平均寿命缩短5周,而且比未受照射的动物衰老得快。但电离辐射所致寿命缩短尚有争议,Warburg用60Coγ射线(0.067Gy/min)对10周龄雌性小鼠照射1~3Gy,在去除辐射诱发白血病、胸腺淋巴肉瘤和内分泌肿瘤以外,只考虑非肿瘤死亡原因时发现辐射诱发寿命缩短效应并不明显。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




