若系统由状态1出发经过某一过程到达状态2,系统再由状态2返回状态1时,原过程对外界产生的一切影响也同时消除,则由状态1到状态2的过程称为可逆过程,否则就是不可逆过程。
例如,一个理想气体系统由状态1(p1,V1,T)出发,按准静态等温膨胀过程到达状态2(p2,V2,T),如图9—7中1→2的曲线所示。假如在此过程中,不存在诸如摩擦力、黏性力等引起耗散效应的因素,那么过程1→2就是可逆过程。在此过程中,系统从外界吸收的热量QT全部用于对外界做功A,它们数值相等,则为
![]()
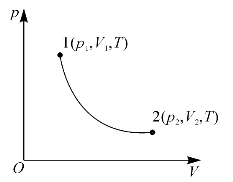
图9—7 准静态等温膨胀过程
若系统由状态2返回状态1,经历了与过程1→2相同的中间状态,即过程2→1,那么过程2→1一定是准静态等温压缩过程。在过程2→1中,外界对系统做功A',全部转变为系统向外界释放的热量Q'T,数值为
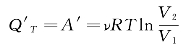 (https://www.xing528.com)
(https://www.xing528.com)
所以
Q'T=QT,A'=A
这表示,当系统由状态2返回状态1时,在原过程1→2中,系统从外界吸收的热量,又释放给了外界,系统对外界所做的功,外界又以等量的功归还给系统。系统和外界都恢复了原状,因此,过程1→2是可逆过程。
应该指出,可逆过程只要求在系统返回到初态时,原过程对外界产生的一切影响也同时消除,但并不要求必须沿原过程的相同路径反向返回。
由上面的讨论可见,可逆过程必须是准静态过程,而且必须是无耗散效应的过程。
准静态过程是一种进行无限缓慢的过程,以致过程所经历的每一个中间状态都接近于平衡态。可见,严格的准静态过程是不存在的,它只是一种理想状况。另外,无耗散效应的过程实际上也是不存在的。例如,当活塞移动时,必须克服汽缸壁对活塞的摩擦力而做功,这部分功将以热能的形式散发到周围的空气中。所以,无耗散效应的过程也只是一种理想状况。由此得到,严格的可逆过程实际上是不存在的。自然界中发生的一切与热现象有关的过程都是不可逆过程,热力学第二定律正是这种不可逆性的反映。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




