1.内能
在热力学中,我们把研究的对象(如气体、液体、固体等)叫作热力学系统,简称系统。在气体动理论中,我们从微观角度定义了系统的内能,它是系统内所有分子无规则热运动能量的总和。对于理想气体,分子之间的相互作用力可忽略,理想气体的内能仅是温度的单值函数。在热力学中,并不关注系统的微观结构,如何定义内能呢?实验证明,热力学系统的状态变化,总是通过外界对系统做功,或向系统传递热量,或两者兼施并用来完成的。当系统从状态a变化到状态b时,外界对系统所做的功与向系统所传递的热量的总和,只与系统的初、末状态有关,而与系统经历的过程无关。由此可见,热力学系统在一定状态下,应具有一定的能量,称为热力学系统的内能。它是系统状态的单值函数。当系统状态确定,其内能为确定的值,即内能是状态量。
当系统由一个状态变化到另一个状态时,内能的变化只与系统的初、末状态有关,而与中间过程无关,则有

若系统经历一系列过程又回到初态,我们称系统经历一循环过程,则系统内能的变化量为
![]()
2.功
热力学中功的计算仍然是用力学中功的定义。图9—1(a)为气体膨胀时推动活塞对外界做功,图9—1(b)为气体状态的变化过程。
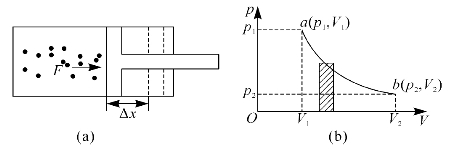
图9—1 气体膨胀对外做功
设气体的压强为p,活塞的横截面积为S,则气体对活塞的压力为F=pS,在无摩擦准静态条件下使活塞移动一微小位移Δx,则气体对外界做的功为
ΔA=FΔx=pSΔx=pΔV(https://www.xing528.com)
ΔA可用图9—1(b)中阴影部分的小面积来表示。系统由状态a变化到状态b的过程中对外界做的总功为
A=ΣΔA=ΣpΔV
当△V→0时,上述求和变成积分,即
![]()
图9—1(b)中ab曲线下面的面积即为气体在膨胀过程中对外界所做的总功,故图9—1(b)又被称为示功图。由图可以看出,当系统经历不同的过程,由状态a变化到状态b时,曲线下面的面积不同,系统所做的功也就不同。这说明系统所做的功不仅与系统的始末状态有关,而且还与过程有关,所以功是过程量。
由式(9—3)知,当气体膨胀时,体积增加,气体对外界做的功A>0,称气体对外界做正功;当气体被压缩时,体积减小,气体对外界做的功A<0,称气体对外界做负功。
3.热量
向系统传递热量也可以改变其内能。例如,把一壶冷水放到火炉上,炉火不断把能量传递给壶中的水,水的温度就会逐渐升高,内能增加。当温度不同的物体互相接触时,通过分子间的碰撞,传递分子无规则热运动的能量,最终使相互接触的物体达到相同的温度。因此,热传递的实质是通过分子间的相互作用,传递分子的热运动能量,从而改变系统的内能。
向系统传递的热量通常用Q表示,在国际单位制中,它的单位与功和内能的单位相同,都是焦耳(J)。
热量传递的方向可以用Q的正负表示。我们规定:当系统从外界吸收热量时,Q>0;当系统向外界放出热量时,Q<0。需要指出的是:热量与功一样是过程量。系统经历的过程不同,所传递的热量也不同。热量只在传热过程发生时有意义,因而不能说系统具有多少热量。
虽然做功和热量传递都能改变系统的内能,但它们在本质上是不同的。做功是将物体机械运动的能量转化成系统内分子热运动的能量,而热量传递是高温物体分子热运动能量通过分子间的相互作用传递给了低温物体。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




