在室温下,气体分子以平均每秒几百米的速率运动。由此看来,似乎在气体内发生的一切过程,都应该进行得非常迅速。比如,若打开一瓶香水,在室内各处应该立刻就能闻到香水的气味。但事实并非如此。经验告诉我们,两种不同气体的混合过程进行得非常缓慢,香水的气味要经过十几秒甚至更长的时间才能传播几米的距离,原因是分子在运动过程中与其他分子发生非常频繁的碰撞。
气体分子间的无规则碰撞对气体平衡态的性质有着十分重要的意义,气体分子按速率有一个稳定的分布以及分子平均能量按自由度均分都是靠碰撞来实现的。分子间的碰撞还在气体由非平衡态过渡到平衡态的过程中起着关键的作用,气体内部发生的许多物理现象和过程,如扩散、热传导和内摩擦等现象都与分子间碰撞的频繁程度有关。
由于气体分子运动的无规则性,一个分子在任意连续两次碰撞之间所经过的自由路程是不同的(见图8—10)。在一定的宏观条件下,一个气体分子在连续两次碰撞之间所可能经过的各段自由路程的平均值叫平均自由程(Mean Free Path),用λ表示。平均自由程的大小和分子的碰撞频繁程度有关。一个分子在单位时间内所受到的平均碰撞次数叫平均碰撞频率(Mean Collisional Frequency),用z表示。若气体分子的平均速率是![]() ,则在时间Δt内一个分子所经过的平均距离是
,则在时间Δt内一个分子所经过的平均距离是![]() ,而平均碰撞次数是zΔt。由于每一次碰撞都将结束一段自由程,所以平均自由程应该是
,而平均碰撞次数是zΔt。由于每一次碰撞都将结束一段自由程,所以平均自由程应该是
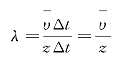

图8—10 气体分子的自由程
在处理分子碰撞问题时,可以把分子看作具有一定体积的弹性小球,而把两个分子可能靠近的最小距离d称为分子的有效直径。显然,分子的有效直径只是分子弹性球模型的直径,而非分子本身的线度。实验表明,d的数量级为10-10m。d与分子间的相对速率有关。为了计算z,我们可以设想跟踪一个分子,例如图8—11中的实心球A,计算它在时间Δt内与多少分子相碰。对碰撞来说,重要的是分子间的相对运动,为简便起见,可以先假设其他分子都静止不动,只有分子A在它们之间以平均相对速率![]() 运动,最后再修正。
运动,最后再修正。
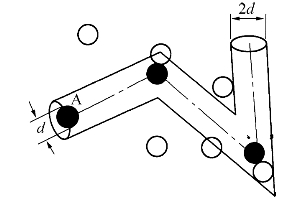
图8—11 气体分子的有效碰撞直径
在分子A运动过程中,只有其中心与A的中心间距小于或等于分子有效直径d的那些分子才有可能与A相碰。因此为了确定与A相碰的分子数目,可以设想以A的中心的运动轨迹为轴线,以分子有效直径d为半径画一个曲折的圆柱体,凡是中心在此圆柱体内的分子都会与A相碰。圆柱体的截面积叫作分子的碰撞截面(Collisional Cross Section),用σ表示,即
![]() (https://www.xing528.com)
(https://www.xing528.com)
在时间Δt内,A所走的路程为![]() ,相应的圆柱体的体积是
,相应的圆柱体的体积是![]() 。若分子数密度是n,则此圆柱体内的总分子数是
。若分子数密度是n,则此圆柱体内的总分子数是![]() ,这也是A与其他分子碰撞的次数,因此平均碰撞频率
,这也是A与其他分子碰撞的次数,因此平均碰撞频率
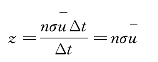
更详细的理论指出,气体分子的平均相对速率![]() 与平均速率面之间的关系是
与平均速率面之间的关系是
![]()
因此分子的平均碰撞频率
![]()
分子的平均自由程

这表明,分子的平均自由程与分子有效直径的平方以及分子数密度成反比,而与平均速率无关。电子管要抽成高真空就是要减少电子的平均碰撞频率,增加平均自由程,提高工作效率和质量。
海平面附近空气分子的平均自由程大约是10-7m,在100 km的高空约是0.16m,而在300km的高空约是2×104m。大气层顶部的氟利昂、二氧化碳和臭氧等气体含量是人们关心的共同话题,科学研究所面临的困难是无法找到足够大的容器来模拟高空的大气状态。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




