一、溶解性
所有的生物体系都含有水,大多数矿物质元素的传递和代谢都是以水作为媒介,在水溶液中进行的。因此,矿物质的生物利用率和活性在很大程度上与它们在水中的溶解性有关。在生物机体中,矿物质往往是与一些有机物质,如蛋白质、氨基酸、肽、糖类化合物、核酸和有机酸等结合形成配合物或螯合物,这样有利于矿物质的吸收和利用。而钙、镁、钡是同族元素,仅以+2价氧化态存在。虽然这一族的卤化物都是可溶的,但是其重要的盐,包括氢氧化物、碳酸盐、磷酸盐、草酸盐、硫酸盐和植酸盐都是极难溶解的。
二、酸碱性
任何矿物质都可以以其离子的形式存在。但从营养学的角度看,氟化物、碘化物和磷酸盐的阴离子是十分重要的。水中的氟化物成分比食物中更常见,其摄入量的多少主要因地理位置的不同而各异。碘以碘化物(I-)或碘酸盐 的形式存在。磷酸盐以多种不同的形式存在,如磷酸盐
的形式存在。磷酸盐以多种不同的形式存在,如磷酸盐 、磷酸氢盐
、磷酸氢盐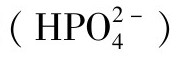 、磷酸二氢盐
、磷酸二氢盐 或磷酸(H3PO4)。各种微量元素参与的复杂生物过程,可以利用Lewis的酸碱理论解释,由于不同价态的同一元素,可以通过形成多种复合物来参与不同的生化过程,因而具有不同的营养价值。
或磷酸(H3PO4)。各种微量元素参与的复杂生物过程,可以利用Lewis的酸碱理论解释,由于不同价态的同一元素,可以通过形成多种复合物来参与不同的生化过程,因而具有不同的营养价值。
三、氧化还原性
碘化物和碘酸盐与食品中其他重要的无机阴离子(如磷酸盐、硫酸盐和碘酸盐)相比,是较强的氧化剂。阳离子比阴离子种类多,结构也更复杂,它们的一般化学性质可以通过其所在的元素周期表中的位置来考虑。有些金属离子从营养学的观点来说是重要的,而有些则是非常有害的毒性污染物,甚至产生致癌作用。碳酸盐和磷酸盐则比较难溶解。其他一些金属元素具有多种氧化态,如锡(+2价和+4价)、汞(+1价和+2价)、铁(+2价和+3价)、铬(+3价和+6价),锰(+2,+3,+4,+6和+7价),因为这些金属元素中有许多能形成两性离子,既可作为氧化剂,又可作为还原剂。如钼和铁最重要的性质是能催化抗坏血酸和不饱和脂质的氧化。微量元素的这些价态变化和相互转换的平衡反应,都将影响组织和器官中的环境特性,例如pH、配位体组成、电效应等,从而影响其生理功能。(https://www.xing528.com)
四、微量元素的浓度
微量元素的浓度和存在状态将会影响各种生化反应。许多原因不明的疾病(如癌症和地方病)都与微量元素的摄入有关。但实际上对必需微量元素的确认绝非易事,因为矿物元素的价态和浓度不同,导致排列的有序性和状态不同,因而对生物体的生命活动产生的作用也不同。
五、螯合效应
许多金属离子可作为有机分子的配位体或螯合剂,如血红素中的铁,细胞红色素中的铜,叶绿素中的镁以及维生素B12中的钴。具有生物活性结构的铬称为葡萄糖耐量因子(GTF),它是三价络合物。在葡萄糖耐量生物检测中,具有生物活性结构的铬比无机Cr3+的效能高出50倍。葡萄糖耐量因子中含有约65%的铬,此外还含有烟酸、半胱氨酸、甘氨酸和谷氨酸等,而Cr6+却没有生物活性。
金属离子的螯合效应与螯合物的稳定性受其本身的结构和环境因素的影响。一般五元环和六元环螯合物比其他更大或更小的环境稳定。金属离子的Lewis碱性也会影响其稳定性,一般碱性越强螯合物就越稳定。此外,带电荷的配位体有利于形成稳定的螯合物。不同的电子供给体所形成的配位键强度不同,对氧来说,H2O>ROH>R2H;氮应为H3N>RNH2>H2S。另外,分子中的共轭结构和立体位阻有利于螯合物的稳定。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




