一、蛋白质的结构
蛋白质分子是由许多氨基酸通过肽键连接而成的生物大分子。每种蛋白质都具有一定氨基酸数量及氨基酸排列顺序,以及多肽链在空间的特定排布。每种蛋白质具有独特生理功能的结构基础是氨基酸排列顺序及多肽链的空间排布。蛋白质的分子量一般都较大,组成蛋白质的氨基酸大约有20种,因此蛋白质分子中氨基酸排列顺序和空间位置几乎是无穷尽的,足以为成千上万种蛋白质提供不同的序列和特定的空间排布,从而完成生命所赋予的数以千万计的生理功能。我们将蛋白质的分子结构分为一级结构、二级结构、三级结构和四级结构4个层次,后三者统称为高级结构或空间构象。蛋白质的空间构象涵盖了蛋白质分子中的每一原子在三维空间的相对位置,它们是蛋白质特有性质和功能的结构基础。但是,并非所有的蛋白质都有四级结构,仅由一条多肽链构成的蛋白质只具有一级、二级和三级结构,只有由二条或二条以上多肽链构成的蛋白质才可能具备完整的四级结构。
(一)一级结构
蛋白质的一级结构(primary structure)也称作蛋白质的共价结构,它是指蛋白质中氨基酸的数目和排列顺序及其共价连接。一级结构是蛋白质分子的基本结构。但是这个概念仅适用于只含有氨基酸的简单蛋白质。在生物体内还有很多的结合蛋白质,它们的分子结构中除了含有氨基酸外,还有其他的组分,比如糖类、脂类等。对于结合蛋白质,其完整的一级结构的概念应该是包括多肽链及多肽链以外的其他的成分(如糖蛋白上的糖链,脂蛋白中的脂类的部分等)以及这些非肽链部分的连接方式和位点。蛋白质的一级结构是一个无空间概念的一维结构。
在蛋白质多肽链中,带有游离氨基的一端被称作为N-端,而带有游离羧基的一端则称作C-端。目前,许多蛋白质的一级结构已经确定,例如胰岛素、血红蛋白、酪蛋白等。少数蛋白质中氨基酸残基数目为几十个,大多数的蛋白质含有100~500个氨基酸残基,也有一些不常见的蛋白质含有多达数千个氨基酸残基。
图3-4为牛胰岛素的一级结构。牛胰岛素的一级结构中含有A链和B链二条多肽链,A链含有21个氨基酸残基,B链含有有30个氨基酸残基。牛胰岛素分子的一级结构中总共形成3个二硫键,其中1个二硫键位于A链内部,由A链的第6位和第11位半胱氨酸的巯基氧化脱氢而形成,另外2个二硫键均形成于A链和B链之间。
图3-4 牛胰岛素的一级结构
蛋白质的一级结构是决定其空间结构的基础,而空间结构则是其实现生物学功能的基础。尽管各种蛋白质的基本结构都是多肽链,但所含氨基酸的数目、各种氨基酸所占构成比例、氨基酸在肽链中的排列顺序的不同,就形成了结构多种多样、功能各异的蛋白质。因此,蛋白质一级结构的研究,是在分子水平上阐述蛋白质结构与其功能关系的基础。
(二)二级结构
蛋白质的二级结构(secondary structure)是指蛋白质分子多肽链骨架中原子的局部空间排列,不涉及氨基酸残基侧链的构象(conformation)。蛋白质的二级结构的常见类型包括α-螺旋、β-折叠、β-转角和无规卷曲。
1.α-螺旋
α-螺旋(α-helix)是存在于各种天然蛋白质中的一种特定的螺旋状肽链立体结构,是蛋白质中最常见、最典型、含量最丰富的二级结构元件。α-螺旋结构如图3-5所示。
图3-5 α-螺旋结构示意图
α-螺旋的结构特点如下:
①在α-螺旋结构中,多肽链通过链内的多个肽平面上的α-碳原子旋转,紧密盘绕成稳固的右手螺旋,每圈螺旋有3.6个氨基酸残基,氨基酸残基位于螺旋的外侧,螺旋的表观直径为0.6 nm,螺旋之间的距离为0.54 nm,相邻的2个氨基酸残基的垂直距离为0.15 nm。
②在α-螺旋结构中,相邻两圈螺旋通过肽键中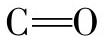 和NH形成许多链内氢键,即每一个氨基酸残基中的NH和前面相隔三个残基的
和NH形成许多链内氢键,即每一个氨基酸残基中的NH和前面相隔三个残基的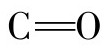 之间形成氢键。肽链中的全部肽键都可以形成氢键,这是稳定α-螺旋的主要因素。氢键的方向与螺旋的长轴基本平行。
之间形成氢键。肽链中的全部肽键都可以形成氢键,这是稳定α-螺旋的主要因素。氢键的方向与螺旋的长轴基本平行。
③在α-螺旋结构中,肽链中氨基酸侧链R分布于螺旋外侧,侧链R的形状、大小和所带电荷均会影响α-螺旋的形成。其中,酸性或碱性氨基酸集中的区域,由于同性电荷相斥,不利于α-螺旋形成;较大的R基(如苯丙氨酸、色氨酸、异亮氨酸)集中的区域,也不利于α-螺旋的形成;脯氨酸分子结构中由于α-碳原子位于五元环上,不易扭转,α-亚氨基存在的部位也不易形成氢键,所以脯氨酸也不利于上述α-螺旋的形成;甘氨酸的R基为H,空间占位很小,同样不利于维持该处螺旋的稳定性。
2.β-折叠
β-折叠(β-pleated sheet)也称β-片层(β-sheet),是蛋白质中常见的二级结构,它由伸展的多肽链组成的。β-折叠的构象是通过一个肽键的羰基的氧和位于同一个肽链的另一个亚氨基的氢之间形成的氢键来维持的。氢键形成的方向几乎都垂直于伸展的肽链。β-折叠结构如图3-6所示。
图3-6 β-折叠结构示意图
β-折叠的结构特点如下:
①在β-折叠结构中,多肽链得到充分伸展,肽链平面之间折叠成锯齿状,同一条多肽链上相邻肽键平面间呈110°夹角。多肽链中氨基酸残基的R侧链均向外伸出分别位于折叠面的上方或下方。
②在β-折叠结构中,分子依靠两段肽链间的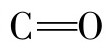 和NH形成氢键,使蛋白质构象趋于稳定。
和NH形成氢键,使蛋白质构象趋于稳定。
③在β-折叠结构中,两段多肽链有顺向平行的,也有逆向平行的。前者两条链从“N-端”到“C-端”是同方向的,后者是反方向的。顺向平行的β-折叠结构中,形成氢键的两个残基间距为0.65 nm;逆向平行的β-折叠结构中,形成氢键的两个残基间距则为0.70 nm。β-折叠的形成通常与结构蛋白质的空间结构有关,但在有些球状蛋白质的空间结构中也存在。例如,天然丝蛋白中就同时存在β-折叠和α-螺旋,溶菌酶、羧肽酶等球状蛋白中也都存在β-折叠结构。
3.β-转角
在蛋白质的分子结构中,多肽链通常会在空间结构中出现180°的回折,这种回折处的构象就称为β-转角(β-turn)。在β-转角结构中,第一个氨基酸残基的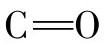 与第四个氨基酸残基的NH之间形成氢键,从而使结构稳定,如图3-7所示。其中,β-转角结构中第二个氨基酸残基通常为脯氨酸,除此之外,甘氨酸、天冬氨酸、天冬酰胺和色氨酸也都常常出现在β-转角的位置。β-转角结构常存在于球状蛋白质分子的表面,与蛋白质的生物学功能有关。
与第四个氨基酸残基的NH之间形成氢键,从而使结构稳定,如图3-7所示。其中,β-转角结构中第二个氨基酸残基通常为脯氨酸,除此之外,甘氨酸、天冬氨酸、天冬酰胺和色氨酸也都常常出现在β-转角的位置。β-转角结构常存在于球状蛋白质分子的表面,与蛋白质的生物学功能有关。
图3-7 β-转角结构示意图
4.无规卷曲
大部分蛋白质,尤其是球状蛋白质,通常包含几种有规律的二级结构,如上面提到的α-螺旋和β-折叠,但蛋白质多肽链中还包含一部分难以确定规律的肽链构象,我们通常把它称作无规卷曲(random coil)。
在蛋白质的构象中,还存在着二级结构与三级结构之间的一个层次,称为超二级结构(supersecondary structure)。它是指在多肽链内顺序上相互邻近的二级结构常常在空间折叠中靠近,彼此相互作用,形成规则的二级结构聚集体。目前,发现的蛋白质超二级结构有三种形式:α-螺旋组合(αα)、β-折叠组合(βββ)和α-螺旋β-折叠组合(βαβ),其中以βαβ组合最为常见。
(三)三级结构
蛋白质的三级结构(tertiary structure)是指在二级结构的基础上,多肽链借助多种作用力,进一步折叠卷曲形成紧密的复杂球形分子的结构。蛋白质的三级结构如图3-8所示。
稳定蛋白质三级结构的作用力主要是次级键,包括氢键、疏水作用、离子键及范德瓦耳斯力等。其中,疏水作用是最主要的稳定作用力。疏水作用是蛋白质分子中疏水基团之间的结合力。酸性和碱性氨基酸的R基团可以带电荷,正负电荷相互吸引形成离子键。与氢原子共用电子对形成的键则为氢键。稳定蛋白质三级结构的这些作用力可存在于一级结构序号相隔很远的氨基酸残基的R基团之间。而这些作用力都属于非共价键,因此易受环境中pH、温度、离子强度等因素的影响,有变动的可能性。二硫键虽然不属于次级键,但是它在稳定蛋白质三级结构中也起着重要的作用,因为在某些多肽链中它能使相隔较远的两个肽段联系在一起。
一些具备三级结构的蛋白质,如血浆清蛋白、球蛋白、肌红蛋白等属于球状蛋白,球状蛋白的疏水基团多聚集在分子的内部,而亲水基团则多分布于分子的表面,所以球状蛋白是亲水的。更重要的是,多肽链经过盘曲形成三级结构后,可形成具有某些生物功能的特定区域,如酶的活性中心。
图3-8 蛋白质三级结构示意图
蛋白质三级结构包括蛋白质分子主链的构象和分子中各个侧链所形成的一定的构象。其中,侧链构象是指形成的结构域。结构域(domain)是蛋白质构象中特定的空间区域。在分子较大的蛋白质中,多肽链上相邻的超二级结构紧密联系,就能形成两个或多个稳定的球形结构单位。一般每个结构域由100~200个氨基酸残基组成,有着各自的独特的空间结构,并承担着不同的生物学功能。
(四)四级结构
蛋白质的四级结构(quaternary structure)是指一些具有特定的三级结构的肽链通过非共价键形成大分子体系的组合方式,是含有两条及以上多肽链的蛋白质的空间排列。构成蛋白质四级结构的每一条具有完整三级结构的多肽链,称为蛋白质的亚基(subunit)。构成蛋白质的亚基的分子结构可以相同,也可以不同。蛋白质的四级结构如图3-9所示。
图3-9 蛋白质四级结构示意图
在蛋白质的四级结构中,亚基之间的作用力不含有共价键,各亚基之间的作用力主要是氢键和疏水作用。一种蛋白质中所含疏水性氨基酸的摩尔比例高于30%时,它形成的四级结构的倾向大于含较少疏水性氨基酸的蛋白质。
蛋白质从一级结构到四级结构的形成过程如图3-10所示。
图3-10 蛋白质结构形成示意图
二、维持和稳定蛋白质结构的作用力
蛋白质是生物大分子,结构复杂,种类繁多。它同任何分子一样,只有在分子内部存在某些特定的相互作用时,分子中一些原子或基团间的相对位置才能被固定,呈现出完整、稳定的立体结构。维持和稳定蛋白质结构的作用力主要有:
1.肽键
在蛋白质分子的多肽链中,一个氨基酸的α-羧基和另外一个氨基酸的α-氨基之间脱去一分子水,缩合就能形成肽键(peptide bond)。肽键是蛋白质一级结构的主要作用力。肽键的结构如图3-11所示。
图3-11 肽键的结构
肽键中的C—N键具有部分双键的性质,其键长为0.132 nm,介于单键和双键之间,不能自由旋转。组成肽键的C、O、N、H这4个原子和与之相邻的2个α-碳原子(Cα1和Cα2)均位于同一肽平面内,构成肽单元(peptide unit)。肽单元中Cα分别与N和羰基C相连的键都是典型的单键,可以自由旋转。肽单元上的Cα所连的两个单键的自由旋转角度,决定了两个相邻的肽单元平面的相对空间位置。
2.二硫键
二硫键是由两个半胱氨酸残基中的巯基氧化后以共价键的方式连接在一起而形成的。二硫键也是维系蛋白质一级结构的主要作用力。二硫键存在于蛋白质分子多肽链的链内和链间,二硫键数目越多,则蛋白质抵抗外界不利因素的能力越强。在生物体内,具有保护作用的角蛋白含二硫键数目最多。某些二硫键是蛋白质形成生物活性所必需的,这些二硫键被还原后,将引起蛋白质天然构象的改变和生物活性的丧失。
3.氢键
氢键是指具有孤电子对的电负性原子,如N、O和S等,与一个H原子结合形成的键,而H原子本身同时又与另一个电负性的原子以共价方式结合。在蛋白质分子中,一个肽键的羰基和另一个肽键的N—H的氢形成氢键。氢键距离O……H约为0.175 nm,键能为8~40 kJ/mol,键能的大小取决于参与氢键的电负性原子的性质和形成的键角。氢键是蛋白质空间结构的主要作用力。
蛋白质多肽链骨架中亚氨基团的氢,色氨酸侧链吲哚环上和氮原子连接的氢,组氨酸侧链咪唑环上和氮原子连接的氢,酪氨酸侧链酚基上的氢,还有一些酸性氨基酸的羧基的氢和酰胺基上的氢,以及侧链羟基上的氢都能与羰基和许多极性基团相互作用形成氢键。在具有α-螺旋和β-折叠结构的多肽键中,其N—H和羰基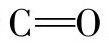 之间形成氢键的数量最多。氢键的稳定性与环境的介电常数有关。蛋白质分子中氨基酸残基的庞大侧链能阻止水与N—H和羰基
之间形成氢键的数量最多。氢键的稳定性与环境的介电常数有关。蛋白质分子中氨基酸残基的庞大侧链能阻止水与N—H和羰基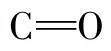 接近形成氢键,从而维持着蛋白质二级结构中氢键的稳定性。
接近形成氢键,从而维持着蛋白质二级结构中氢键的稳定性。
4.离子键
离子键,也称盐键,是由正负离子之间的静电引力所形成的化学键。蛋白质分子中,有带正、负电荷的基团如羧基、氨基、咪唑基等,在空间结构和环境适宜的情况下,就能形成离子键。大多数情况下,这些基团分布在蛋白质分子表面,与水分子发生电荷—偶极作用,形成排列有序的水化层,从而稳定蛋白质在水溶液中的构象。高浓度的盐、过高pH或过低pH等条件,都可以破坏蛋白质构象中的离子键,这就是强酸、强碱致使蛋白质发生变性的原因。
5.范德瓦耳斯力
范德瓦耳斯力包括三种较弱的作用力,即定向力、诱导力、分散力,它们都是静电引力。定向力发生在极性分子(或基团)与极性分子(或基团)之间。极性分子具有偶极,而偶极与偶极之间的相互吸引使相反的极相对。诱导力是指极性分子(或基团)的偶极与非极性分子(或基团)的诱导偶极之间的相互吸引。分散力是指非极性分子(或基团)瞬时偶极之间的相互吸引,是大多数情况下起主要作用的范德瓦耳斯力。分子或基团中电子电荷密度的波动即电子运动的不对称性会造成瞬时偶极,范德瓦耳斯力可以诱导周围的分子或基团产生诱导偶极,诱导偶极反过来又稳定了原来的偶极,因此在它们之间产生了相互作用。
范德瓦耳斯力非常微弱,键能只有0.4~4 kJ/mol,但是,它在蛋白质分子中大量存在,它是形成和维持蛋白质三级、四级结构的非常重要的作用力。
6.疏水作用力
在水溶液中,蛋白质非极性侧链的氨基酸残基彼此可以紧密靠近,形成的疏水结构往往藏在蛋白质分子的内部,从而避开与水分子的接触,这种现象叫作疏水作用力。实际上,许多亲水的球状蛋白质的三级结构,就是大量非极性基团聚集在内部,极性基团分布于蛋白质分子表面的球形结构。疏水基团的聚集是一个有序化的过程,如果想破坏这种聚集结构,使蛋白质分子展开并与水分子充分接触,就需要外界提供能量。疏水作用力也是维持蛋白质三级、四级结构稳定的重要因素。
维持蛋白质构象的作用力如图3-12所示。
图3-12 维持蛋白质构象的作用力
a—离子键b—氢键c—疏水作用力d—范德瓦耳斯力e—二硫键力
三、蛋白质的理化性质
蛋白质分子是由氨基酸组成的,其理化性质有一部分与氨基酸相似或相关。例如,酸碱性及等电点、紫外吸收性质、呈色反应等。除此之外,蛋白质还具有胶体性质、沉淀性、水解性和疏水性等其他功能性质。
(一)蛋白质的酸碱性
蛋白质同氨基酸一样,也属于两性电解质,它能同酸或者碱发生反应。蛋白质可离解基团除了C-末端的a-羧基和N-末端的a-氨基外,其他的可离解基团主要来自蛋白质分子的侧链,因此,蛋白质相当于一个多价离子,其所带电荷的性质和数量与分子中可离解基团的含量、分布有关,同时也与溶液的pH有关。蛋白质分子在某一个pH时所带电荷数为零,这就是它的等电点pI。在pH>pI的介质中,蛋白质作为阴离子在电场中可向阳极移动;而在pH<pI的介质中,蛋白质则作为阳离子向阴极移动;在pH=pI的介质中,蛋白质在电场中不运动,此时蛋白质的溶解度也最低。
(二)蛋白质的水解
蛋白质在酸、碱或酶的催化作用下,发生肽键断裂,最终完全水解生成氨基酸。在水解的过程中,随着水解程度的不同,反应会生成不同的中间产物,主要是蛋白胨和各种不同长度的肽类。
蛋白质→蛋白胨→小肽→二肽→氨基酸
蛋白质在酸水解过程中,得到的色氨酸会被破坏;蛋白质发生碱水解时,胱氨酸、半胱氨酸、精氨酸等遭到破坏,还会引起氨基酸的外消旋化。而蛋白质的酶水解较为理想,它对氨基酸的破坏较小。但是,酶水解的反应速度较慢,要将蛋白质彻底水解往往还需要一系列酶的共同作用。
(三)蛋白质的颜色反应
蛋白质分子中的肽键和许多侧链基团都可以与一些特定的试剂发生呈色反应。这些呈色反应常用于蛋白质的定性和定量检测。
1.双缩脲反应
在蛋白质的颜色反应中,双缩脲反应(biuret reaction)是一个重要的颜色反应。双缩脲反应的原理是在碱性溶液中,蛋白质或三肽及以上的分子均可与Cu2+发生双缩脲反应,生成紫红色络合物。因为氨基酸的分子中没有肽键,二肽分子中只含有一个肽键,故不能发生此反应。因此,双缩脲反应可用于检测蛋白质的水解程度。反应如图3-13所示。
图3-13 双缩脲反应
2.酚试剂反应
酚试剂呈色反应是最为常用的蛋白质定量方法(Lowry法)。蛋白质分子中的色氨酸与酪氨酸残基可将试剂中的磷钨酸和磷钼酸盐还原生成蓝色化合物(钼蓝)。酚试剂法灵敏度很高,可用于蛋白质的定性和定量检测。
3.茚三酮反应
茚三酮反应也是蛋白质的一个重要颜色反应,在pH=5~7条件下,蛋白质与水合茚三酮溶液共热,可生成蓝紫色的化合物(图3-14)。
图3-14 茚三酮反应
4.黄色反应
含有芳香族氨基酸,特别是酪氨酸和色氨酸的蛋白质在溶液中与硝酸反应,先产生白色沉淀,加热白色沉淀则变成黄色,再加入碱,颜色变深至橙黄色。这也是皮肤、毛发、指甲遇到浓硝酸变黄的原因。
5.米伦反应
米伦试剂为硝酸汞、亚硝酸汞、硝酸和亚硝酸的混合液。蛋白质溶液中加入米伦试剂后即产生白色沉淀,加热后沉淀变成红色。由于酪氨酸分子结构中含有酚基,故酪氨酸及含有酪氨酸的蛋白质都能发生此反应。
(四)蛋白质的疏水性
蛋白质有它自身的疏水性,理论上,已知一种蛋白质的氨基酸组成,就可以根据各氨基酸的疏水性确定蛋白质的平均疏水性,即各氨基酸的疏水性加和后与总氨基酸数的比值。
蛋白质的表面疏水性(或表观疏水性,surface hydrophobicity)是一个重要的物理化学常数。蛋白质的表面疏水性与蛋白质的空间结构、蛋白质所呈现的表面性质和与脂肪结合能力等有重要的关系,更能反映出蛋白质同水、其他化学物质的作用。
四、蛋白质的功能性质
在食品加工、制备、保藏和消费期间凡是能够影响蛋白质在食品体系中的性能的那些蛋白质的物理和化学性质都被称为蛋白质的功能性质(functional property)。例如,蛋白质的胶凝、溶解、泡沫、乳化、黏度等。蛋白质功能性质大多数影响着食品的感官质量,尤其是在质地方面,也对食品成分制备、食品加工或储存过程中的物理特性起着重要的作用。各种蛋白质在不同食品中的功能作用如表3-7所示。
表3-7 蛋白质在食品中的功能作用
蛋白质的功能性质是多样的,它们对不同食品的不同品质起着决定性的作用。各种食品中蛋白质的功能性质如表3-8所示。
表3-8 各种食品中蛋白质的功能性质
(一)水合性质
大多数食品是水合(hydration)的固体体系,食品中各种组成成分的物理化学性质和流变学特性会受到体系中水的影响和水与食品中其他组成成分的相互作用的影响。蛋白质在溶液中的构象主要取决于它和水之间的相互作用,水能改变蛋白质的物理、化学性质,如具有无定形和半结晶性质的食品蛋白质,水的增塑作用可以改变它们的玻璃化转变温度Tg和变性温度Td。此外,在食品加工过程中,浓缩蛋白质或分离蛋白的应用,都涉及蛋白质的水合过程。蛋白质吸附水、保留水的能力,不仅能影响蛋白质的黏度和其他性质,还能影响食品的质地,影响最终产品的质量。
蛋白质制品的许多功能特性都与水合作用有关,例如水吸收作用、溶解性、溶胀、润湿性、增稠性、黏度、持水容量(或水保留作用)、黏附和内聚力,以及聚集、乳化、起泡性等,都与水合作用的过程有关。
1.蛋白质—水相互作用
蛋白质的水合作用指的是蛋白质的肽键(偶极—偶极或氢键),或氨基酸侧链(离子的极性甚至非极性基团)同水分子之间的相互作用。蛋白质的水合作用,通常以持水力(water holding capacity)或保水性(water retention capacity)来衡量。蛋白质的持水力是指蛋白质将水截留(保留)在其组织中的能力,被截留的水包括吸附水、物理截留水和流体动力学水。由于氨基酸组成不同,所以不同蛋白质的水合能力也不同。研究表明,分子中含有极性基团的极性氨基酸、离子化的氨基酸、蛋白质盐等对水有更强的结合能力,所以它们的结合水量相对较大。
2.水合性质的测定方法
蛋白质的水合性质对食品品质有着十分重要的作用。实验室测定食品蛋白质的吸水性和持水容量的方法通常有以下4种。
①相对湿度法(或平衡水分含量法)。相对湿度法是测定保持在某一水分活度Aw时,食品所吸收的水量的方法。这种方法在食品中可用于评价蛋白粉的吸湿性和结块现象。
②溶胀法。溶胀法是通过将蛋白质粉末置于下端连有刻度的毛细管的烧结玻璃过滤器上,让其自发地吸收过滤器下面毛细管中的水,即可测定水合作用的速率和程度的方法。
③过量水法。过量水法是使蛋白质试样同超过蛋白质所能结合的过量水接触,随后通过过滤或低速离心或挤压使过剩水同蛋白质保持的水分离的方法。这种方法只适用于溶解度低的蛋白质。用于可溶性蛋白质测定时必须进行校正。
④水饱和法。水饱和法是指测定蛋白质饱和溶液所需要的水量(用离心法测定对水的最大保留性)的方法。
3.影响水合性质的因素
蛋白质的浓度、pH、温度、离子强度、其他成分等,均能影响蛋白质—蛋白质和蛋白质—水的相互作用。蛋白质总水吸附量随蛋白质浓度的增加而增加,而在等电点时蛋白质表现出最小的水合作用,这是由于在等电点条件下蛋白质—蛋白质的相互作用达到最大,蛋白质分子所带的净电荷数最少,蛋白质同水的作用最小。
pH的变化影响蛋白质分子的解离和净电荷量,因而可改变蛋白质分子间的相互吸引力和排斥力及其与水缔合的能力。在等电点时,蛋白质—蛋白质相互作用最强,蛋白质的水合作用和溶胀最小。例如,宰后僵直前的生牛肉(或牛肉匀浆)pH从6.5下降到接近5.0(等电点),其持水容量显著减少,并导致肉的汁液减少和嫩度降低。
温度的变化会影响蛋白质的氢键作用和离子基团结合水的能力,从而影响蛋白质结合水的能力。蛋白质结合水的能力一般随温度升高而降低。蛋白质加热时发生变性和聚集,聚集可以减少蛋白质的表面面积和极性氨基酸对水结合的有效性,因此,变性后聚集的蛋白质结合水的能力因蛋白质之间相互作用而下降。
离子的种类和浓度对蛋白质的吸水性、溶胀和溶解度也有很大影响。盐类和氨基酸侧链基团通常同水发生竞争性结合。在低盐浓度(<0.2 mol/L)时,蛋白质的水合作用增强,这是由于水合盐离子与蛋白质分子的带电基团发生微弱结合的原因,但是这样低的浓度不会对蛋白质带电基团的水合层带来影响。实质上,增加的结合水量是来自与蛋白质结合离子的缔合水。高盐浓度时,水和盐之间的相互作用超过水和蛋白质之间的相互作用,因而引起蛋白质“脱水”。
4.水合作用和蛋白质其他功能性质之间的关系
蛋白质的其他功能如胶凝、乳化作用也与蛋白质的水合性质存在密切的关系。在食品实际加工中,对于蛋白质的水合作用,通常以持水力或保水性来衡量。持水力是指蛋白质将水截留(或保留)在其组织中的能力,持水力与蛋白质的水合作用有关,会影响到食品特别是肉制品和面团的嫩度、多汁性、柔软性。因此持水力对食品品质具有更重要的实际意义。
(二)溶解性
蛋白质作为有机大分子化合物,在水中以分散态存在,因此,蛋白质在水中无严格意义上的溶解度,只是将蛋白质在水中的分散量或分散水平相应地称为蛋白质的溶解度(solubility)。蛋白质溶解度的大小在食品加工过程中非常重要,因为溶解度特性数据在确定天然蛋白质的提取、分离、纯化时是非常有用的,蛋白质的变性程度也可以以蛋白质的溶解行为的变化作为评价指标。溶解度也是评价蛋白质饮料的一个主要特征。
1.溶解性的表示方法
蛋白质溶解度的常用表示方法为蛋白质分散指数(protein dispersibility index, PDI)、氮溶解指数(nitrogen solubility index, NSI)、水可溶性氮(water soluble nitrogen, WSN)。
PDI=(水分散蛋白质/总蛋白质)×100%
NSI=(水溶解氮/总氮)×100%
WSN=(可溶性氮的质量/样品质量)×100%
2.影响蛋白质溶解性质的因素(https://www.xing528.com)
蛋白质溶解度的大小受到pH、离子强度、温度、溶剂类型等因素的影响。影响蛋白质溶解性质的因素主要有:
(1)氨基酸组成与疏水性
蛋白质分子中氨基酸的疏水性和离子性是影响蛋白质溶解性的主要因素。疏水相互作用增强了蛋白质与蛋白质的相互作用,使蛋白质在水中的溶解度降低。离子相互作用则有利于蛋白质—水相互作用,可使蛋白质分散在水中,从而增大了蛋白质在水中的溶解度。蛋白质的溶解度与氨基酸残基的平均疏水性和电荷频率有关,平均疏水性越小或电荷频率越大,蛋白质的溶解度也就越大。
(2)pH的影响
蛋白质的溶解度在等电点pI时通常是最低的,pH在高于或低于等电点pI时,蛋白质所带的净电荷为负电荷或正电荷,其溶解度均增大。但是,蛋白质的种类不同,其在等电点pI时的溶解度也会各异。一些蛋白质如酪蛋白、大豆蛋白在等电点时几乎不溶,而乳清蛋白在等电点时的溶解性仍然很好。利用大多数蛋白质在pH为8~9时具有很高的溶解性,可提取植物蛋白。例如,将大豆粉置于pH为8~9的碱性水溶液中浸提,然后利用等电点沉淀法将pH调至4.5~4.8,再从提取液中回收大豆蛋白质。
(3)离子强度的影响
不同浓度的盐溶液对蛋白质的溶解性会产生不同的影响。当中性盐溶液浓度为0.1~1 mol/L时,它可增大蛋白质在水中的溶解度,叫作盐溶(salting in),此时蛋白质的溶解性与离子强度有关。而当中性盐溶液的浓度大于1 mol/L时,它会降低蛋白质在水中的溶解度甚至使蛋白质产生沉淀析出,叫作盐析(salting out)。
(4)温度的影响
在一定的pH和离子强度条件下,蛋白质的溶解度在0~40℃会随着温度的升高而增大。但是,对于高疏水性蛋白质,它们的溶解度的变化则与温度呈负相关。例如β-酪蛋白和某些谷蛋白,在温度超过40℃时,其分子运动足以使稳定的二级和三级结构的键断裂,这种变性就会伴随着分子聚集现象的发生而发生。
大多数蛋白质在较高温度条件下处理时,溶解度会发生明显的不可逆降低。但是,有时为了杀灭微生物,钝化微生物体内的酶,去除异味、水分和其他成分,加热处理又是不可或缺的。
(5)有机溶剂的影响
有机溶剂同样会影响蛋白质的溶解性。一些有机溶剂如丙酮、乙醇等,可降低蛋白质溶液中水的介电常数,使得蛋白质分子内和分子间的静电作用力提高。蛋白质分子内的静电排斥作用使得蛋白质分子伸长,有利于肽链基团的暴露和分子间氢键的形成,并促使分子间的异种电荷产生静电吸引。这些分子间的极性相互作用,促使蛋白质在有机溶剂中聚集沉淀或在水介质中溶解度降低。
(三)黏度
溶液的黏度(viscosity)反映了溶液对流动的阻力情况。一般用黏度系数μ表示一种液体的黏度大小。蛋白质溶液的黏度是蛋白质在食品加工中增稠能力的指标。通常,在加工处理中高温杀菌、pH的改变、蛋白质的水解、无机离子的存在等都会严重影响蛋白质溶液的黏度。
τ=μ·γ=μ·v/d
式中:τ为液体流动时的剪切力;γ为液体流动时的剪切速率;v为板块的运动速率;d为两个板块间的距离。
影响蛋白质流体黏度特性的主要因素是分散蛋白质分子或颗粒的表观直径。表观直径的变化受以下参数的影响:
①蛋白质分子的固有特性,如蛋白质分子的分子大小、体积、结构、电荷数及浓度等。
②蛋白质和溶剂(水)分子间的相互作用情况。
③蛋白质分子间的相互作用力。
任何影响蛋白质黏度的因素,都会影响到蛋白质分子的表观直径大小。
蛋白质溶液的黏度系数会随其流速的增大而降低,这种现象称为“剪切稀释”(shear thinning)。该现象产生的原因为:
①蛋白质分子运动方向取向逐渐一致,使液体流动时的摩擦阻力降低。
②蛋白质的水合环境在运动方向产生形变。
③氢键和其他弱的键断裂,使得蛋白质的聚集体、网状结构离解,蛋白质体积减小。
当溶液流动时,蛋白质中弱的作用力的断裂通常是缓慢发生的,因此蛋白质流体在达到平衡之前,其表观黏度随时间的增加而降低。当剪切停止时,原来的聚集体可能重新形成,但黏度系数不会降低,如乳清蛋白浓缩物和大豆分离蛋白。
蛋白质体系的黏度、稠度是流体食品如饮料、肉汤、汤汁等食品的主要功能性质,它影响着食品的品质、质地,对于蛋白质食品的输送、混合、加热和冷却等加工过程也有实际意义。
(四)胶凝作用
蛋白质的胶凝作用(gelation)是指变性的蛋白质分子聚集并形成有序的蛋白质网络结构的过程。蛋白质的胶凝作用与蛋白质的缔合、聚集、沉淀、絮凝和凝结等都属于蛋白质分子在不同水平上的聚集变化,但它们相互之间有一定的区别。蛋白质的缔合(association)一般是指在亚基或分子水平上的变化;聚合(polymerization)或聚集(aggregation)是指有较大的聚合物生成;沉淀(flocculation)是指由于蛋白质溶解度部分或全部丧失而引起的一切聚集反应;絮凝(precipitation)指蛋白质没有变性时所发生的无序聚集反应;凝结(coagulation)是变性蛋白质所产生的无序聚集反应。
蛋白质通过胶凝作用形成的凝胶具有三维网状结构,它是蛋白质—蛋白质之间的相互作用(氢键、疏水相互作用),蛋白质—水之间的相互作用以及邻近肽键之间的吸引力和排斥力这3类作用力达到平衡时的产物。蛋白质凝胶可以容纳其他的成分和组分,对食品的外观、形态、质地等方面具有重要作用,如肉类食品,不仅可以形成黏弹性质地,同时还具有保水、稳定脂肪、黏结等作用。热处理通常是蛋白质凝胶形成的重要过程,随后的冷却过程中,酸化有助于凝胶的形成。添加盐类,特别是Ca2+能提高凝胶形成的速率和凝胶的强度,例如大豆蛋白、乳清蛋白和血清蛋白。但是,有少量的蛋白质不经过加热也可以形成凝胶。例如酪蛋白胶束、卵白蛋白和血纤维蛋白可经过适度的酶水解后形成凝胶;酪蛋白胶束可通过添加Ca2+形成凝胶;大豆蛋白还可通过先碱化,然后恢复到中性或等电点pI的方式来形成凝胶。
蛋白质的热凝结胶凝作用分为以下两个步骤:第一步是在加热条件下,蛋白质分子发生一定程度的变性和伸展,从溶液状态转变为预凝胶状态,一些有利于凝胶网络形成的基团暴露,一定数量的基团通过非共价键结合,为第二步凝胶的形成做准备,此过程是不可逆的,存在一定程度的聚集;第二步是冷却的过程,随着溶液的温度冷却到室温,溶液体系的热动能降低,有利于各种分子暴露的功能基团间非共价键的稳定形成,从而形成凝胶。
根据胶凝形成的途径,可将凝胶分为热致凝胶和非热致凝胶两类。例如,卵白蛋白加热形成的凝胶为热致凝胶,而通过调节pH、加入二价金属离子或者是部分水解蛋白质形成的凝胶则为非热致凝胶。根据蛋白质形成凝胶后,凝胶对热的稳定性的不同,可将凝胶分为热可逆凝胶和非热可逆凝胶两类。热可逆凝胶是通过蛋白质分子间的氢键形成而保持稳定,当凝胶重新被加热后会再次形成溶液,冷却后又恢复凝胶状态,如明胶。非热可逆凝胶多涉及分子间的二硫键形成,二硫键一旦形成就不容易再发生断裂,加热不会对其产生破坏作用,如卵白蛋白、大豆蛋白。
蛋白质形成凝胶有两类不同的结构方式,分别为肽链的有序串性聚集排列和肽链的自由聚集排列两类。肽链的有序串性聚集排列形成的凝胶是透明或半透明的,例如血清蛋白、溶菌酶、卵白蛋白、大豆球蛋白等形成的凝胶;肽链的自由聚集排列形成的凝胶是不透明的,例如肌浆蛋白在高离子强度下形成的凝胶,还有乳清蛋白、β-乳球蛋白所形成的凝胶。常见蛋白质的凝胶结构中,这两种方式可同时存在,并且受到凝胶条件(蛋白质浓度、pH、离子种类、离子强度、加热温度和加热时间等)的影响。
胶凝是某些蛋白质的一种很重要的功能性质,在许多食品的制备中起着主要的作用,例如,各种乳品、果冻、凝结蛋白、明胶凝胶、各种加热的碎肉或鱼制品、大豆蛋白凝胶、膨化或喷丝的组织化植物蛋白和面包面团的制作等。
(五)面团的形成
小麦蛋白是众多食品蛋白质中唯一具有形成黏弹性面团特性的蛋白质。小麦面粉与水大约以3:1的比例在室温下混合、揉搓,能形成强内聚性和强黏弹性的面团(dough),再通过发酵、焙烤等工艺就可制成面包。
小麦面粉中含有可溶性蛋白质和不溶性蛋白质两类蛋白质。可溶性蛋白质大约占小麦总蛋白的20%,主要包括清蛋白和球蛋白,以及少量的糖蛋白,它们对于小麦粉的面团形成特性没有贡献。面筋蛋白是不溶性蛋白质,约占小麦总蛋白的80%,主要包括麦醇溶蛋白(gliadin)和麦谷蛋白(glutenin),它们是面团形成的主要因素。小麦粉中的面筋蛋白在形成面团以后,其中还包含有其他成分,如淀粉、糖和极性脂类、非极性脂类、可溶性蛋白质等,这些成分都有助于面筋蛋白形成面团三维网状结构,从而影响着面包的质地。
面筋中氨基酸组成比较独特,其中谷氨酰胺和脯氨酸残基含量占总氨基酸残基的40%以上,有利于分子间氢键的形成,同时也使面筋具有很强的吸水能力和黏弹性质。面筋中所含有的许多非极性氨基酸有利于蛋白质分子和脂类的疏水作用,使之产生聚集。半胱氨酸残基和胱氨酸残基占面筋总量的2%~3%,可形成许多二硫键,有利于蛋白质分子在面团中形成紧密的连接。
水和面粉在混合和揉搓时,面筋蛋白质分子开始排列成行和部分伸展,分子间疏水相互作用随之增强,从而促使二硫键的形成。最初的面筋颗粒转变成薄膜,形成具有三维空间的黏弹性蛋白质凝胶网络,该网络能够起到截留淀粉粒和其他成分(糖、极性脂类和非极性脂类)的作用。但是,面团对网络结构破坏的抵抗能力随着捏合时间的延长而增强,达到最大耐受值,随后又减弱,此时凝胶网络结构被破坏。这种破坏包括聚合物在剪切方向的取向和二硫键的断裂,以及由此引起的聚合物聚集体的减小。在面团形成过程中,加入氧化剂KBrO3有助于二硫键的形成,可增加面团的弹性和韧性。
麦谷蛋白(glutenin)和麦醇溶蛋白(gliadin)二者的适当平衡的比例对于面团的形成也是非常重要的。麦谷蛋白的含量决定着面团的弹性、黏合性和强度,麦醇溶蛋白决定着面团的流动性、伸展性和膨胀性。面包的强度与大分子的麦谷蛋白有关,麦谷蛋白的含量过高会抑制发酵过程中残留的CO2气泡的膨胀,抑制面团的鼓起,而若麦醇溶蛋白的含量过高则会导致过度的膨胀,使产生的面筋膜易破裂和易渗透,面团容易出现塌陷。在面团中加入极性脂类有利于麦谷蛋白和麦醇溶蛋白的相互作用,提高面筋的网络结构。脂可以形成“醇溶蛋白—脂—谷蛋白”复合体。极性脂与面筋蛋白结合后,面筋蛋白就能利用其极性基团与淀粉、戊聚糖或水等相互结合,大幅增强面团弹性,改善面团强度,从而改变面团的加工性能。
(六)蛋白质的界面性质
蛋白质的界面性质(interficial properties)是指蛋白质能自发地迁移至汽—水界面或油—水界面的性质。由于蛋白质分子是两亲分子,它在界面上的吉布斯自由能低于其在体相水中的自由能,因此,体相水中的蛋白质能自发地向界面迁移,到达平衡时,蛋白质在界面上的浓度总是高于其在体相水中的浓度。蛋白质作为一类天然大分子物质,它能够在界面上形成高黏弹性薄膜,并产生物理垒以抵抗外界机械作用的冲击,使得界面体系更加稳定。
影响蛋白质的表面活性的因素分为内在因素和外在因素。内在因素指的是蛋白质中氨基酸的组成、结构、立体构象、分子中极性和非极性残基的分布与比例、二硫键的数目与交联以及分子的大小、形状和柔顺性等。外在因素指凡是能影响蛋白质构象、亲水性与疏水性的环境因素,它包括温度、pH、离子强度和盐的种类、界面的组成、蛋白质浓度、糖类和低相对分子质量表面活性剂的加入、能量的输入,以及形成界面加工的容器和操作顺序等。
蛋白质是一种比较理想的表面活性剂,其特点有:
①具有能快速吸附到界面的能力。
②吸附到达界面后蛋白质分子能迅速伸展和取向。
③蛋白质一旦到达界面,就能立即与邻近分子发生相互作用而形成具有强内聚力和黏弹性的膜,能耐受热和机械作用的破坏。
许多天然的和加工的食品都是泡沫或乳化体系的产品,需要利用蛋白质的起泡性、泡沫稳定性和乳化性等功能性质。
1.乳化性质
食品乳化体系是分散的互不相溶的两个液态相,常见的液态相为水相和油相。由于两相的极性不同,在界面上界面张力比较大,使乳化体系在热力学上是不稳定的体系,因此需要通过乳化剂的作用来降低界面张力,增加体系的稳定性。蛋白质分子中同时具有亲水基团和亲油基团,可以在食品乳化体系的形成过程中发挥乳化剂的作用。
许多食品都是由蛋白质稳定的乳状液,形成的分散系有油包水型(W/O)和水包油型(O/W)两种形式。蛋白质在维持这些乳状液体系的稳定性中发挥着十分重要的作用,它吸附在分散的油滴和连续水相的界面上,能使油滴具备产生抗凝集性的物理学、流变学性质。可溶性蛋白质最重要的作用是它有向油—水界面扩散并在界面吸附的能力,蛋白质分子的一部分与界面相接触,其疏水性氨基酸残基面向非水相排列,降低了体系的自由能,蛋白质分子的其余部分发生伸展并自发地吸附在界面上,表现出相应的界面性质。一般认为蛋白质分子的疏水性越大,界面上吸附的蛋白质的浓度也越大,界面张力也就越小,乳状液体系就越稳定。
影响蛋白质乳化作用的因素主要有:
①蛋白质的溶解度与其乳化性质(emulsifying property)之间存在着正相关。例如,在肉馅胶体(pH为4~8)中,如果有0.5~1 mol/L氯化钠的存在就可大幅提高蛋白质的乳化容量,增大蛋白质的溶解性,从而达到较好的乳化效果。
②pH对蛋白质的乳化作用也有影响。某些蛋白质在等电点pH时溶解度很低,乳化能力下降,不能稳定油滴的表面电荷。当达到等电点或一定的离子强度时,蛋白质以高黏弹性紧密结构形式存在,这样不但可以阻止蛋白质伸展或在界面吸附,还可稳定已吸附在界面的蛋白质膜,阻止表面形变或解吸。
③加热可降低被界面吸附的蛋白质膜的黏度和刚性,从而降低乳状液体系的稳定性。例如,β-乳球蛋白经过热处理后,分子内的—SH暴露,与相邻分子之间的—SH形成二硫键,在界面上发生有限聚集。
④添加低相对分子质量的表面活性剂,不利于由蛋白质稳定的乳状液体系的稳定性。因为小分子表面活性剂会降低蛋白质膜的硬性,削弱蛋白质在界面保留的能力。
通常,评价蛋白质乳化性质的指标包括乳化活性指数(EAI, emulsifying activity index)、乳化容量(EC, emulsion capacity)和乳化稳定性(ES, emulsion stability)。
①乳化活性指标(EAI)指单位质量的蛋白质所产生的界面面积。
式中:φ为分散相的体积分数;R为乳状液粒子的平均半径;m为蛋白质的质量。
另一种简便且实际的测定蛋白质的EAI的方法是浊度法,即乳状液的浊度。
式中:A为吸光度;l为光路长度。
②乳化容量(EC)是指在乳状液相转变前(从O/W乳状液转变成W/O乳状液)每克蛋白质所能乳化的油的体积。
测定蛋白质乳化容量的方法:在不变的温度和速度下,将油或熔化的脂肪加至在食品捣碎器中被连续搅拌的蛋白质水溶液中,根据后者黏度和颜色的突然变化或电阻的增加检测相的转变。
对于一个由蛋白质稳定的乳状液,相转变通常会发生在φ为0.65~0.85范围。
相转变并非一个瞬时过程,转变之前先形成W/O/W双重乳状液。
乳化容量随相转变达到时蛋白质浓度的增加而减少,而未吸附的蛋白质累积在水相。
③乳化稳定性(ES):由蛋白质稳定的乳状液一般在数日内是稳定的。试样在正常条件下,在合理的保藏期内通常观察不到相分离。因此,常采用诸如保藏在高温或在离心力下分离这样的剧烈条件来评价乳化稳定性。
若采用离心的方法,可用乳状液界面面积(即浊度)减少的百分数,或者分出的乳油的百分数,或者乳油层的脂肪含量表示乳状液的稳定性。常用下式表示乳化稳定性
乳化性质也是蛋白质重要的功能性质之一。在食品加工中,球蛋白具有很稳定的结构和很强的表面亲水性,它们不是良好的乳化剂,例如,血清蛋白、乳清蛋白。酪蛋白分子结构中肽链上高度亲水区域与高度疏水区域是隔开的,所以它们是很好的乳化剂。大豆蛋白分离物、肉和鱼肉蛋白质也是不错的乳化剂。
2.起泡性质
食品泡沫(foam)是指气泡在连续的液相或含有可溶性表面活性剂的半固相中形成的分散体系。通常,气体是空气或CO2,连续相是含蛋白质的水溶液或悬浊液。食品泡沫的特点是:
①含有大量的气体。
②在气相和连续相之间存在较大的表面积。
③溶质的浓度在界面处较高。
④具有能膨胀、具有刚性或半刚性和弹性的膜。
⑤泡沫不透明。
泡沫食品的柔软性决定于气泡体积、薄层厚度及流变学性质。泡沫中,分散的两相之间存在界面张力,蛋白质的作用就是吸附在气—液界面,降低界面的张力,同时对所形成的吸附膜产生必要的流变学特性和稳定性。
许多加工食品都是泡沫型产品,例如蛋白质酥皮、蛋糕、棉花糖和充气糖果、点心顶端配料、冰淇淋、蛋奶酥、啤酒泡沫、奶油冻和面包等。冰淇淋是很复杂的泡沫体系,它含有脂肪球、乳胶体、分散的冰晶悬浮体、多糖凝胶、糖和蛋白质的浓缩溶液以及空气气泡等多种成分。
食品加工中,产生泡沫的方法主要有以下几种:
①让鼓泡的气体通过多孔分配器(如烧结玻璃),然后通入浓度为0.01%~2.0%的蛋白质水溶液中可产生泡沫。
②在大量气相存在时搅打、搅拌或振摇蛋白质水溶液可产生泡沫。
③突然解除预先加压溶液的压力可产生泡沫。
形成的泡沫由于表面张力等原因,会发生破裂,造成泡沫不稳定性的因素主要有:
①重力、压力差、蒸发作用等降低了薄层的厚度,导致泡沫的破裂。
②泡沫本身大小不一,会导致泡沫的破裂。
③分隔气泡的薄层发生破裂从而导致泡沫的破裂。
影响蛋白质起泡性质的因素主要包括以下几点。
(1)蛋白质本身的性质
具有良好起泡性的蛋白质应当是蛋白质分子能够快速扩散到气—液界面,易于在界面吸附、展开和重排,并且通过分子间的作用形成黏弹性的吸附膜。蛋白质自身性质对起泡性质的影响如表3-9所示。
表3-9 蛋白质本身性质对起泡性质的影响
具有良好起泡能力的蛋白质,其泡沫的稳定性一般较差,相反,起泡能力差的蛋白质,其形成泡沫的稳定性较好,因为蛋白质的起泡能力和泡沫的稳定性是由两类不同的分子性质决定的。起泡能力取决于蛋白质分子的快速扩散、对界面张力的降低、疏水基团的分布等性质,主要由蛋白质的溶解性、疏水性、肽链的柔软性决定;泡沫稳定性主要由蛋白质溶液的流变学性质决定,如吸附膜中蛋白质的水合、蛋白质的浓度、膜的厚度、适当的蛋白质分子间相互作用。
在食品加工中,卵清蛋白是最好的蛋白质起泡剂,血清蛋白、明胶、酪蛋白、谷蛋白、大豆蛋白等也具有不错的起泡性质。
(2)盐类
盐的种类和蛋白质在盐溶液中的溶解特性,影响着蛋白质的起泡性。大多数球状蛋白(如牛血清蛋白、卵清蛋白、谷蛋白和大豆蛋白等)的起泡性和泡沫稳定性,随着NaCl溶液浓度的增大而增强;相反,另外一些蛋白质(如乳清蛋白、特别是β-乳球蛋白)的起泡性和泡沫稳定性,随着盐浓度的增大而减弱。二价阳离子(Ca2+、Mg2+)在浓度为0.02%~0.04%范围内,能与蛋白质的羧基生成桥键,使之形成黏弹性较好的蛋白质膜,从而提高了泡沫的稳定性。
(3)糖类
蔗糖、乳糖和其他糖类通常会抑制泡沫的膨胀。蛋白质在糖溶液中,由于其结构的稳定性大大增强,不能在界面吸附和伸长,因此蛋白质在搅打时就很难产生较大的界面面积和较大的泡沫体积。制作蛋白酥皮和其他含糖泡沫甜食时,最好在泡沫膨胀后再加入糖。而有的蛋白质在糖溶液中具有较好的起泡性质,例如卵清蛋白、糖蛋白等。
(4)脂类
低浓度(小于0.1%)脂类与蛋白质共存时,其起泡性能会大幅降低。特别是具有高表面活性的极性脂类化合物占据了空气/水界面,对吸附蛋白质膜的最适宜构象产生干扰,从而抑制了蛋白质在界面的吸附,使泡沫的内聚力和黏弹性降低,最终降低泡沫的稳定性,造成搅打过程中泡沫的破裂。
(5)蛋白质浓度
蛋白质浓度越高,泡沫越稳定;蛋白质的起泡能力一般也随着蛋白质浓度的增大而增强,并在某一浓度达到最大值。蛋白质浓度在2%~8%的范围内,液相具有最好的黏度,膜具有适宜的厚度和稳定性;但当蛋白质浓度超过10%时,溶液的黏度过大,影响到蛋白质的起泡能力,气泡变小、泡沫变硬。
(6)机械搅拌
机械搅拌是形成泡沫的常用手段,但是搅拌强度和时间必须适中,才能使蛋白质在界面形成良好的吸附。过度搅拌会使蛋白质产生絮凝,不能很好地吸附在界面上,从而降低了膨胀度和泡沫的稳定性。
(7)加热处理
蛋白质经过加热处理致使其部分变性,可以改善蛋白质本身的起泡性。在产生泡沫前,适当加热可提高大豆蛋白(70~80℃)、乳清蛋白(40~60℃)等蛋白质的起泡性能。但是,加热会使泡沫中的气体膨胀、黏度降低,导致泡沫的破裂,因此,加热处理大大降低泡沫的稳定性,却有利于蛋白质的起泡能力。
(8)pH
在溶液的pH接近等电点pI时,蛋白质分子之间的排斥力很小,有利于蛋白质分子间的相互作用和蛋白质在膜上的吸附,形成黏稠的吸附膜,从而提高蛋白质的起泡性能和泡沫的稳定性。在pI值之外的pH环境中,蛋白质的起泡能力较好,但泡沫的稳定性很差。
(七)蛋白质与风味物质结合
蛋白质可以跟风味物质(flavor compounds)结合,从而影响食品的感官品质。食品中存在的风味物质主要有醛、酮、酸、酚和脂肪氧化的分解产物等,它们与蛋白质结合会影响到食品在加工过程中或是食用时的口感。
风味结合包括风味物质在食品的表面吸附或经扩散向食品内部渗透,风味结合与蛋白质样品的水分含量和蛋白质与风味物质的相互作用有关。固体食品的吸附分为两种类型:一种是范德瓦耳斯力或氢键相互作用,以及蛋白质粉的空隙和毛细管中的物理截留引起的可逆物理吸附;另一种是共价键或静电力的化学吸附。对于液态或高水分含量食品,风味物质与蛋白质结合的机理主要是风味物质的非极性部分与蛋白质表面的疏水性区或空隙部分的相互作用,以及风味化合物与蛋白质极性基团,如羟基和羧基,通过氢键和静电作用的相互结合。而醛和酮在表面疏水区被吸附后,还可以进一步扩散至蛋白质分子的疏水区内部。
风味物质与蛋白质的相互作用通常是完全可逆的。但是,如果挥发性物质(如醛或酮)以共价键的方式与蛋白质结合,这种结合通常是不可逆的。风味物质与蛋白质的可逆的非共价键结合应遵循斯卡特卡尔(Scatchard)方程,平衡时
V结合/[L]=nk-V结合k
式中:V结合为每摩尔蛋白质结合挥发性物质的物质的量(mol);[L]为平衡时游离挥发性化合物的浓度(mol/L);k为平衡结合常数(mol/L);n为每摩尔蛋白质可用于结合挥发性化合物的总位点数。
根据平衡时的不同[L]值,用斯卡特卡尓方程,从实验测定的V结合值即可计算出k和n,或者以V结合/[L]对V结合作图,得到一条直线,k为直线的斜率,nk为截距。这是假设蛋白质中的所有配体的结合位点都具有相同的亲和力,而且配体与蛋白质结合时其构象不发生变化。与此相反的另一个假设,当蛋白质与风味物质结合时,通常会产生适度的构象变化。此时,风味物质将扩散至蛋白质的疏水内部,并破坏蛋白质链段间的疏水相互作用,从而使蛋白质的结构去稳定和改变蛋白质的溶解性。由于这些结构的变化,斯卡特卡尔关系式在蛋白质应用中呈曲线。各种羰基化合物与蛋白质结合的热力学常数如表3-10所示。
表3-10 羰基化合物与蛋白质结合的热力学常数
注:n为天然状态时结合部位的数目;k为平衡结合常数。
蛋白质与风味物质的结合也会受到环境因素的影响,水可以提高蛋白质对极性挥发物质的结合,但不影响蛋白质对非极性物质的结合,这是因为水增加了极性物质的扩散速度。高浓度的盐使蛋白质的疏水相互作用减弱,导致蛋白质伸展,可提高蛋白质与羰基化合物的结合。在中性或碱性pH条件下,酪蛋白与羰基化合物的结合能力更强。蛋白质的水解会降低蛋白质与风味物质的结合能力。蛋白质的热变处理会增强其与风味物质的结合。脂类物质的存在,可促进蛋白质与各种羰基挥发物质的结合和保留。对蛋白质进行真空冷冻干燥处理时,可使原本与蛋白质结合的50%的挥发物质释放出来。
(八)与其他物质的结合
蛋白质除了可与水分、脂类和挥发性风味物质结合以外,还能通过弱的相互作用或共价键与其他的很多物质(金属离子、色素、染料等)结合,也能与一些具有诱变性和其他生物活性的物质结合。这些物质的结合能产生良好的解毒作用,也可产生毒性增强的作用,还有可能使得食品中蛋白质的营养价值降低。蛋白质与金属离子结合有利于一些矿物质(钙、铁)的吸收,蛋白质与色素的结合可用于蛋白质的定量分析,大豆蛋白与异黄酮结合可有效提高其营养价值。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




