(一)测序结果质量分析
表6-3反映了5组滤料样品测序所得到的序列数及OUT数。
表6-3 样品测序数据统计(ANAMMOX反应器)
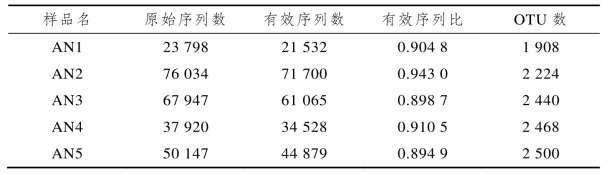
由表6-3可知,原始序列共计255 846条,有效序列共计233 704条,有效序列比为89.49%~94.30%。采用QIIME在相似度0.97水平下对有效序列进行聚类分析,得到AN1~AN5中包含的OTU条数分别为1 908、2 224、2 440、2 468、2 500。在抽取相同序列的条件下,5组滤料样品获得的OTU数大小为:AN5>AN4>AN3>AN2>AN1。由图6-6所示的稀释曲线可知,序列数量到15 000左右时各滤料样品的稀释曲线基本趋于平坦,说明取样数量基本合理,更多的取样可能只会产生少量新的OUT,因此该测试结果能够较好地反映真实环境中微生物的群落结构。

图6-6 样品的稀释曲线(ANAMMOX反应器)
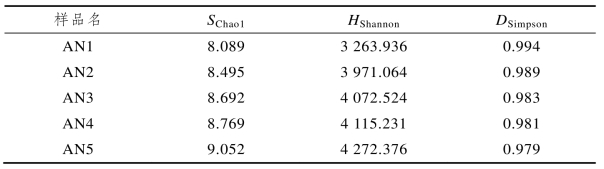
(二)菌群丰度和多样性分析
表6-4反映了5组滤料样品的SChao1、HShannon、DSimpson大小。HShannon用于表示微生物群落的多样性,陈重军等[240]考察了ABR反应器厌氧氨氧化稳定运行期间各个隔室的微生物群落结构特征,HShannon范围为4.19~5.20;曹雁等[241]考察了上流式厌氧过滤床的微生物群落结构,HShannon为7.14~8.89;Zhang等[242]研究了磁性纳米粒子对UASB反应器厌氧氨氧化性能的影响,在30、60、90、130 d时测得污泥样品的HShannon分别为4.91、5.13、4.65、4.56,本研究中HShannon处于相对较高值(8.089~9.052),说明菌群的多样性较高,ANAMMOX反应器滤料表面生物膜上存在适合多种类型微生物生存的生态位。从不同滤料层位的菌群丰度和多样性来看,SChao1与HShannon的变化趋势基本一致,大小均为AN5>AN4>AN3>AN2>AN1,而DSimpson与SChao1、HShannon的变化趋势相反,AN1的DSimpson最大,AN5的DSimpson最小,AN5的DSimpson比AN1下降了1.5%,体现出优势物种的生物量在总生物量中所占的比重有所减小,40~50 cm滤料层的优势种群比例最小。由上述3种Alpha多样性指数结果可知,ANAMMOX反应器内菌群的丰度和多样性随着滤料深度的增加而逐渐增大,这可能是由于较低深度(0~10 cm)滤料层的进水基质浓度较高,AAOB生长态势良好,占据优势地位,造成其他竞争能力弱的微生物无法获得适宜的生存空间而减少,随着污水自下而上流动,基质浓度逐渐降低,AAOB的优势逐渐减弱,其他微生物群落的丰富度和多样性开始增长。
表6-4 样品微生物群落多样性指数(ANAMMOX反应器)
基于加权Unifrac距离的PCoA图如图6-7所示。由图可知,AN1与其他4组样品之间的距离均较远,说明ANAMMOX反应器内0~10 cm滤料层的菌群结构与10~50 cm滤料层之间存在明显差异,距离大小为LAN1-AN2>LAN1-AN3>LAN1-AN4>LAN1-AN5,说明0~10 cm滤料层与10~20 cm滤料层的群落结构差异相对最小,与40~50 cm滤料层的群落结构相似度最低。AN3、AN4、AN5之间的距离较近,说明ANAMMOX反应器内20~30 cm、30~40 cm和40~50 cm滤料层的群落结构较为相近。
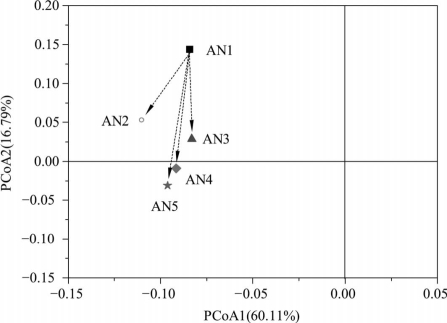
图6-7 基于加权Unifrac距离的PCoA图(ANAMMOX反应器)
(三)菌群结构及分布分析
1.门水平
ANAMMOX反应器内的微生物群落结构多样性较丰富,从5组滤料样品共检出45个已知菌门,其中主要的门水平菌群结构及分布情况如图6-8所示。由图6-8可知,变形菌门(Proteobacteria,25.26%~41.06%)、拟杆菌门(Bacteroidetes,13.44%~22.27%)、绿弯菌门(Chloroflexi,5.01%~15.87%)、厚壁菌门(Firmicutes,5.83%~13.88%)、浮霉菌门(Planctomycetes,3.48%~8.49%)、酸杆菌门(Acidobacteria,3.92%~6.21%)、放线菌门(Actinobacteria,3.09%~5.45%)、绿菌门(Chlorobi,3.01%~5.10%)、疣微菌门(Verrucomicrobia,1.38%~3.02%)、芽单胞菌门(Gemmatimonadetes,1.31%~1.62%)等菌群门类的相对丰度较高。与脱氮功能相关的微生物门类主要包括 Proteobacteria、Planctomycetes和 Nitrospirae(相对丰度0.013%~0.136%,图中未给出)三类,厌氧氨氧化菌(AAOB)所属的Planctomycetes相对丰度排第5位。(https://www.xing528.com)
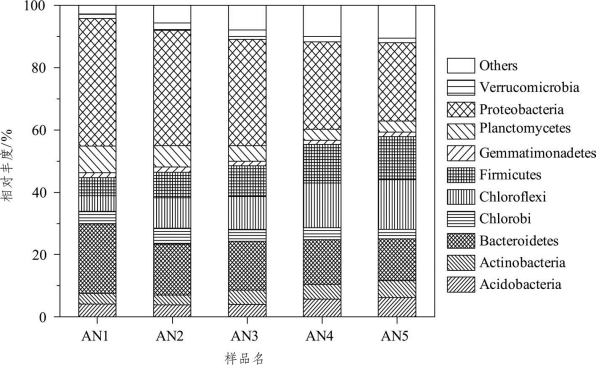
图6-8 主要门水平菌群结构及分布(ANAMMOX反应器)
从脱氮功能菌所属门类的空间分布来看,Proteobacteria在AN1~AN5内的相对丰度分别为41.06%、37.08%、34.12%、28.16%和25.26%,所占比例从AN1到AN5滤料层逐渐减小,Planctomycetes在AN1~AN5内的相对丰度分别为8.49%、6.84%、5.05%、 3.48%和3.55%,低于Proteobacteria的占比,但在各滤料层中的分布量同样随着滤料深度的增加而减少,且Planctomycetes在 AN1和 AN2滤料层分布较多,占总菌丰度的6.84%~8.49%,而在AN4和AN5滤料层的分布处于较低水平,占总菌丰度的3.48%~3.55%。Planctomycetes的分布受ANAMMOX反应基质(NH+4-N和NO-2-N)浓度的影响,在AN1和AN2滤料层,进水中的NH+4-N和NO-2-N浓度相对较高,有利于AAOB的生长,因而Planctomycetes在这2个滤料层的相对丰度较高。随着污水中的NH+4-N和NO-2-N在厌氧氨氧化作用下被同步消耗,渗入AN4和AN5滤料层的反应基质因浓度较低而导致AAOB富集程度下降,因而在Planctomycetes在这2个滤料层的分布量有所减少。作为具有硝化功能的重要微生物类型,Nitrospirae在一定条件下可将NO-2-N氧化成NO3--N,测序结果显示Nitrospirae在ANAMMOX反应器内各层所占比例分别为0.136%、0.104%、0.058%、0.045%和0.013%,这是由于进水中携带的少量溶解氧为Nitrospirae的生存提供了条件,因而在ANAMMOX反应器内同时存在少量Nitrospirae并对氮素污染物的转化产生一定的影响。随着污水中溶解氧和NO-2-N的逐级消耗,滤料上层环境逐渐不利于Nitrospirae的生长,丰度大幅降低。
在ANAMMOX反应器内还检测到Bacteroidetes、Chloroflexi、Firmicutes等相对丰度较高的菌群门类,陈重军等[240]在ABR厌氧氨氧化反应器内、曹雁等[241]在上流式厌氧过滤床反应器内也检测到了这几类菌。其中,Bacteroidetes在AN1~AN5内的占比分别为22.27%、16.39%、15.66%、14.38%和13.44%,由于Bacteroidetes具有代谢有机物的功能,随着有机物在ANAMMOX反应器内的逐级消耗,Bacteroidetes的丰度也逐渐减小。Chloroflexi、Firmicutes是厌氧氨氧化反应器内的常见微生物类型,有研究表明在SBBR、UASB、SBR等反应器[243-246]实现厌氧氨氧化后均发现了Chloroflexi或Firmicutes的存在,Chloroflexi、Firmicutes常与Planctomycetes、Proteobacteria等脱氮微生物协同共存于厌氧氨氧化体系内形成具有一定稳定性的微生态系统,但是它们与脱氮菌共存的互作机制及原因尚不清楚,有待进一步研究。
2.纲水平
在纲水平上共有127个已知菌类被检出,其中相对丰度大于1%的纲水平菌群结构及分布情况如图6-9所示。由图6-9可知,相对丰度排前5位的微生物分别是β-变形菌纲(Betaproteobacteria,12.58%~22.50%)、黄杆菌纲(Flavobacteriia,8.69%~17.76%)、δ-变形菌纲(Deltaproteobacteria,3.63%~11.44%)、厌氧绳菌纲(Anaerolineae,4.31%~9.76%)和 γ-变形菌纲(Gammaproteobacteria,4.30%~6.83%),其次是浮霉菌纲(Planctomycetia,3.16%~8.15%)、芽孢杆菌纲(Bacilli,2.99%~6.36%)、iii1-8(3.40%~6.09%)、梭状芽孢杆菌纲(Clostridia,2.19%~3.19%)、α-变形菌纲(Alphaproteobacteria,2.24%~2.75%)、拟杆菌纲(Bacteroidia,1.83%~2.20%)、Saprospirae(1.34%~1.89%)、OPB1(1.03%~1.40%)和芽单胞菌纲(Gemmatimonadetes,1.05%~1.40%)。
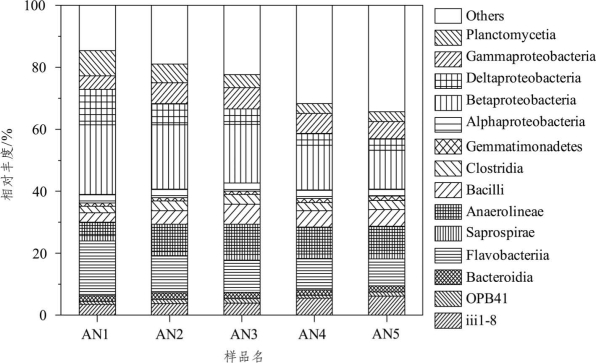
图6-9 主要纲水平菌群结构及分布(ANAMMOX反应器)
整体而言,各滤料层所分布的优势微生物类型差异不大,但是相对丰度却有着明显差异。变形菌纲在总菌群中所占的比例最高,其中占比较高的 Betaproteobacteria、Deltaproteobacteria、Gammaproteobacteria、Alphaproteobacteria在AN1~AN5滤料层的相对丰度和分别为40.95%、36.94%、33.32%、27.41%和24.04%;拟杆菌门下占比较高的Flavobacteriia、Bacteroidia、Saprospirae的相对丰度总和随着滤料深度的增加而减小,其群落丰度的变化主要受Flavobacteriia丰度的影响,而Flavobacteriia的丰度与有机物的利用场所有关,有机物含量随着滤料深度的增加而减少,因而Flavobacteriia的丰度也随之下降。Planctomycetia占浮霉菌门总丰度的82.45%~96.02%,其相对丰度与浮霉菌门的变化趋势一致,ANAMMOX反应器内的大部分AAOB均属于这个纲。Chen等[247]采用高通量测序研究了ABR厌氧氨氧化反应器内的微生物分别情况,结果表明5个隔室内的菌群结构相似而丰度各异,本研究的结果与之相符合。
3.属水平
为进一步阐明ANAMMOX反应器内的菌群结构和分布特征,从检出的322个已知菌属中选取相对丰度较高的进行分析,结果如图6-10所示。由图可知,在各滤料层相对丰度均大于1%的菌属主要包括土杆菌属(Geobacter,1.83%~6.56%)、Candidatus Brocadia(1.25%~5.33%)、Sulfuritalea(2.55%~3.69%)、SHD-14(1.29%~2.32%)、牦牛瘤胃菌(Proteiniclasticum,1.40%~1.90%)、Dok59(1.23%~1.43%);在部分滤料层相对丰度大于1%的菌属主要有陶厄氏菌属(Thauera,0.21%~2.86%)、黄杆菌属(Flavobacterium,0.73%~1.07%)、砂单胞菌属(Arenimonas,0.61%~1.27%)、密螺旋体属(Treponema,0.27%~1.26%)。另外,AN1~AN5滤料层中相对丰度较低及未培养菌属的占比分别为73.92%、79.26%、80.71%、84.39%、87.75%,同时还存在大量未检测出的物种,可见微生物的多样性随着滤料层深度的增加而变得更加复杂。
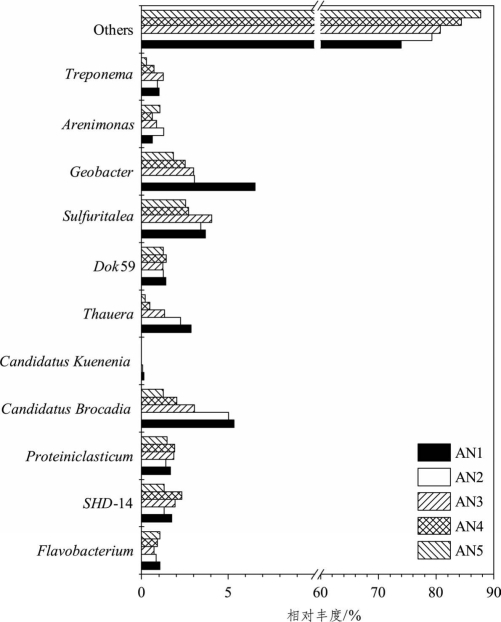
图6-10 主要属水平细菌群落结构及分布(ANAMMOX反应器)
在浮霉菌纲Planctomycetia中共检出7个菌属,分别是Gemmata、Nostocoida、A17、Pirellula、Planctomyces、Candidatus Kuenenia、Candidatus Brocadia,其中前5个属的相对丰度极低(0.01%~0.05%,图中未给出),而Candidatus Brocadia和Candidatus Kuenenia的比例相对较高,是污水处理中最常见的AAOB类型。其中,Candidatus Brocadia属占据绝对优势,在AN1~AN5中的相对丰度分别为5.33%、5.03%、3.04%、2.02%和1.25%,可见较低滤料层(AN1和AN2)中Candidatus Brocadia属的占比显著高于高滤料层(AN4和AN5);而Candidatus Kuenenia的相对丰度较低,仅在AN1和AN2中分别占有0.13%、0.07%,在AN3~AN5并未检出,这可能是由于反应基质较低时Candidatus Kuenenia的竞争力远不如Candidatus Brocadia而被淘汰。因此,ANAMMOX反应器内厌氧氨氧化的主要功能菌属为Candidatus Brocadia,它能在厌氧环境下以NO-2-N为电子受体直接将NH+4-N氧化为N2从而实现高效脱氮。
目前研究发现的AAOB共有5个属[72-82],分别是Candidatus Brocadia、Candidatus Kuenenia、Candidatus Scalindua、Candidatus Anammoxoglobus和Candidatus Jettenia。Gonzalezmartinez等[248]采用MBR反应器启动厌氧氨氧化后,检测到Candidatus Brocadia是主要的AAOB类型;姚芳等[249]在膨胀颗粒污泥床(EGSB)中分别接种污水厂的二沉池污泥和厌氧颗粒污泥,成功启动厌氧氨氧化后检测到污泥中的主要AAOB类型为Candidatus Brocadia,丰度分别为11.34%、7.28%;汪瑶琪等[250]将污水厂好氧污泥和实验室培养的具有ANAMMOX功能的厌氧污泥(体积比1∶2)接种于UASB反应器内启动厌氧氨氧化,当容积负荷为0.44 kg·(m3·d)-1时,检测到的主要AAOB类型为Candidatus Brocadia、Candidatus Jettenia和Candidatus Kuenenia,其中Candidatus Brocadia丰度最高,占比13.40%;谭锡诚等[251]在UASB反应器中成功启动厌氧氨氧化后发现,进水NH+4-N浓度为200 mg·L-1时污泥中的优势AAOB类型仅有Candidatus Brocadia,而当进水NH+4-N浓度为450 mg·L-1时优势AAOB类型变成了Candidatus Jettenia和Candidatus Kueneni;曹雁等[241]对UBF厌氧氨氧化反应器内的菌群多样性分析结果表明,稳定运行阶段的主要AAOB类型为Candidatus Brocadia,所占比例约为1%。Ye等[252]在SBR反应器内实现厌氧氨氧化后检测到Candidatus Brocadia、Candidatus Jettenia和Candidatus Kuenenia占比分别为4.36%、0.86%和0.32%。可见,Candidatus Brocadia是厌氧氨氧化反应器内常见的AAOB类型,但受进水基质浓度、反应器类型、接种污泥以及运行条件等的影响,该菌属的相对丰度不尽相同。
此外,在各滤料层中检测到的Thauera和Flavobacterium,多数种含有硝酸还原酶(Nar),能在厌氧条件下将NO3--N还原为NO-2-N[253,254];Dechloromonas(相对丰度0.21%~0.47%,图中未给出)和Bdellovibrio(相对丰度0.03%~0.06%)属于常见的反硝化菌属,能利用有机物作为碳源将NO-2-N或NO-3-N还原为N2[255,256];同时还存在少量能将NH+4-N氧化为NO-2-N的Nitrosomonas(相对丰度0.008%~0.095%)和能将NO-2-N氧化为NO3--N的Nitrospira(相对丰度0.002%~0.062%)。因此,ANAMMOX反应器内除了AAOB以外,还协同共存有多种AOB、NOB或DNB,这些菌群的相对丰度虽然远不及AAOB,但却能改变厌氧氨氧化的反应基质(NO-2-N和NH+4-N)和产物(NO3--N)的浓度,导致最终NO-2-N、NH+4-N的消耗量以及NO-3-N的产生量发生变化,这也是前述实验中ANAMMOX反应器稳定运行时ΔNO-2-N/ΔNH+4-N、ΔNO-3-N/ΔNH+4-N的值偏离厌氧氨氧化的理论值1.32和0.26的重要原因。氮素污染物在这些菌群的作用下进行复杂的迁移转化,共同影响着ANAMMOX反应器的脱氮性能。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




