(一)饥饿调控
1.饥饿对硝化效果的影响
采用4组相同条件下启动的CRI系统,编号C1~C4,分别运行3个阶段:稳定期(阶段Ⅰ)、饥饿期(阶段Ⅱ)和恢复期(阶段Ⅲ)。稳定期运行20 d后,停止进水,进入饥饿期;C1、C2、C3、C4的饥饿时间分别为5、10、15、20 d;饥饿期结束后,重新进水,进入恢复期,进水水质、运行参数等均与稳定期相同。稳定期和恢复期每天取水检测出水水质,考察饥饿前后出水中氮素污染物的变化情况,筛选出能获得最优部分亚硝化效果的饥饿调控模式。
1)NH4+-N浓度的变化
饥饿前后各系统对污水中NH4+-N的去除情况如图2-2所示。由图2-2可见,C1~C4在前20 d均处于较稳定的运行状态,各反应器出水NH4+-N的浓度维持在20 mg·L-1左右,NH4+-N去除率稳定在60%左右。
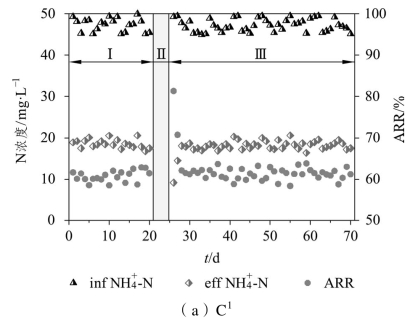
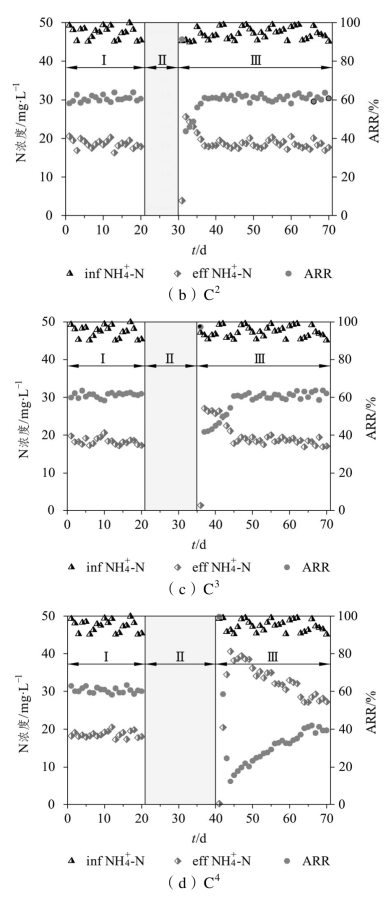
图2-2 饥饿前后NH4+-N去除性能的变化
分别经历5、10、15、20 d的饥饿期(阶段Ⅱ)后,恢复污水供应,各系统进入恢复期。可以看到,各系统在恢复初期对NH4+-N的去除趋势较为相似,在恢复期的第1天,C1、C2、C3、C4的NH4+-N去除率分别升高至81.3%、91.4%、97.3%、99.6%,相比各自饥饿前分别提高了19.9%、30.8%、35.3%、39.5%。分析认为,由于饥饿期未给系统提供任何的营养基质,微生物将更加彻底地分解系统内残存的污染物以维持新陈代谢活动,同时部分微生物由于营养物质的缺乏而被逐渐淘汰,使得滤料表面可用于污染物吸附的点位增多。当初次恢复进水时,污水中的大部分NH4+-N被迅速地吸附在滤料表面生物膜上,导致出水NH4+-N浓度降低,NH4+-N去除率相比阶段Ⅰ有明显提高,且随着饥饿时间的延长,滤料上的空余吸附点位增多,吸附NH4+-N的能力也越强,NH4+-N去除率的提升效果也越显著。
然而,在恢复期的第2天,C1、C2、C3、C4的NH4+-N去除率又分别降低至70.7%、43.7%、41.7%、58.6%,这表明恢复进水后大部分NH4+-N只是吸附在滤料表面而并未得到高效的转化,随着进水次数的增加,吸附逐渐达到饱和,出水中NH4+-N的浓度升高。C1、C2、C3分别经过3、7、10 d的恢复期后,NH4+-N去除率恢复至饥饿前水平,而C4经过24 d的恢复期后NH+4-N去除率仍为40%左右,难以恢复至饥饿前的水平。由此可见,经历饥饿后,系统内的硝化细菌受到了不同程度的冲击,因而硝化性能有所下降;饥饿时间越长,硝化性能下降得越明显,恢复原有状态所需要的时间也更长,而饥饿时间过长将导致硝化性能无法完全恢复。
2)NO-x-N浓度的变化
图2-3显示了饥饿前后各系统内NO-2-N和NO3--N浓度的变化情况。由图2-3可知,稳定运行期间各系统的出水中NO3--N浓度较高、NO-2-N浓度较低,NAR仅为1%左右。这表明饥饿前稳定运行的CRI系统以全程硝化为主,即大部分NH+4-N被AOB转化成NO-2-N后,又被NOB进一步转化为NO3--N。
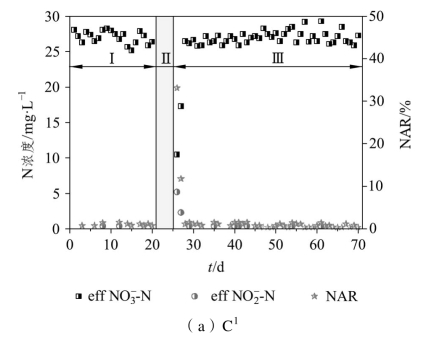
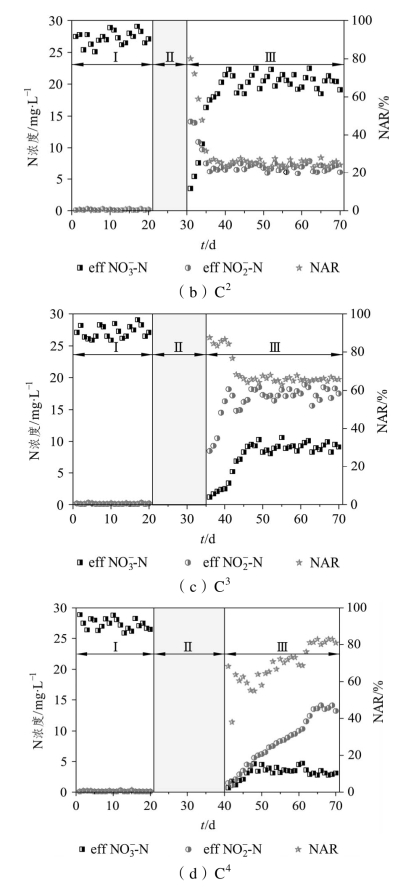
图2-3 饥饿前后NO2--N和NO3--N的浓度变化
恢复初期,各系统均表现出明显的NO-2-N积累现象。在恢复期的第1天,C1、C2、C3、C4的NO-3-N浓度分别下降至10.5、3.5、1.2、0.7 mg·L-1,相应的NAR分别升高至33.1%、80.5%、87.6%、68.2%,这表明在5~15 d的饥饿时间内,饥饿时间越长,NO-2-N转化为NO3--N的过程受阻越明显,因而NO2--N的积累现象就越显著。Morgenroth等[112]和Pijuan等[113]在进行活性污泥的饥饿研究时,同样也发现了在恢复阶段存在NO2--N的积累现象;而经过20 d的饥饿后,出水NO2--N浓度仅为1.5 mg·L-1,NAR相比15 d饥饿后反而有所降低,这说明较长时间的饥饿将导致NH4+-N转化为NO-2-N、NO-2-N转化为NO3--N这两个过程均受到阻碍。
随着运行时间的延长,各系统的NAR出现明显差异。其中,C1从恢复期的第2 d起NAR开始下降,到恢复期的第3 d时NAR仅为1.1%,基本恢复至饥饿前水平,可见饥饿5 d后,系统的硝化性能可以在较短的时间内得到良好的恢复。C2在恢复期的前3 d,出水NO2--N的浓度均高于NO3--N,但从第4 d起出水NO3--N的浓度逐渐超过NO-2-N浓度,最终NAR稳定在25%左右。C3在恢复期的前7 d,NAR均高于75%,从第8 d起稳定在65%左右,其硝化反应已经转变为以短程硝化的形式为主,出水中NO-2-N的浓度一直高于NO-3-N。C4在经过23 d的恢复期后NAR升高至80%以上。结合图2-2中NH+4-N浓度的变化可知,结束10、15 d的饥饿期后,系统将NH+4-N氧化为NO-2-N的能力逐渐得到恢复,而将NO-2-N氧化为NO-3-N的能力难以完全恢复,因而在NH+4-N去除率恢复的同时出现NO-2-N积累现象。饥饿时间为20 d时,系统将NH+4-N氧化为NO-2-N的能力难以完全恢复,因此C4在表现出NO-2-N积累的同时,NH+4-N去除率却比阶段Ⅰ时有所降低。
2.饥饿对硝化菌活性的影响
为解析饥饿调控下CRI系统部分亚硝化的发生机制提供理论依据,在稳定期、饥饿期、恢复期3个运行阶段分别定期检测滤料中硝化菌(AOB和NOB)的活性变化,考察不同饥饿时间下硝化菌活性的衰减与恢复情况。
1)活性衰减情况
不同饥饿时间下硝化菌(AOB和NOB)的活性变化情况如图2-4所示,经计算得到的硝化菌衰减速率如表2-3所示。可以看到,饥饿前NOB的活性均高于AOB,因而系统在稳定期的硝化反应以全程硝化为主。进入饥饿期后,AOB和NOB的活性均呈现衰减趋势,但是其衰减规律表现出较大的差异。
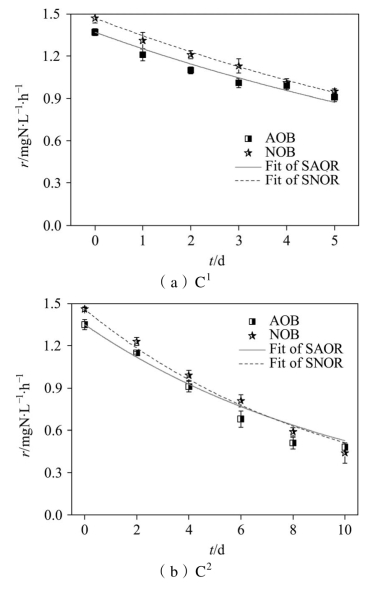
由图2-4(b)可知,C2在饥饿至第10 d时,AOB的活性开始高于NOB,结合表2-3可知,该阶段NOB的活性衰减速率[(0.105±0.005)d-1]高于AOB的活性衰减速率[(0.094±0.006) d-1],这也是恢复期出现NO2--N积累的原因。随着饥饿时间的延长,系统内可供AOB利用的氮源物质逐渐减少,AOB快速做出响应而进入内源呼吸期,该阶段AOB产生的NO2--N浓度极低,无法满足NOB的需求,导致NOB活性衰减速率加快。Bollmann等[114]的研究表明,AOB能在饥饿条件下利用自身核糖体供给生长代谢,这种特有的代谢过程使其能够更好地应对饥饿环境,因而AOB的活性衰减速率相对较慢。Hao等[115]利用富集的硝化菌进行实验时发现,7 d的好氧饥饿后NOB的衰减速率[(0.306±0.026)d-1]高于AOB[(0.144±0.009) d-1],与本研究的结果相一致。
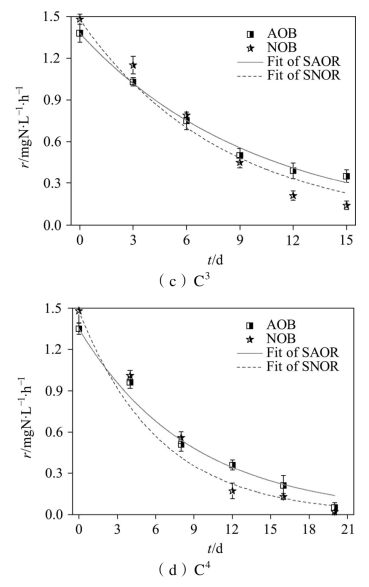
图2-4 AOB和NOB活性随饥饿时间的衰减
表2-3 AOB和NOB在不同饥饿时间下的衰减速率
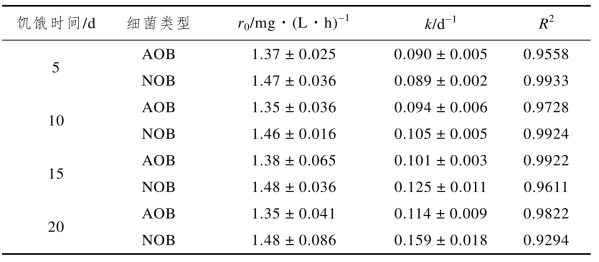
由图2-4(c)可以看到,继续延长饥饿时间至15 d,AOB和NOB的活性进一步降低,该阶段结束时AOB的活性[0.35 mg·(L·h)-1]是NOB的2.5倍,NOB的活性衰减速率是AOB的1.24倍。由图2-4(d)可知,饥饿20 d后AOB和NOB的活性均降至较低水平,NOB的活性衰减速率是AOB的1.4倍。硝化菌活性的降低,与不能适应饥饿环境的AOB和NOB逐渐失去活性有关;AOB与NOB的衰减速率之差随着饥饿时间的延长而进一步增大,说明饥饿对NOB的活性抑制更加明显。(https://www.xing528.com)
2)活性恢复情况
饥饿期结束后,各CRI系统内硝化菌的活性恢复情况如图2-5所示,经计算得到的硝化菌恢复速率如表2-4所示。由图2-5(a)可以看到,C1在恢复期的第1 d时AOB活性高于NOB,可见恢复进水后,AOB能更快地从饥饿环境中复苏,进入正常生长状态。Bollmann等[114]研究发现AOB特有的代谢机制使其能更好地应对营养物质短缺的饥饿环境,从而使细胞在不利生长环境下处于预备状态,停止细胞分化等行为,当重新恢复营养物质供给时,AOB能迅速做出反应并提供细胞生长所需的酶,进而使细胞得到激活;NOB因无法快速适应环境的变化,致使其活性恢复速率滞后于AOB,从而导致了NO2--N的积累。由图2-5(b)(c)(d)可以看到,C2、C3、C4内AOB的活性一直高于NOB,这合理解释了这三个系统内一直存在的NO2--N积累现象。
表2-4 AOB和NOB在不同恢复时间下的恢复速率
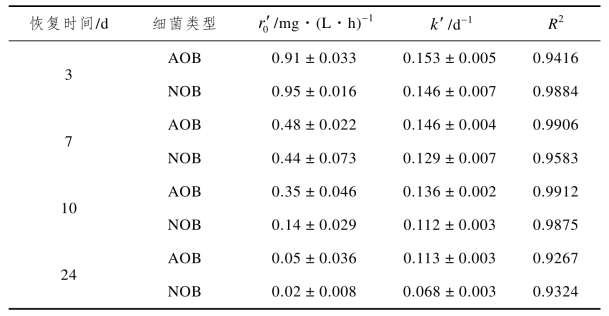
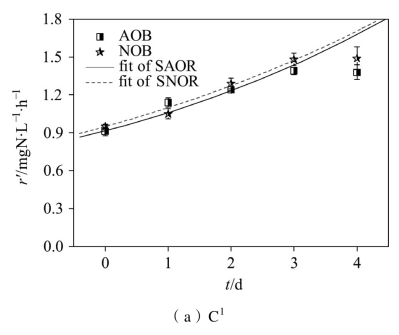
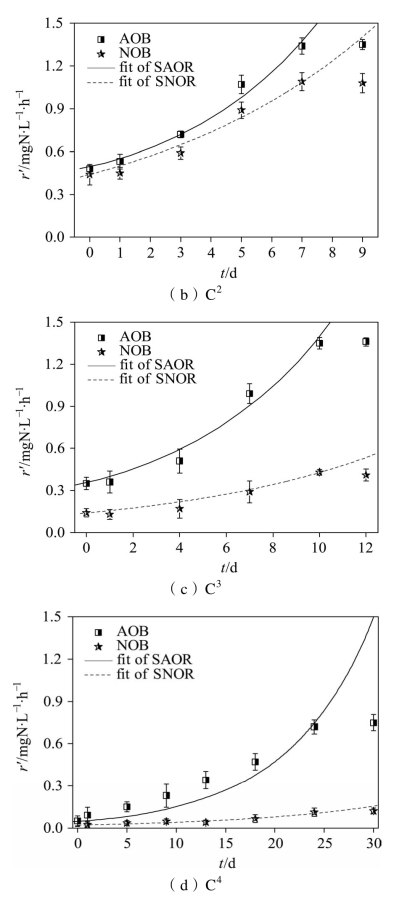
图2-5 AOB和NOB活性随时间的恢复
同时,从活性恢复速率来看,饥饿时间越长,AOB和NOB的活性恢复速率就越低,恢复至某一水平所需的时间也就越长。从活性恢复水平来看,C1、C2、C3、C4分别经过3、7、10、24 d的恢复期后,AOB和NOB的活性开始趋于稳定。其中C1、C2、C3内AOB的活性能基本恢复至饥饿前水平,因而系统对NH4+-N的去除率均能回升至60%左右,而C4内AOB的活性仅能恢复至饥饿前的53.3%,因而该系统对NH4+-N的去除率难以完全恢复。NOB的活性恢复水平取决于饥饿时间的长短,其中C1从恢复期的第2 d起NOB活性再次超过AOB,因而NO2--N的积累率变低,系统再次转变为全程硝化,可见5 d饥饿期对NOB活性的影响相对较小,其活性能够逐渐恢复至饥饿前水平;而C2、C3、C4内NOB在稳定后的活性水平仅能达到饥饿前的74.7%、29.1%、7.4%,可见较长时间的饥饿(10~20 d)可选择性地淘汰NOB,使AOB在硝化菌群中占据优势,因而会出现稳定的NO-2-N积累现象,且饥饿时间越长,不能适应饥饿环境而被淘汰的NOB就越多,AOB所占优势就越显著,NAR就越高。
综合考虑不同饥饿时间后各系统的NH+4-N去除率、NO-2-N积累率,选择15 d作为快速启动CRI系统部分亚硝化的最佳饥饿时间,当恢复进水至第10 d时,NH+4-N去除率为60.7%,NO-2-N积累率为66.1%,出水NO-2-N/NH+4-N为0.91。为满足耦合厌氧氨氧化的进水需求,将在此基础上通过调控进水pH进一步提高NO-2-N积累率。
(二)进水pH调控
AOB和NOB对环境的酸碱性十分敏感,进水pH是影响系统硝化性能的一个关键因素。因此,本节实验选择经饥饿调控后稳定运行的C3反应器,调节进水pH分别至7.2、7.5、7.8、8.1、8.4、8.7、9.0,各运行14个周期,分析进水pH对氮素污染物转化的影响,探讨能实现NO2--N高效积累的进水pH条件。
图2-6反映了进水pH对CRI系统内COD去除性能的影响。可以看到,进水COD浓度为120~140 mg·L-1,进水pH为7.2~9.0时,出水COD浓度均低于30 mg·L-1,平均去除率为82.5%。可见CRI系统内异养菌对进水pH的适应范围较宽,对pH变化的抗冲击能力较强,该系统在COD去除方面具有其显著的优势。
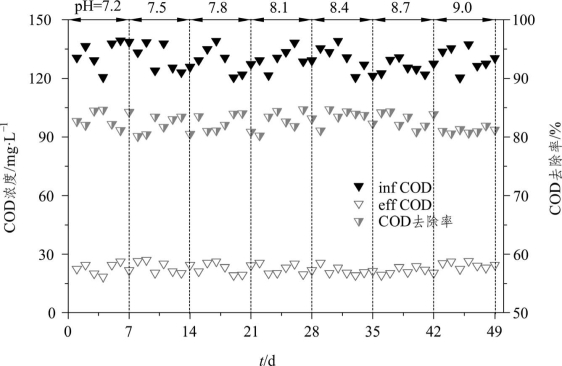
图2-6 不同进水pH下COD的去除情况
图2-7(a)反映的是不同进水pH条件下系统内NH4+-N、NO3--N、NO2--N及FA的浓度变化规律;图2-7(b)反映的是相对应的ARR、NAR和NNR。
从图2-7可以看到,进水pH为7.2~8.7时,出水NH4+-N浓度维持在18 mg·L-1左右,NH4+-N去除率稳定在60%左右;而当进水pH升高到9.0时,出水NH4+-N浓度增加到30 mg·L-1左右,NH4+-N去除率出现“落点”(B),骤然降至40%左右。进水pH为7.2~7.5时,出水NO2--N、NO3--N浓度波动较小,NO2--N积累率维持在65%左右;当进水pH上升至7.8~8.4时,出水NO3--N浓度缓慢减小,NO2--N积累率逐渐升高。
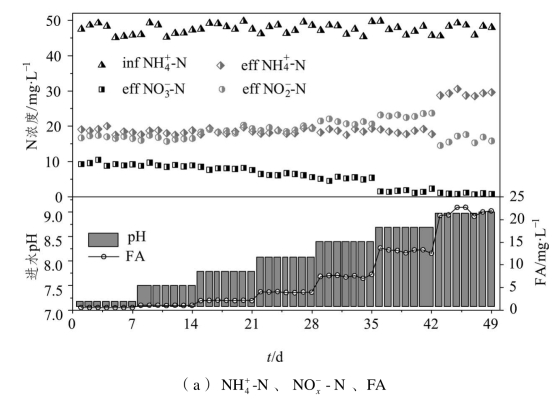
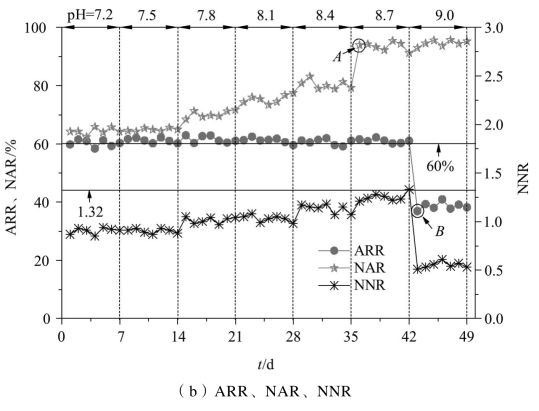
图2-7 不同进水pH下CRI系统内氮素污染物的变化
当进水pH继续升高至8.7时,出水NO2--N浓度明显升高、NO3--N浓度明显下降,NO2--N积累率出现“跃点”(A),骤然升至93.9%,该“跃点”反映出进水pH为8.2时,NOB的活性开始受到严重抑制,NO2--N向NO3--N的转化过程受阻,因而NO2--N积累率出现大幅提升;当进水pH为9.0时,出水NO2--N浓度大幅下降,结合NH4+-N去除率出现的“落点”可知,进水pH为9.0时,AOB的活性也开始受到抑制,NH4+-N向NO2--N的转化过程受阻,因而NH4+-N去除率大幅降低,NNR降至0.5左右,同时在该进水pH条件下NOB的活性也受到进一步抑制,出水中NO3--N的浓度变得更低,平均浓度仅为0.9 mg·L-1,这使得该阶段的NO2--N积累率仍能维持在90%以上。
目前,关于AOB和NOB最适pH范围的报道差异较大。Claros J等[116]研究了pH对部分亚硝化反应器内AOB活性的影响,结果表明AOB生存的最佳pH为7.4~7.8;高大文等[117]控制SBR反应器内初始pH为7.8~8.7,运行25 d后NO2--N积累率超过90%;徐婷等[118]采用SBR工艺处理人工模拟氨氮废水发现,pH大于7.3时会对NOB产生抑制,pH在7.3~8.0内较有利于NO2--N的积累。这些报道中关于硝化菌的适宜pH范围虽然有所差异,但基本上可以认为,混合体系中AOB和NOB的最适pH分别在8.0和7.0附近。本研究中当进水pH为8.7时,NO2--N积累率在90%以上,说明AOB在该pH范围内生长最好,而NOB的最适pH不在该范围内,因而AOB成为优势菌群,NO2--N积累效果最佳。
pH对AOB和NOB的影响主要体现在两个方面:① 不同的微生物都有其最适pH或适宜的pH范围,pH过高或过低可能引发细胞膜电荷的变化或影响代谢过程中酶的活性,进而影响微生物对营养物质的吸收效率,因此可以利用AOB和NOB的最适pH的不同,通过调控进水pH进一步稳定控制硝化类型及硝化产物;② 根据反应式NH3+H2O ![]() NH+4+OH-,pH的变化会对溶液中游离氨(FA,以NH3计)的浓度产生影响,由于亚硝化过程中AOB利用的真正底物是NH3而不是NH4+,因此pH的变化将会影响亚硝化的进程及硝化菌群的组成。FA的计算公式如下[29]:
NH+4+OH-,pH的变化会对溶液中游离氨(FA,以NH3计)的浓度产生影响,由于亚硝化过程中AOB利用的真正底物是NH3而不是NH4+,因此pH的变化将会影响亚硝化的进程及硝化菌群的组成。FA的计算公式如下[29]:
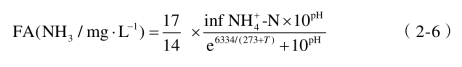
当FA浓度适宜时,可作为AOB的氨氧化基质;而当FA浓度达到某一阈值时,又会不同程度地抑制AOB和NOB的活性。目前,国内外关于FA对AOB和NOB抑制浓度的研究结论存在差异,Rongsayamanont等[119]认为FA对AOB和NOB产生抑制的起始浓度范围分别为60~120、0.6~60 mg·L-1;Anthonisen等[120]研究发现,FA浓度为10~150 mg·L-1时会对AOB产生抑制,而对NOB的抑制浓度为0.1~1.0 mg·L-1;Kim等[121]发现FA浓度为0.7 mg·L-1时,NOB在活性下降了约50%;Fux等[122]认为FA浓度大于5 mg·L-1时可对AOB产生抑制,FA浓度为40 mg·L-1时产生严重抑制,而对NOB产生完全抑制的FA浓度仅为0.6 mg·L-1;吴莉娜等[123]的研究表明,FA浓度为40~70 mg·L-1时可实现稳定的亚硝化,但FA浓度为160 mg·L-1左右时会抑制全部的硝化反应;孙洪伟等[124]的研究表明,当FA浓度为2.5~197.2 mg·L-1时,AOB的活性并未受到影响,而 FA浓度为137.6~168.4 mg·L-1时,NOB的活性被完全抑制。虽然这些研究得到的FA抑制浓度结论不一致,但均反映出NOB对FA的敏感性要高于AOB。
本研究中FA浓度随着pH的提高而增大,pH为7.2、7.5、7.8、8.1、8.4、8.7、9.0时对应的FA浓度均值分别为0.54、1.03、2.11、3.97、7.52、13.15、21.68 mg·L-1。当FA浓度为2.11~7.52 mg·L-1时,出水NO2--N平浓度随着FA的升高而增加,而NO3--N平均浓度逐渐减小,这说明AOB在该FA浓度范围内比NOB表现出更强的适应性。当FA浓度为13.15 mg·L-1时,NO2--N积累出现“跃点”,可认为是NOB活性在继饥饿抑制后再度受到严重抑制的开始。但这并不意味着FA浓度越高,CRI系统的NO2--N积累效果越好,当FA浓度达到21.68 mg·L-1时,NH4+-N去除率出现“落点”,这说明该FA浓度会对AOB和NOB同时产生严重的抑制,从而导致系统出水NH4+-N浓度增加,NO2--N和NO3--N浓度减小。
综上所述,在饥饿调控的基础上,调节进水pH至8.7时可对NOB产生选择性抑制,同时不会影响AOB的活性,系统的NH4+-N去除率稳定在60%左右,NO2--N积累率稳定在93%左右,出水NO2--N/NH4+-N为1.21~1.33。由此可见,通过“饥饿-pH”协同调控已实现较好地耦合厌氧氨氧化进水要求的部分亚硝化。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




