建设上海设施,是中国加强科技自主创新的战略举措,是一项规模大、耗资巨、周期长、意义重要、影响深远的具有开创性的系统工程。分子影像系统的设计方案,参考了现有的国外同类设施的运行和国内研究单位的最高技术水平而初步制定,并随着新科技和新产品的发展而在一定框架范围内不断得到调整。方案力争在经费允许的条件下,不断提高主要技术指标,同时将关键技术集成和自主创新作为项目建设的必要程序,纳入管理规范,打破国外技术垄断壁垒,提高设备引进的主动性,将制造企业更新、改造、配套的能力,作为设备引进的重要依据,降低了设备选型风险,而且不断提升分子影像系统的专业技术水平和支撑能力,服务于广大用户。
分子影像系统快速扫描原子力显微镜,是国家蛋白质科学研究(上海)设施首台面向国内外用户开放运行的大型仪器设备,长期以来运行情况良好。高精度激光双光镊是上海设施自主研制建设的高精度大型仪器设备,在同类型仪器设备中,属于中国国内首台。
在国家大科学装置稳定的运行和维护经费支持下,分子影像系统自2013年初步建成并开放运行至今,基本实现了100%对国内外用户开放,实际运行机时>7 000 h(有效机时>5 000 h,机器研究>1 000 h),故障率<1%。分子影像系统在2013—2017年间的累计开放运行中,服务了国内外共计26家科研院所、高等学校和企事业单位,探索类和研究类的项目课题超过50项,发表论文十余篇,代表性项目成果2项。
9.5.1 樊嘉、史颖弘课题组和王炜、曹毅课题组关于肝癌组织纳米机械特征及其分子起源的研究[17]
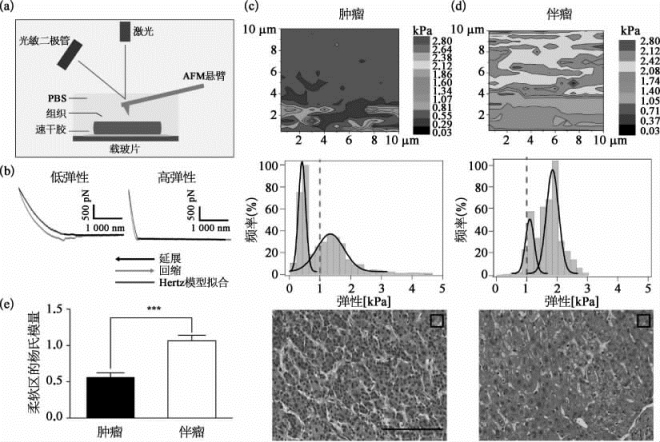
图9-26 人体肝脏、肝细胞癌的组织生物力学特征(彩图见图版第57页)
(a)用原子力显微镜检测人体肝脏实验样本弹性的方法。(b)不同的力曲线分别表示较低和较高的弹性数据。(c)肿瘤/肝癌组织弹性的生物力学特征。(d)正常组织弹性的生物力学特征。(e)正常组织和肿瘤/肝癌组织的较软区域的杨氏模量检测的统计对比数据。伴瘤:paraneoplasm。(图片引自[17])
该成果聚焦于肝细胞癌的组织生物力学特征(图9-26)与肿瘤复发转移的过程,中山医院的国家肝癌重点实验室提供了活体组织实验样本。研究基于原子力显微镜在单细胞水平上检测的有较低弹性峰值在切除取样手术后获得的肝癌组织上的杨氏模量分布,可以作为力学指纹来评价肝癌的恶性程度,而肝组织的弹性(杨氏模量)分布、改变及特定的纳米力学特点,预示了肝脏结构异常、肝硬化、肝癌和复发性肝癌的风险指数。研究发现,从正常的肝到肝硬化(liver cirrhosis)、原发性肝癌(hepatocellular carcinoma,HCC),再到复发性肝癌(recurrent HCC),其组织生物力学的弹性都逐渐减小,揭示了缺氧通过改变肝癌的生物力学,来促进肝癌细胞侵袭转移的生理病理过程(图9-27)。肝癌的发生是一个多变性、多步骤的渐变复杂过程。鉴于此,该成果提供了一种全新的技术创新检测平台,为未来的肝细胞癌的早期诊断,提供了可资借鉴的技术方法。

图9-27 从正常的肝脏到肝硬化、肝癌,再到复发性肝癌(详见下载图9-27,下载网址见31页脚注)(https://www.xing528.com)
其组织生物力学的弹性逐渐减小,揭示了缺氧通过改变肝癌生物力学,来促进肝细胞癌侵袭转移的生理病理过程。(图片引自[17])
9.5.2 郭兴东、许琛琦课题组和黄文茂、曹毅课题组关于支持T细胞受体多样性的脂肪依赖性构象动力学的研究[18]
在获得性免疫系统中,T细胞能够清除病原体和感染病变的细胞。T细胞抗原受体(T-cell receptor,TCR)是T细胞识别“自我”和“非我”物质的主要受体,可以和抗原呈递细胞(antigen-presenting cell,APC)表面特定的peptide(肽)-MHC复合物(p MHC)结合起来发挥作用。ab TCR复合物由TCRab异源二聚体、CD3eg、CD3ed和CD3zz组成。TCR与p MHC结合后,会引起TCR复合物中CD3分子胞内段免疫酪氨酸基序(immunoreceptor tyrosine-based activation motif,ITAM)中酪氨酸残基的磷酸化,随后开启下游信号。这个过程可以分为2个阶段,第一阶段发生TCR由结构关闭到结构打开的转换,第二阶段发生由TCR结构打开到ITAM磷酸化的激活态。许琛琦之前的工作表明,CD3e和CD3z的胞内段含有碱性氨基酸富集区(basic rich sequence,BRS;带正电)。这些BRS可以通过电荷相互作用,与富含酸性磷脂(带负电)的细胞质膜内侧相互作用,使得其ITAM被磷脂保护起来,免于被下游的激酶磷酸化[19]。随后他们发现,在T细胞活化的初期,内流的Ca2+可以通过中和细胞质膜内侧的酸性磷脂所带的负电荷,而帮助那些未结合抗原的TCR复合物胞内段从细胞质膜上解离下来,从而发生磷酸化,并放大初始的TCR信号[20]。这些研究证明了细胞质膜磷脂对TCR信号转导之重要调控作用。此外,TCR复合物在接受不同的抗原刺激时,会产生不同的下游信号,从而引起不同的T细胞免疫反应,但产生这种功能多样性的结构基础依然不甚清楚。
为了探究该科学问题,在许琛琦、曹毅的联合指导下,郭兴东、阎成松、李华、黄文茂等人运用多种技术手段,分析了TCR复合物胞内段与细胞质膜磷脂结合的结构动态性。首先,他们利用单分子原子力显微镜(AFM),检测CD3e胞内段(CD3eCD)与细胞质膜内侧相互作用的力学特征。研究发现,CD3eCD从细胞质膜解离的过程中会产生特异的力谱,除了单峰力事件外,还有一定比例的双峰力事件,这表明CD3eCD中很可能存在2个与细胞质膜结合的位点。研究人员通过计算发现,除了之前鉴定的BRS区域外,在脯氨酸富集区(proline rich sequences,PRS)和ITAM前半部分区域,还存在一个较弱的次级膜结合位点。为了验证该推测,他们随后使用核磁共振(NMR),结合溶液PRE[7]试剂TEMPOL,测定与磷脂结合的CD3eCD的构象动态特征。结果显示次级膜结合位点区域的氨基酸残基PRE效应相对较低,这进一步验证了次级膜结合位点的存在。而将该结合位点中的碱性残基和疏水残基突变后,发现CD3eCD前半段依旧与磷脂结合,而后半段却从磷脂上解离下来。最后,他们利用全内反射荧光显微镜(total internal reflection fluorescence microscope,TIRFM)和荧光共振能量转移(FRET)技术,检测不同强度抗原刺激下CD3eCD从细胞质膜上解离的程度,发现在不同强度的抗原刺激下,CD3eCD从细胞质膜上的解离程度确实存在差异。这表明,不同强度的抗原确实可以使CD3eCD处于不同的构象态。这些实验证明,膜脂依赖的TCR复合物构象动态特征,很可能是TCR复合物传导不同刺激信号的结构基础。
该研究揭示了TCR复合物胞内段的结构动态性,阐明了TCR复合物传导不同刺激信号的结构基础(图9-28)。
总之,经过近5年的建设与开放共享,本系统用户在生命科学领域取得显著成果。随着系统设备的稳定与升级、方法学的开发与应用、工作人员不断精进的技术支持、管理制度的不断完善,各项指标都在不断地进一步得到优化,也有越来越多的用户来到这里进行实验研究。因此有理由相信,未来将会有更多更好的成果涌现出来。
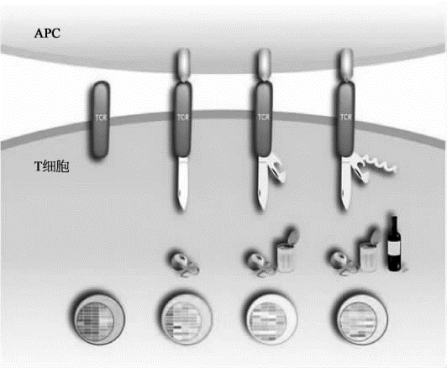
图9-28 强弱不同的特异性抗原能够诱导TCR复合物产生不同的构象变化,从而产生不同的活化信号以及不同的免疫反应(详见下载图9-28,下载网址见31页脚注)
图片引自[18]。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




