9.4.1 满足验收的系统技术性能状态(表9-1)
表9-1 分子影像系统的验收指标

*DNA折纸术(DNA origami)是一种DNA纳米技术,其原理是利用经过精心设计的许多短单链DNA与一条长达数千碱基的DNA链杂交,在杂交过程中短单链DNA帮助长DNA链折叠成预先设计的形状,故被形象地称为DNA折纸术。
(续表)

(续表)
9.4.2 系统测试
9.4.2.1 单分子影像分析模块
1.原子力显微镜
(1)扫描成像测试
测试指标和依据:
在有足够技术人员、样品可实现同步制备的条件下,同时实现自动化快速扫描。扫描一个样品并得到稳定、高质量的图像,约需不到20 min。原子力显微镜可以测试每种类型的样品5个/d,可达到(8 h/d工作量)测量样品最大能力10个/d、每个样品3~5个图像的指标。AFM可对单个分子的表面进行三维成像,最高精度优于1 nm。
测试方法、测试设备及结果、测试结论:
①原子力显微镜检测293FT活细胞的表面三维形貌
a)实验方法
实验使用的AFM探针为硅针尖,弹性力常数为0.7 N/m(探针型号Bruker Scan Asyst-fluid+)。首先,在细胞房中用云母或玻璃片预先培养293FT活细胞,达到期望的理想检测密度。然后在成像检测之前,通过双面胶将云母或玻璃片固定在60 mm培养皿中。同时将PBS缓冲液温育至37℃,滴加到培养皿中,保持细胞存活和一直在缓冲液体系中。最后,通过光学显微镜初步定位以后,利用原子力显微镜智能扫描模式进行液相成像,用Scan Asyst-fluid+检测293FT活细胞的表面三维形貌。
b)测试设备及结果
测试设备为原子力显微镜。测试结果见图9-6。

图9-6 实时检测293FT活细胞的表面三维形貌(详见下载图9-6,下载网址见31页脚注)
height:高度;peak force error:峰值力误差;quadrature:正交幅值;inphase:同相位。
c)测试结论
AFM可以对单个细胞表面进行三维成像,最高精度优于1 nm。AFM扫描一个293FT活细胞样品,预先需要样品固定、温育、体系平衡,平均耗时10 min以上。扫描得到稳定高质量图像的整个过程,约需不到40 min,平均一个样品30 min。另外,补偿每次更换样品、系统参数调节、稳定实验体系或同一样品重复收集图像的时间约为10~20 min/次。正常情况下,原子力显微镜可以测试该种样品的最大能力为10个样品/d。
②原子力显微镜检测基于DNA折纸术的正三角形和矩形二维纳米器件之形貌
a)实验方法
实验使用AFM的探针为硅针尖,弹性力常数为0.4 N/m(探针型号Bruker Scan Asyst-air)或0.7 N/m(Bruker Scan Asyst-fluid)。首先,利用M13mp18病毒单链作为脚手架链,并利用经过Autodesk Maya 2012、Python 2.7.2、caDNAno 2.2.0、Can Do等程序预先设计好的很多带有修饰的订书钉链,按照特定比例在1×TAE-Mg2+缓冲液体系[3]中混合以后,经过PCR退火处理,完成DNA自组装的折纸过程。然后,吸取预处理结束的样品2~5μl,滴加到新解离的新鲜云母表面。吸附几分钟以后,利用原子力显微镜轻敲模式、接触模式、智能扫描模式进行成像,同步检测基于这种DNA折纸术的正三角形和矩形二维纳米器件之形貌。
b)测试设备及结果
测试设备为原子力显微镜。测试结果见图9-7。

图9-7 基于DNA折纸术的正三角形和矩形二维纳米器件之形貌(详见下载图9-7,下载网址见31页脚注)
c)测试结论
AFM可以对单个分子表面进行三维成像,最高精度优于1 nm。AFM扫描一个DNA折纸术样品,并得到稳定和高质量的图像,约需不到20 min,平均一个样品15 min。另外,补偿每次更换样品、系统参数调节、稳定实验体系或同一样品重复收集图像的时间,约为5~10 min/次。在正常情况下,原子力显微镜测试该种样品的最大能力为20个/d。
③原子力显微镜液相检测在磷脂双分子层膜上的膜联蛋白A5单体的清晰二维结构
a)实验方法
实验使用的AFM探针为硅针尖,弹性力常数为0.7 N/m(探针型号Bruker Scan Asyst-fluid+)。首先,将磷脂双分子层膜制备在新解离的新鲜云母表面,约需30 min。然后,将预先准备好的0.1 mg/ml膜联蛋白(annexin)A5混合在含有2 mmol/L Ca2+的溶液中,滴加到细胞质膜上大约30 min。利用原子力显微镜的智能扫描模式Scan Asyst进行检测,对膜联蛋白A5野生型在磷脂双分子层膜上形成的三聚体结构以及膜联蛋白A5单体的清晰二维结构进行扫描成像。
b)测试设备及结果
测试设备为原子力显微镜,测试结果见图9 8。
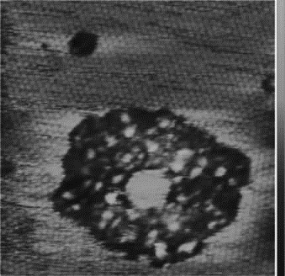
图9-8 膜联蛋白A5在含有2 mmol/L Ca2+溶液中与磷脂双分子层膜结合,膜联蛋白A5单体的二级结构清晰可见。
c)测试结论
AFM可对单个分子表面进行三维成像,最高精度优于1 nm。用AFM扫描一个膜联蛋白A5样品,并得到稳定和高质量的图像,约需不到20 min,平均每个样品15 min。另外,补偿每次更换样品、系统参数调节、稳定实验体系或同一样品重复收集图像的时间,约为5~10 min/次。在正常情况下,原子力显微镜测试该种样品的最大能力为20个/d。
④原子力显微镜检测桑蚕丝的表面微观形貌
a)实验方法
实验使用的AFM探针为硅针尖,弹性力常数为0.4 N/m(探针型号Bruker Scan Asyst-air)或0.7 N/m(Bruker Scan Asyst-fluid)。首先将桑蚕丝预处理后经过化学浸泡、溶解,添加特定的缓冲液,稀释到合适的浓度,持续滴加到新鲜解离的云母表面,为时大约10 min;然后利用原子力显微镜QNM[4]扫描模式进行快速扫描,检测桑蚕丝的表面微观形貌。
b)测试设备及结果
测试设备为原子力显微镜。测试结果见图9-9。
c)测试结论

图9-9 原子力显微镜以QNM模式快速扫描检测桑蚕丝的表面微观形貌(彩图见图版第53页)
AFM可对单个分子表面进行三维成像,最高精度优于1 nm。AFM扫描一个桑蚕丝样品,并得到稳定高质量的图像,约需不到20 min,平均一个样品15 min。另外,补偿每次更换样品、系统参数调节、稳定实验体系或同一样品重复收集图像的时间,约为5~10 min/次。在正常情况下,原子力显微镜测试该种样品的最大能力为20个/d。
⑤原子力显微镜检测阿尔茨海默病的疾病相关蛋白GAV-9短肽小分子在无机衬底上的一维外延生长的动态过程
a)实验方法
GAV-9肽(NH 2-VGGAVVAGV-CONH 2)是一个与几种神经退行性疾病相关蛋白质同源的保守序列。实验主要利用原位AFM,实时观察GAV-9肽在云母无机衬底上一维外延生长的动态自组装过程。
实验使用的AFM探针为氮化硅(Si3 N4)针尖,是弹性力常数为0.34 N/m(Bruker SNL 10)的A位置探针。首先将预先合成好的GAV-9多肽粉末用10 mmol/L磷酸缓冲液溶解,并稀释到合适的浓度,滴加一滴约30μl的磷酸缓冲溶液到新解离的新鲜云母表面。使原子力显微镜在轻敲模式下工作,在获得稳定成像后,使用探针旋滴法引入GAV-9溶液,到预定浓度。实验环境湿度控制在70%以上,温度保持在22±1℃。在所有的AFM实验过程中,尽量保持针尖与样品之间的作用力为一个最小值。然后,利用原子力显微镜,实时原位观察GAV-9短肽分子在云母无机衬底上一维外延生长的动态自组装过程,进一步了解和检测多肽分子在衬底表面的动态自组装过程,以及多肽和疾病相关蛋白质在体内的折叠与积聚机制。
b)测试设备及结果
测试设备为原子力显微镜。测试结果见图9-10。

图9-10 GAV-9短肽小分子在无机衬底上的一维外延生长动态过程
通过设计正确的多肽序列,调控多肽与衬底之间的相互作用力,可以达到控制多肽在衬底表面按照指定方式进行自组装,并进一步制造功能性纳米结构的目的。纳米结构的形成,在本质上是一个结晶的过程。通常认为,结晶过程涉及2个基本步骤——成核与生长。当调节GAV-9短肽达到合适浓度的时候,云母表面形成一些纤维细丝。原位观察发现,纤维细丝以末端为“种子”,可以继续延伸生长,这对今后实验具有很大的借鉴意义。通过进一步调节多肽的浓度,或许可以观察到更精密的生长过程,并为进一步研究按照人们意愿操纵和构造图案提供了可能性。在实验测试过程中,AFM设备运行稳定,最高精度优于1 nm,同时位移测量精度优于1 nm。即使在扫描速度较大的情况下,也能够得到较好的图像,为该课题在下一阶段的实验研究,提供了很大帮助。
c)测试结论
用AFM可以对单个分子表面进行三维成像,最高精度优于1 nm。用AFM可以对单个分子进行操纵,同时检测分子的位移(或形变)和力,位移测量精度优于1 nm。用AFM实时原位检测GAV-9短肽分子在云母无机衬底上一维外延生长的动态自组装过程,并进行稳定、高质量的扫描成像,整个过程约需不到60 min,平均一个样品50 min。在正常情况下,原子力显微镜测试该种样品的最大能力为10个/d。
(2)动力学测试
测试指标依据:
在有足够技术人员,样品可以实现同步制备的情况下,同时也满足标准化实验条件时,测量标准化样品得到100个以上的同一样品动力学测量结果,约需不到60 min。原子力显微镜可以一天测试每种类型的样品7~8个,可达到每天(8 h工作量)测量样品的最大能力为10个的动力学测试指标。
AFM可对单个分子进行操纵,同时检测分子的位移(或形变)和力,位移测量精度优于1 nm,力的测量精度范围为几十到几百皮牛(p N)。
测试方法、测试设备及结果、测试结论:
课题是用原子力显微镜检测人CD3胞内段多肽与细胞质膜内侧的相互作用力。
a)实验方法
实验中使用的AFM探针为Si3 N 4针尖,是弹性力常数为0.06 N/m(Bruker SNL 10)的D位置探针。首先利用PEG链接分子[5]相关基团-NHS与探针表面的—NH 2进行化学反应,对NHS-PEG2000-MAL进行单分子修饰,连接到探针表面。随后利用PEG链接分子另一端的—MAL基团与巯基—SH进行化学反应,对预先表达纯化的C端带有半胱氨酸的人CD3胞内段多肽进行单分子修饰,连接到PEG链接上,从而得以将目标多肽偶联到探针上,在缓冲液中保存待测。同时,在经100μg/ml的多聚赖氨酸预处理的新解离的新鲜云母表面,培养293FT细胞;随后用特殊剥离法和100μg/ml K蛋白酶(proteinase K)处理细胞质膜表面残存的蛋白质,用R18等磷脂染料染色,从而标记获得293FT细胞内膜样品。用原子力显微镜以QNM扫描模式,在液相下预先扫描经过预处理的衬底表面形貌。经过初步定位以后,更换预先修饰好多肽的探针,校准探针的力学参数,在液相模式下搜索扫描面积大而且平整、经过预处理的衬底表面形貌后,打开自动坐标和定点位移窗口,选择快速力曲线工作模式,在多个定点选择和设定程序栏填写100(即为每个点测100条力曲线)。接下来在成像扫描模式中选择力曲线开始(Ramp Start)按钮,在扫描的图像中点击感兴趣的位置(ROI)。软件自动操作探针在感兴趣的点上反复抬压100次,在接触-离开(Approach-Retract)样品的循环过程中检测多肽与内膜之间的作用力,存储数据图像以供随后的分析。定量解析人CD3胞内段多肽与细胞质膜内侧之间的相互作用力。
b)测试设备及结果
测试设备为原子力显微镜,测试结果见图9-11。
通过新方法的样品准备,可以制得密度高、连续完整、表面较为平整的293FT细胞内膜。通过对大于2 000个相互作用力的力谱分析,最终约有500个力曲线的单分子统计结果显示:人CD3的胞内段多肽与细胞质膜内侧之间存在着较强的特异性相互作用力,大约几十到几百皮牛。突变体多肽N端的碱性氨基酸发生突变后,与野生型相比,相互作用力有明显降低,但是依然保持在较高水平,提示疏水相互作用也可能在其中同时发挥重要作用。
c)测试结论
用AFM可对单个分子进行操纵,同时检测分子的位移(或形变)和力,位移测量精度优于1 nm,力的测量精度范围为几十到几百皮牛。AFM实时检测一次生物分子(人CD3胞内段多肽与细胞质膜内侧)的相互作用力以及杨氏模量、力学性能定性、定量测试,整个过程约需不到60 min,平均一个样品50 min。在正常情况下,原子力显微镜测试该种样品的最大能力为10个/d。
2.高精度激光双光镊(https://www.xing528.com)
测试指标和依据:
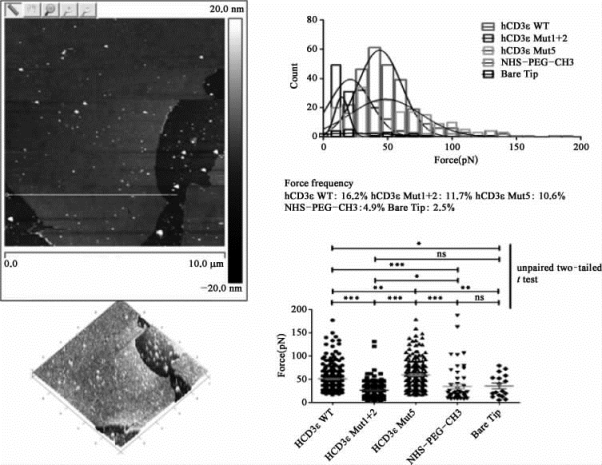
图9-11 人CD3胞内段多肽与细胞质膜内侧的相互作用力(彩图见图版第54页)
height sensor:高度传感器;count:计数;bare tip:秃尖;force:力;force frequency:力频率;unpaired two-tailed t test:不配对双尾t检验。
最高精度优于1 nm。可对单个分子进行操纵,同时检测分子的位移(或形变)和力,位移的测量精度优于1 nm。力的测量量程宽于0.05~200 p N,精度为50 f N。
测试方法:
高精度激光光镊通过偏振分束,将激光分成2束。其中一束为固定光束,另一束通过压电陶瓷控制转镜实现微小偏转,进而精细控制双光镊之间的相对距离,其基本原理见图9-12和图9-13。高精度激光双光镊,能够精细捕获和操控微纳米尺度的微球,常被生化领域的研究者用来研究单分子的折叠动力学过程,如抗血凝蛋白的折叠和错误折叠、神经元SNARE蛋白复合物的单分子折叠动力学、RNA的折叠动力学以及微小力诱导的构象变化等。在这些单分子折叠动力学过程的测量中,常用微米级粒子如聚苯乙烯微球,作为力和位移的探针。通过地高辛-抗地高辛、生物素链霉亲和素(streptavidin)等的连接,可以将所要研究的单分子体系偶联到2个聚苯乙烯微球上。这样,通过高精度激光双光镊,就可以实时动态地测量单个分子的伸长量与受力;同时可以通过激光双光镊,对单分子加载一定大小的力,并能够精细改变力的大小,进一步研究在不同力的诱导下,单分子的折叠动力学过程。在这些单分子测量体系中,首先须标定光镊的精度以及测试单分子的能力。为此,采用高精度激光双光镊,捕获半径为1μm的聚苯乙烯微球探针,测量微球在光阱中进行受限布朗运动时的噪声功率谱,通过洛伦兹线型拟合,可以获得包括探测器响应、光阱刚度、光镊噪声水平等的光镊探测精度信息。
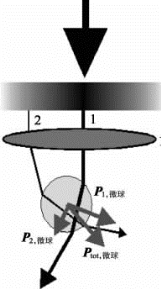
图9-12 聚焦激光形成梯度力的示意图
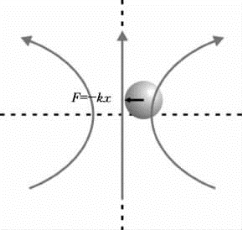
图9-13 光镊对粒子的作用力示意图
测试设备及结果:
高精度激光双光镊的光路如图9-14,其中捕获激光采用1 064 nm的近红外激光器,输出功率可达4 W。经磁光隔离和功率调整系统后,由望远镜系统T1扩束。再由偏振分束系统分成2束激光,其中一束由压电转镜微调角度,实现2个光镊之间的相对运动。经角度调整后,望远镜系统T2将转镜共轭到捕获物镜O1的后焦面。2束光经搜集物镜O2以及后续光路系统,分成2束,分别被2个位置传感探测器所探测。照明光采用LED科勒照明系统,由CCD对捕获的微球进行实时成像。
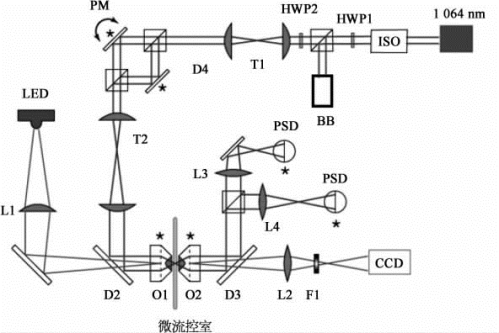
图9-14 激光双光镊光路图
LED:发光二极管;PM:偏光片;HWP2:半波片2;PSD:位置灵敏探测器;BB:挡光元件;ISO:隔离器;CCD:相机系统。
①激光器:采用光谱物理公司生产的近红外激光器,型号为CW,ND:YVO4(1 064 nm)。半导体泵的激光,最大输出功率可达4 W,最大实际测量功率可达5.3 W。定制带10 m光纤,输出波长为1 064 nm,模式为基模的激光器。
②显微镜物镜:采用奥林巴斯(Olympus),60×水浸,在1 064 nm波长处的透过率达到80%。
③位置敏感探测器:采用DL100-7 PEBA3型位置敏感探测器,对位置进行测量。经过数据采集卡,采集并记录到计算机。
④纳米转台:采用MadCity Lab公司的双轴铝制纳米转台系统(nano-MTA2X,aluminum),偏转范围为0~5 mrad,控制精度可达10 nrad。
⑤样品池控制系统:采用Newport公司的ESP301三轴控制器,控制3台电机,以及3个电机控制样品池的三维移动。电机的移动范围为0~12 mm。可采用操作手柄,方便地移动样品池位置。
⑥数据采集和控制卡:采用美国国家仪器公司的PCI-6289,M系列采集卡。它具有32路模拟输入、48位数字输入/输出、4路模拟输出,具有18 B(比特)解析度。采集卡的指标为:单通道能达到625 kS/s,多通道能达到500 k S/s。
⑦显微成像系统:图像数据采集卡采用Basler sc A640-74fc型相机,图像分辨率为658×492像素,最大采集速率为74帧/s。相机采用1 394 B线与图像采集卡相连。
⑧防振台:台面尺寸(长×宽×高)为4英尺×6英尺×18英寸[6],型号为TMC 784 751-02R。隔振腿均为独立设计,型号为14M-144-00。采用SV-14型平台气阀。
⑨工业控制计算机:采用戴尔(Dell)公司的T3600工作站,处理器为E5-1650。具有支持显微成像器件、激光器控制、数据采集卡以及转镜等硬件设备的接口,能够对数据进行实时采集和记录。显卡具有支持四屏输出的功能,其中2台显示器放在控制室,第三台显示器放在仪器间。
⑩激光切割机:采用美国Epilog生产的Zing 16激光切割系统。型号为Zing16-30W CO2激光器,最大切割尺寸为406 mm×304 mm。
高精度激光双光镊捕获2个聚苯乙烯微球的实时实验影像,如图9-15和图9-16所示。其中2个聚苯乙烯微球的直径约为2μm。
图9-17为处在光阱中的聚苯乙烯微球作受限布朗运动位移时的功率谱(红色曲线)。作为对照,蓝色曲线为光阱中没有微球时测得的激光光斑重心位置的功率谱,紫色曲线为激光关闭时测量得到的探测器的本地噪声功率谱。
激光光镊的光阱阱域约为被捕获微球的半径。对于实验所采用1μm半径的聚苯乙烯微球,由激光光镊捕获聚苯乙烯微球运动位置的功率谱,可以进一步拟合得出。位置敏感探测器的电压位移转换系数为1~2 m V/nm。在激光器输入为1.5 W时,光阱刚度的典型值约为0.2 p N/nm,因此光阱的最大阱力可估算为1μm×0.2 p N/nm=200 p N,光阱的测力范围可以通过增大激光功率而适当加大。本系统激光双光镊的最大功率可达5 W。功率谱的进一步分析表明,光镊位移探测精度约为0.08 nm/Hz1/2,力的探测精度为0.08 nm/Hz1/2×0.2 p N/nm=16 f N/Hz1/2,优于50 f N的设计指标。
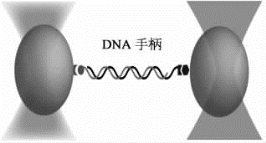
图9-15 高精度激光双光镊示意图(详见下载图9-15,下载网址见31页脚注)

图9-16 双光镊捕获2个聚苯乙烯微球示意图(彩图见图版第54页)
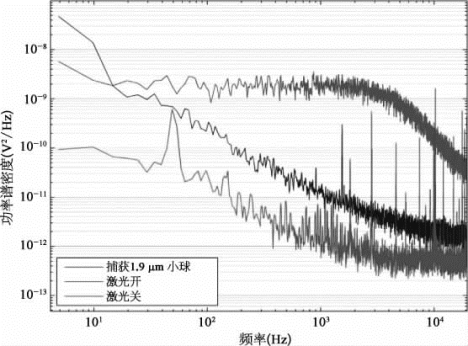
图9-17 光阱中的功率谱比较(彩图见图版第55页)
进一步,可以直接测量位移和力的功率谱,由功率谱估算探测噪声的水平,以衡量光镊的探测精度,如图9-18所示。
从图9-18可以估算,位移探测精度约为0.07 nm/Hz1/2,力的探测精度为25 f N/Hz1/2,均优于设计指标。
在标准化实验条件下,在对单分子用品浓度和实验条件已经优化的前提下,考虑DNA微球的偶联,以及实验准备大约需要1~2 h,实际测量时间按照5 h/d计算,在一般蛋白质折叠动力学过程的测量中,每个态的寿命在毫秒量级,采集15 min数据足以解析蛋白质动态过程,因此检测样品的能力可优于20个/d。
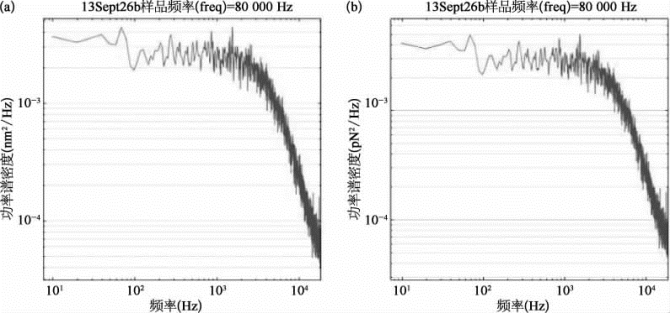
图9-18 位移(a)和力(b)的功率谱
测试结论:
高精度激光双光镊采用偏振分束,采用压电转镜来精细控制光阱的相对距离,可以对单个分子进行操纵,并检测分子的伸长和受力,位移的测量精度优于1 nm,力的测量量程宽于0.05~200 p N,精度优于50 f N。可检测单分子样品20个/d,符合预期的设计指标。
9.4.2.2 小动物影像分析模块
1.小动物化学发光荧光成像设备检测能力测试
(1)验收指标:每天能对100个样品进行检测。
(2)测试方法:将荧光素注入小鼠皮下。受试小鼠150只。3人进行实验,1人负责麻醉,1人负责设备操作,1人负责小鼠操作。留下1组小鼠,观察几天,看细胞的扩散程度。
(3)测试结果:对小鼠脂肪垫注射标记过的肿瘤细胞,3周后进行成像检测(腹腔注射荧光素酶底物),结果如图9-19所示。
对信号区域进行信号强度测算,得到图9-20的结果。
继续饲养至4周,再次进行上述检测,得到结果如图9-21。
对信号区域进行信号强度测算,得到图9-22的结果。
可以观察到,随着饲养时间的延长(3~4周),信号强度增加。因为信号强度与标记的细胞数量呈线性关系,故可以得出结论:标记的细胞数量增加。
(4)测试数量:每次测试5只,每次大约20 min。上午8:30—12:00,测试10次,合计测试50只小鼠;下午13:00—17:00,测试11次,合计测试55只小鼠。全天合计测试105只小鼠。
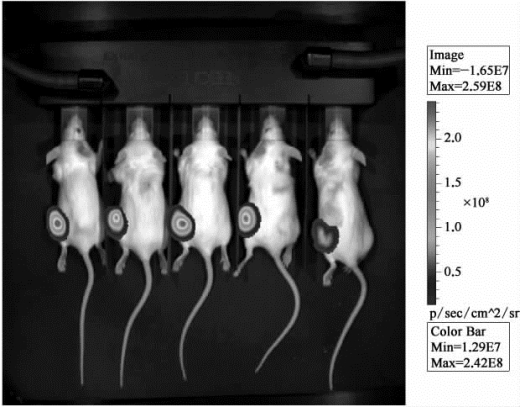
图9-19 对小鼠注射肿瘤细胞3周后的成像检测成果(彩图见图版第55页)Image:图像;Color Bar:对比度;Min:最小;Max:最大。
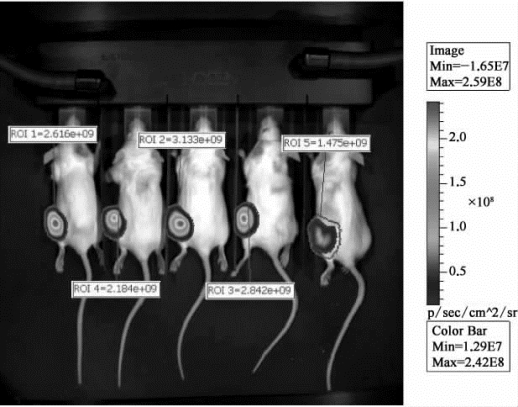
图9-20 小鼠影像分析测试中注射3周后对信号强度的测算结果(彩图见图版第56页)
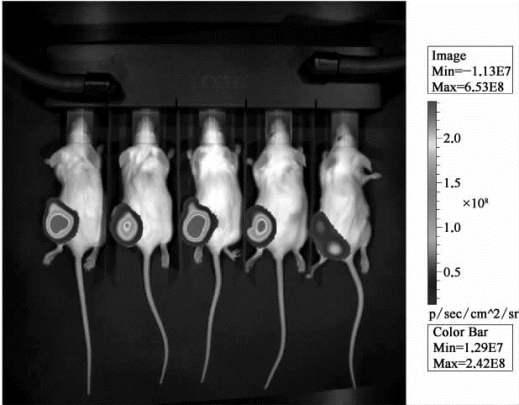
图9-21 对小鼠注射肿瘤细胞4周后的成像检测结果(彩图见图版第56页)
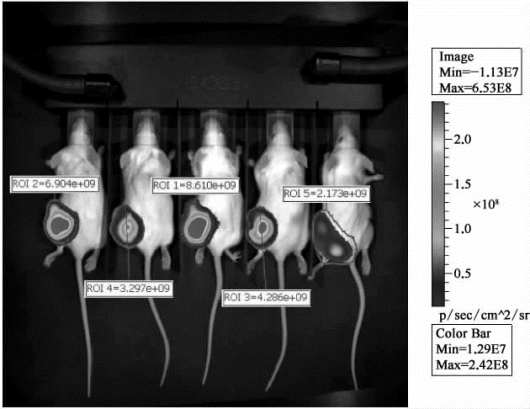
图9-22 小鼠影像分析测试中注射4周后对信号强度的测试结果(彩图见图版第57页)

图9-23 X射线辐照仪
(5)测试结论:此设备性能完好,工作正常,完全达到测试指标要求。
2.X射线辐照仪的设备测试
(1)验收指标:每天对50个样品进行检测。
(2)测试方法:小鼠X射线照射(见图9-23),每次每笼5只小鼠,每次15 min左右。把小鼠放置于辐照室内,关上门进行开机辐照,上午8:30—11:30,测试9次,每次5只小鼠,合计45只小鼠;下午13:30—16:30,测试10次,每次5只小鼠,合计50只小鼠。一共测试95只小鼠。
(3)测试结论:此设备性能完好,工作正常,完全达到测试指标要求。
3.样品制备测试
饲养设备已经到位,实际计算结果是,IVC笼位3 072笼,屏障开架笼位(见图9-24和图9-25)4 600笼,大鼠笼位310笼。合计小鼠笼7 672笼,大鼠笼310笼。满足设计指标。

图9-24 IVC(小鼠独立通风笼具)

图9-25 大鼠及小鼠的平板架饲养模式
9.4.3 系统验收
通过对上海设施的分子影像系统各项指标的测试以及分析,可以得出结论:本系统满足452—453页“9.3.3 系统研究计划”中提出的各项具体技术指标。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




