复合激光显微镜系统,在设备完成到货安装调试后的试运行期间,即开始接受用户实验。该系统于2015年7月28日通过国家验收,正式对用户开放运行。随着运行的稳定及用户的认可,至2016年年底,年服务课题组达55个,年服务有限机时达到近10 000 h。用户成果显著,在Nature、Cell Stem Cell等知名期刊上均有论文发表,年发表文章5~6篇。截至2017年11月,2017年度用户发表文章数达到15篇,其中一区文章8篇,二区文章5篇[9]。科研类用户以课题申请为主,每季度申请1次,有效期为半年。对错过季度递交申请时间段的紧急课题,提供紧急申请渠道。公司用户以外企对象为主,签订使用合同,提供机时及技术服务。目前,诺华、联合利华、和记黄埔等知名企业,均是系统的用户。下面列举几个复合激光显微镜系统用户成果的例子。
8.5.1 通过高通量、高内涵成像和共聚焦荧光显微成像,研究中药石菖蒲及其活性成分,促进成体神经发生
神经干细胞可以自我更新、增殖与分化,产生神经组织的各种细胞。神经元从神经干细胞产生的过程,被称为神经发生。在衰老、长期压力刺激或者神经系统病变的过程中,神经干细胞的增殖和自我更新水平下降,神经发生受阻,加速了认知功能的受损。一直以来,科学家都在寻求通过促进神经干细胞自我更新和神经发生的有效手段,来对抗衰老及神经退行性疾病相关的认知障碍。已有研究证明,通过移植胚胎神经干细胞或者体外诱导的神经干细胞,能够改善小鼠的学习记忆能力。但是,这一技术在人体上的应用,还须解决包括细胞来源和细胞功能性整合等的问题。而另一方面,利用药理学手段激活内源的神经干细胞,以达到治疗神经退行性疾病的目的,简单易行;并且可以利用药物的特异性,实现针对性的功能干预和补偿,是有望替代体内移植的新方法。

图8-53 石菖蒲提取物(AT)促进神经干细胞(NPC)[10]扩增和成年小鼠海马神经的发生(彩图见图版第47页)
(a)石菖蒲AT促进小鼠海马神经干细胞增殖,小鼠海马切片齿状回(dentate gyrus,DG)区的代表性免疫染色共聚焦显微图像和Brd U阳性细胞定量分析;(b)石菖蒲促进小鼠海马神经的发生。Ctrl:对照。(图片改自[17])
在中国传统药物中,有许多已经确认具有益智作用。其中一些中药来源的天然化合物,已报道可以在体外系统中促进神经发生,提示了这些中药益智作用的可能机制。2015年5月25日,中科院上海生化细胞研究所裴钢研究组,在国际学术期刊Aging Cell在线版上发表了其最新研究成果[17],报道了传统中药石菖蒲及其活性成分细辛醚,促进神经干细胞增殖和神经发生的作用及其分子机制,提示了抗衰老及延缓相关的神经退行性病变的新策略。在裴钢和赵简的指导下,毛坚鑫和黄世超等发现石菖蒲及其活性成分细辛醚,能够促进在体神经干细胞增殖和神经发生。成年小鼠、年老小鼠以及转基因阿尔茨海默病模型小鼠在口服石菖蒲之后,海马神经干细胞的增殖和神经发生的水平明显增加,从而改善了年老小鼠和阿尔茨海默病模型小鼠的认知能力(图8-53)。利用上海设施的高通量细胞分析仪(ThermoFisher Arrayscan Cellomics VTI 700)和共聚焦荧光显微镜(Leica SP8),进一步的机制研究发现,石菖蒲及其组分细辛醚,能够通过调控细胞外信号调节激酶(extracellular regulated protein kinases,ERK)的级联反应,直接促进神经干细胞增殖和神经发生(图8-54)。这一研究表明,石菖蒲及其主要成分细辛醚,可以用于防治衰老及相关的神经退行性疾病和进行再生性治疗。
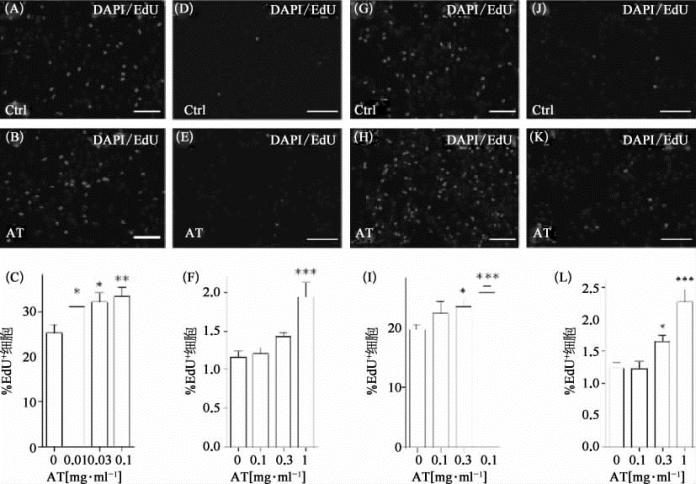
图8-54 石菖蒲提取物可以促进神经干细胞在体外增殖(彩图见图版第48页)
(A—C)用不同浓度的石菖蒲提取物(AT)孵育,减少生长因子(1 ng/ml EGF和1 ng/mlβFGF)溶液中的单层成年海马神经干细胞,为时24 h,固定前2 h加入Ed U[11]。(A)DMSO处理的对照组图像(Ed U为红色,DAPI为蓝色);(B)0.1 mg/ml的AT处理的细胞图像;(C)定量统计的Ed U阳性细胞在所有细胞中所占的比例;(D—F)用不同浓度AT处理无EGF或βFGF环境中单层成年海马神经干细胞,为时14 h。(D)DMSO处理的对照组图像(Ed U红色,DAPI蓝色),(B)1 mg/ml AT处理的细胞图像;(G—I)用不同浓度的AT孵育,减少生长因子溶液中的单层胚胎神经干细胞,为时24 h;(J—L)用不同浓度的AT孵育无生长因子EGF或βFGF溶液中的单层胚胎神经干细胞,为时14 h。(图片改自[17])
8.5.2 利用共聚焦显微镜成像技术,研究小分子化台物诱导人成纤维细胞直接转化为神经细胞的新方法
终末分化的体细胞,可以通过强制表达一些特异的转录因子,而被重编程为多能干细胞,表明细胞的命运是可以逆转的。不同谱系特异的转录因子组合,还可以将人和鼠的体细胞直接转分化为心肌细胞、肝细胞或神经细胞,为疾病模型的构建以及再生医学,提供了可供选择的途径。然而,这些通过强制表达外源基因以实现重编程或转分化的方法,却限制了其应用。因此,人们一直致力于控制外源基因的表达,并尽可能减少外源转录因子的使用。已经发现,一些细胞可渗透的小分子化合物,能够促进细胞的重编程。此外,一些小分子化合物的组合,可以将小鼠的成纤维细胞诱导到多能性的状态。
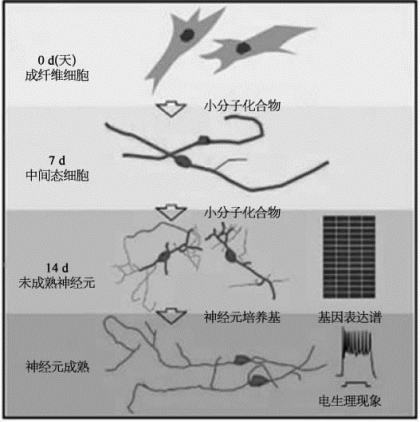
图8-55 小分子化合物诱导人成纤维细胞向神经细胞转化的示意图(详见下载图8-55,下载网址见31页脚注)
图片改自[18]。
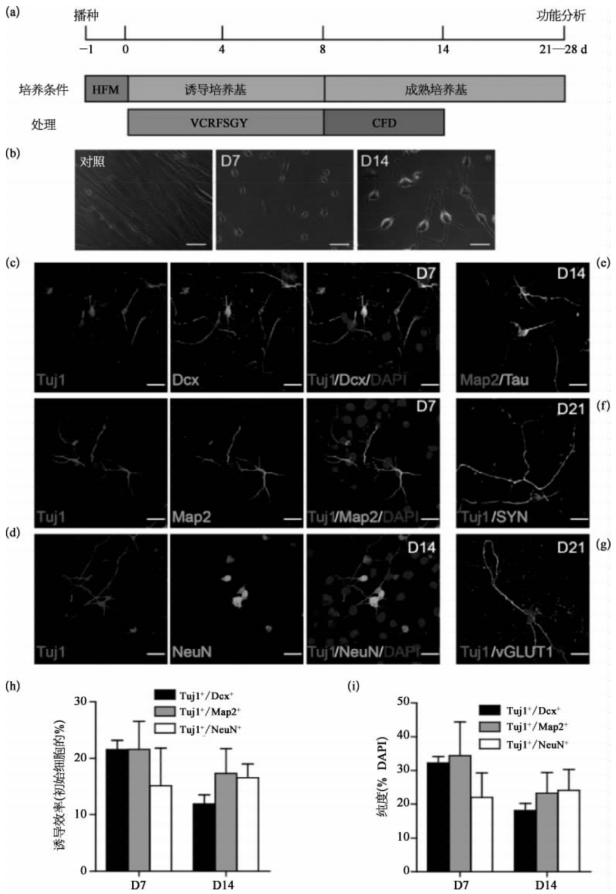
图8-56 小分子化合物诱导产生人类神经细胞(彩图见图版第49页)
(a)诱导方法;(b)对照组人成纤维细胞(HAF)和第7、第14 d的人神经细胞(hci N)的相差图像;(c)共聚焦荧光图像显示第7 d人神经细胞(hciN)显示双极神经元形态,且表达Dcx(绿色)、Tuj1(红色)和Map2(绿色);(d—g)共聚焦图像显示人神经细胞进行神经元标记物Neu N(d)、Tau(e)、SYN(f)、VGLUT1(g)的染色;(h)人神经细胞诱导效率;(i)诱导产生的Tuj1+/Dcx+、Tuj1+/Map2+和Tuj1+/Neu N+人神经细胞在细胞总数中的比例。(图片改自[18])
2015年8月6日,国家蛋白质科学研究(上海)设施复合激光显微镜系统用户、中科院上海生科院生化细胞研究所的裴钢研究组,在国际学术期刊Cell Stem Cell在线版上发表了最新研究成果[18],报道了该组应用小分子化合物,组合诱导人成纤维细胞转化为神经细胞的最新成果。这种化合物诱导的人神经细胞(hciNs),具有与对照神经元相似的电生理特性,具有神经元基因表达谱特征。他们还利用小分子化合物,将家族性阿尔茨海默病患者的成纤维细胞,诱导成神经细胞(图8-55)。由这些转化所获得的神经细胞,表现出阿尔茨海默病的部分病理特征。在裴钢、赵简以及禹永春的指导下,胡文祥、裘斌龙和关武强等人尝试通过小分子化合物的组合,将人成纤维细胞直接转分化为神经细胞。他们的成果表明,一些小分子化合物可以诱导正常人和阿尔茨海默病患者的成纤维细胞直接向神经细胞转化。化合物组合中包括分子HDAC抑制剂VPA、GSK3抑制剂CHIR99021、TGFβ抑制剂repsox、c AMP激活剂forskolin、JNK抑制剂SP600125、PKC抑制剂GO6983和ROCK抑制剂Y-27632。利用上海设施复合激光显微镜系统的共聚焦显微镜Leica TCS SP8拍照观察发现,由成纤维细胞经化合物诱导转分化而获得的神经元,表现出典型神经元形态,并且表达包括神经元特异核蛋白(Neu N)和成熟蛋白质标记物突触素(synaptophysin,SYN)等一系列神经元标记物(如图8-56所示)。诱导产生的hciN细胞成熟后,表现出自发的钙瞬变特征,且能够产生重复动作电位、快速钠内向电流和自发性突触后电流等,表明hciN细胞可以形成功能性突触。有趣的是,研究者发现神经祖细胞基因Sox 2、PA x 6、Foxg 1或神经巢蛋白(nestin)基因在诱导过程中未见表达,表明这一化合物诱导方法,使人成纤维细胞快速退出细胞周期,直接转分化而生成hciN细胞。进一步,该化合物也可用于神经疾病模型的构建。该研究组成功地应用化合物组合,将携带突变基因的家族性阿尔茨海默病患者的成纤维细胞,诱导成神经细胞。这些病人来源的hciNs,表现出相应淀粉样蛋白分泌异常等相关的病理特征,表明该化合物的诱导策略是生成患者特异性神经细胞的可行方法,为神经系统疾病模型的构建、相关机制的研究和药物的筛选,提供了一个有用与可行的方法。
8.5.3 利用共聚焦显微镜和流式分析技术,发现在酸性环境中特异性识别凋亡坏死细胞的免疫受体
2015年5月26日,美国科学院院刊(PNAS)在线发表了中科院上海生科院生化细胞研究所何勇宁研究组的研究成果[19]。该组成员曹龙兴等人结合冷冻电镜三维重构技术和相关的分子生物学方法,获得了人源DEC205胞外段的三维结构,并发现该分子在酸性条件和碱性条件下呈现不同的构象。在酸性条件下,该分子形成一个紧凑的双环状构象;而在碱性条件下,双环状构象被打开,呈现具有较大柔性的线性构象。进一步的生化和细胞实验表明,利用流式细胞分析仪BD Calibur和共聚焦显微镜Leica TCS SP8进行检测分析,DEC205在酸性和碱性条件下的构象变化,与其功能直接相关。DEC205仅在酸性条件下识别凋亡和坏死细胞,而对于正常细胞而言,DEC205无论在酸性还是碱性条件下都不会识别。这表明,DEC205是一个在酸性环境中特异性地识别凋亡/坏死细胞的免疫受体,也是到目前为止发现的首个具有这种功能的受体(图8-57)。事实上,酸化与细胞凋亡、肿瘤发生以及炎症都紧密相关,因此关于DEC205的这一研究,意味着新的凋亡细胞清理通路。另外,由于DEC205已被用于针对肿瘤等抗原的免疫疗法,该研究也为相应的抗肿瘤免疫策略提供了新思路。
本成果依托上海设施的电镜分析系统、复合激光显微镜系统、规模化蛋白质制备系统等实验平台,在电镜分析系统上完成了电镜相关数据采集的实验,在复合激光显微镜系统上完成了荧光观察、流式细胞仪细胞筛选等实验,在规模化蛋白质制备系统上利用动态光散射完成了分子半径的测定等实验。
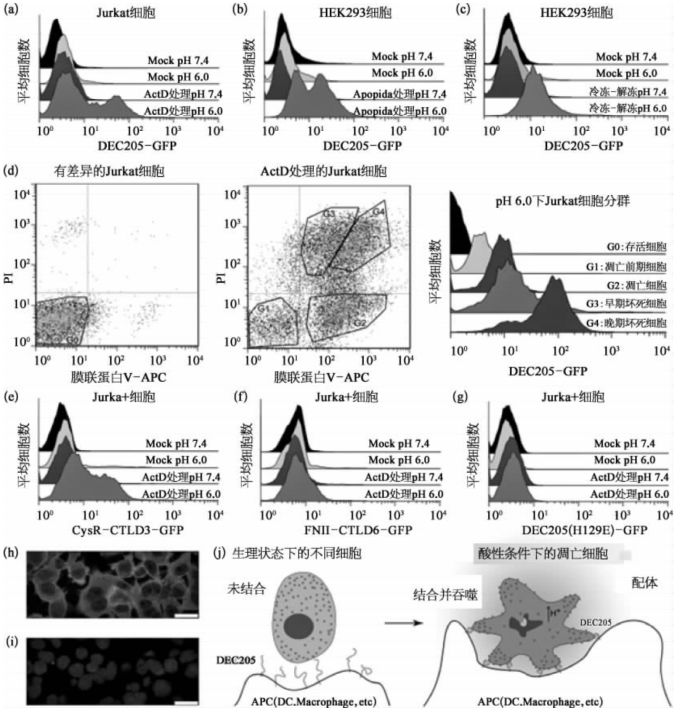
图8-57 免疫受体分子DEC205在不同pH值环境条件下识别凋亡/坏死细胞(彩图见图版第50页)
(a)通过流式分析仪BD Calibur检测,在酸性pH值环境下,DEC205-GFP能结合放线菌素D(ActD)处理过的人外周白血病T细胞(Jurkat细胞);(b)DEC205-GFP能在酸性pH环境中结合Apopida[12]处理过的HEK293细胞;(c)DEC205-GFP能在酸性pH环境中结合冻融HEK293细胞;(d)膜联蛋白V(annexin V)-APC、PI和DEC205-GFP三色荧光标记酸性条件下的Jurkat活细胞(左)和ActD处理的Jurkat细胞(中),右侧结果为结合DEC205这2种细胞在流式图谱中圈定的不同子集比例;(e)CysR-CTLD3-GFP(小环部分)可以在酸性条件下结合ActD处理的Jurkat细胞;(f)在酸性或者中性条件下,FNⅡ-CTLD6-GFP(大环部分)不能结合到ActD处理过的Jurkat细胞;(g)在酸性或者中性条件下,DEC205(H129E)-GFP不能结合到ActD处理过的Jurkat细胞;(h)对酸性pH 6.0条件下的HEK293,固定通透处理后标记DEC205-GFP和DAPI,利用激光光聚焦显微镜Leica TCS SP8进行成像;(i)在pH 7.4的PBS中,对HEK293细胞进行固定通透处理,荧光标记DEC205-GFP和DAPI,进行共聚焦成像;(j)DEC205在酸性环境中特异地识别凋亡/坏死细胞的模式图。DC,Macrophage,etc:树突状细胞、巨噬细胞等。(图片改自[19])
8.5.4 运用荧光激发流式分选技术,研究证明炎症相关的细胞因子组台,可促进肌肉干细胞在体外的长期扩增(图8-58、图8-59)
成体干细胞没有致肿瘤性,其使用不涉及伦理问题,具有较高的安全性,是非常有前途的再生医学治疗的细胞来源。理想的成体干细胞疗法的策略是,从患者或捐献者体内获取少量组织,分离干细胞后在体外扩增出用于移植的足够多的干细胞。这一策略有效地避免了目前疗法中“以损伤修复损伤”的问题,其关键在于建立高效扩增的功能性干细胞。但是,多数成体干细胞难以在体外进行有效的功能性扩增,因而阻碍了成体干细胞在再生医学中的应用。与多数成体干细胞类似,肌肉干细胞很难在体外扩增。同时,肌肉干细胞在体外培养后很快分化为成肌肉祖细胞,失去了在体内修复肌肉损伤的能力。这一问题是阻碍肌肉干细胞用于肌肉相关退行性疾病治疗之主要困难。
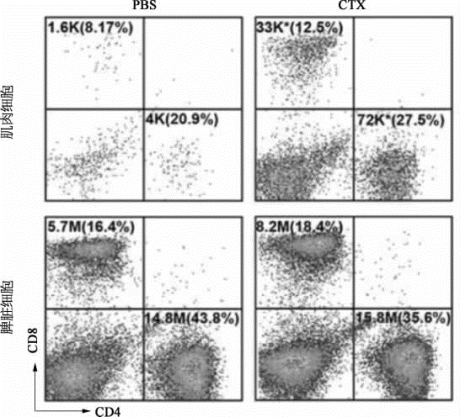
图8-58 应用流式细胞分析仪BD Calibur对T淋巴细胞进行分析(彩图见图版第51页)(https://www.xing528.com)
使用心脏毒素(cardiotoxin,CTX)诱导损伤3 d后,在肌肉和脾脏细胞中,T淋巴细胞CD4阳性或者CD8阳性的细胞数均有显著变化。*代表在统计学上具有显著性,P<0.01。统计结果是由3次独立的实验计算而来。K为103个细胞,M为106个细胞。(图片改自[20])
2015年5月15日,国际专业学术期刊Cell Research在线发表了中科院上海生化细胞研究所胡苹和王红艳研究组合作研究的最新成果[20]。通过研究体内肌肉干细胞增殖的微环境,发现T细胞诱导的急性炎症,是肌肉干细胞增殖的重要微环境。又通过生物化学分析方法,进一步鉴定出T细胞所分泌的最小有效细胞因子组合,发现该细胞因子组合能够像T细胞一样。利用上海设施的荧光激发细胞分选仪BD Influx,进行分离活化肌肉干细胞的操作,能有效地促进肌肉干细胞在体外的增殖和长期传代。长期培养后的肌肉干细胞,不仅保持了高效的体外分化能力,而且能在体内高效修复肌肉损伤。在损伤修复后,移植的肌肉干细胞能够回归正确的干细胞壁龛(niche)[13],并修复后续的肌肉损伤。传代后的肌肉干细胞,在全基因组水平上具有与体内肌肉干细胞相似的表达谱。这一系统的建立,有效地解决了肌肉干细胞在体外培养后迅速丧失干细胞性,无法在体内修复肌肉损伤的问题,为肌肉干细胞用于再生医学治疗奠定了基础。同时,这一工作揭示了免疫细胞、急性炎症与成体干细胞之间的有机联系,为进一步深入研究免疫反应与机体再生的关系奠定了基础。
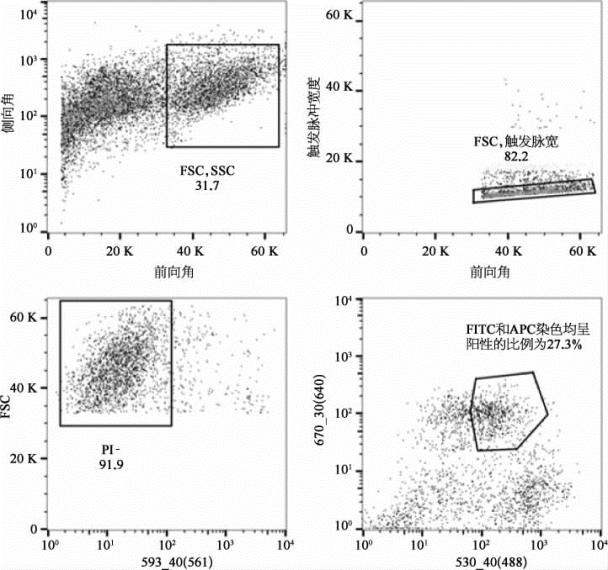
图8-59 用荧光激发流式细胞分选仪分选肌肉干细胞(彩图见图版第51页)
利用胶原酶消化肌肉细胞,用荧光染料抗体anti-CD34/FITC和anti-integrin-α7/APC进行标记,圈出PI呈阴性的活细胞群,再通过荧光激发细胞分选仪(BD Influx),从中分选出FITC、APC呈双阳性的肌肉干细胞。(图片改自[20])
8.5.5 利用超高分辨率显微成像技术和活细胞成像技术,发现提高T细胞抗肿瘤免疫功能的新方法
人体的免疫系统负责保卫机体健康,其中T细胞在肿瘤的监控和杀伤中起着至关重要的作用。然而,肿瘤细胞能够通过多种机制来抑制T细胞的抗肿瘤活性,从而逃避免疫系统的攻击。在临床上,可以通过提高T细胞的活性来治疗肿瘤。目前,基于T细胞的肿瘤免疫治疗,已经取得巨大的成功,具有广泛的应用前景。但是现有的治疗方法仅对部分病人有效,并有一定的副作用。因此,科学家需要开发新的肿瘤免疫治疗方法,以改善疗效,并让更多的病人受益。
中科院上海生科院生化细胞研究所分子生物学国家重点实验室/国家蛋白质科学研究(上海)设施许琛琦研究组和分子生物学国家重点实验室李伯良研究组,从全新角度去研究T细胞的抗肿瘤免疫功能。科研人员认为,通过调控T细胞的“代谢检查点”,可改变其代谢状态,使之获得更强的抗肿瘤效应。2016年3月17日,国际专业学术期刊Nature在线发表了他们的合作研究成果[21]。他们发现“代谢检查点”可以调控T细胞的抗肿瘤活性,并鉴定了肿瘤免疫治疗的新靶点——胆固醇酯化酶ACAT1以及相应的小分子药物前体,为开发新的肿瘤免疫治疗方法奠定了基础。研究人员充分利用了超高分辨率显微镜(STORM)、全内反射活细胞成像技术和共聚焦显微成像技术,将它们熟练地应用到课题的不同实验中(如图8-60),从而取得了一系列实验成果。他们发现,T细胞代谢通路中的胆固醇酯化酶ACAT1,是一个很好的调控靶点。抑制ACAT1的活性,可以大大提高CD8+T细胞(又名杀伤性T细胞)的抗肿瘤功能。因为ACAT1被抑制后,杀伤性T细胞质膜上的游离胆固醇水平提高,从而让T细胞的肿瘤抗原免疫应答变得更加高效。同时,科研人员还利用ACAT1的小分子抑制剂avasimibe在小鼠模型中治疗肿瘤,发现该抑制剂具很好的抗肿瘤效应;并且avasimibe与现有的肿瘤免疫治疗临床药物anti-PD-1联用后效果更佳。该项研究开辟了肿瘤免疫治疗研究的一个全新领域,证明细胞代谢对肿瘤免疫应答起到了关键作用,同时发现ACAT1这一新的药物靶点,揭示ACAT1小分子抑制剂的应用前景,为肿瘤免疫治疗提供了新思路与新方法。此研究入选“2016年度中国科技十大成果”。
8.5.6 运用共聚焦显微成像技术,协助研究小G蛋白Arl1调控GEF蛋白BIG1定位的分子机制
膜泡运输是细胞内部以及细胞之间运输大分子物质和颗粒物质的主要途径,它在细胞的营养吸收、免疫调节、信号传导、神经传递等过程中都发挥着非常重要的作用。小G蛋白Rab家族和Arf家族成员,在膜泡运输过程中作为分子开关而发挥其功能作用。它们可以通过与不同效应蛋白质的结合,募集相关的蛋白质到特定细胞器上,激活下游信号通路。GEF蛋白可以激活小G蛋白的活性,使之由结合GDP的非活性状态转变为结合GTP的活性状态。
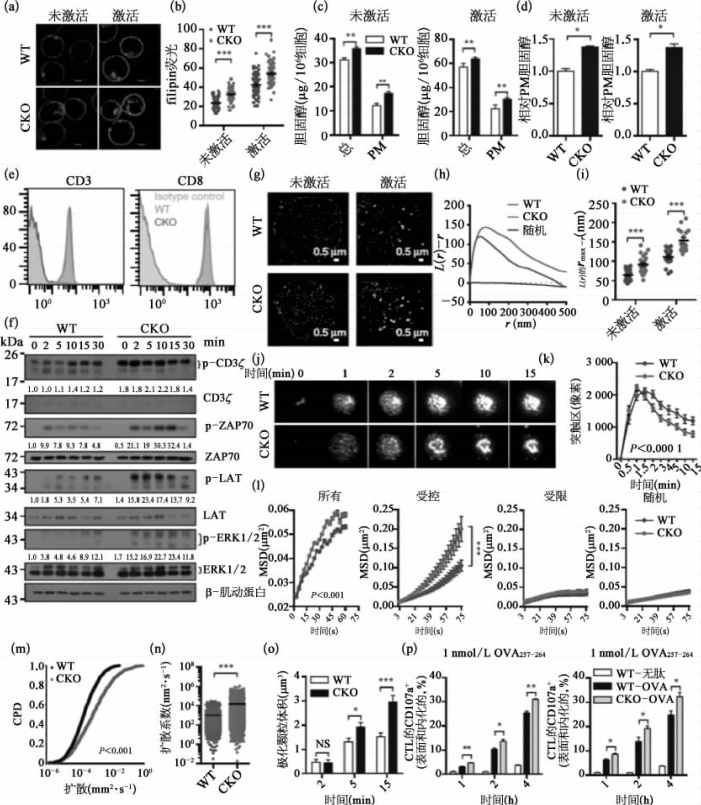
图8-60 细胞质膜胆固醇调节T细饱受体聚集和免疫突触形成(彩图见图版第52页)
(a—d)通过filipinⅢ染色对本底水平和激活的CD8+T细胞的胆固醇进行定量分析(共聚焦显微成像),Acat 1CKO CD8+T细胞质膜的胆固醇水平,比野生型T细胞要高。(e,f)Acat 1CKO CD8+T细胞的TCR信号跟野生型细胞相比,有极大增强。本底Acat1CKO CD8+T细胞的TCR和CD8表面水平并没有增加。(e)本底野生型和CKO CD8+T细胞表面的CD3和CD8表达水平。(f)4μg·ml-1 anti-CD3/CD28刺激的本底CD8+T细胞的TCR信号。(g—i)利用单分子荧光超高分辨率显微镜(STORM)成像分析发现,本底和激活的CD8+T细胞质膜上的TCR聚集,都比野生型细胞中的要大;(j—n)利用活细胞成像,发现ACAT1缺陷导致TCR微团更快地进行定向运动,趋向突触中心。(j,k)全内反射荧光显微镜(TIRFM)分析平面脂质双分子层上CD8+T细胞的免疫突触。(i—n)CD8+T细胞上TCR微团的运动参数。(o,p)细胞溶解型颗粒的极化和脱粒水平在Acat 1CKO CD8+T细胞中扩大了。WT:野生型;CKO:条件性基因敲除;Isotype control:同型对照。(图片改自[21])
中科院上海生科院生化细胞研究所丁建平研究组在内吞体代谢和膜泡运输过程中,对小G蛋白的生物学功能开展了多年的研究工作,先后测定了一些重要的小G蛋白,包括Arl2、Rab5和Rab9等的复合物结构,揭示了它们在膜泡运输过程中的生物学功能及其发挥功能的分子基础。近期又开展了小G蛋白Arl1调控GEF蛋白BIG1在高尔基体反式面定位机制的研究。小G蛋白Arf1调控高尔基体的膜泡运输过程,其活性受GEF蛋白BIG1的调控;而BIG1作为小G蛋白Arl1的效应蛋白质,通过Arl1被招募到高尔基体膜上,激活Arf1。但是,Arl1如何特异性地识别和招募BIG1的分子机制还不清晰。2016年7月19日,国际学术期刊Journal of Molecular Cell Biology在线发表了丁建平研究组的最新研究成果[22],该研究工作揭示了膜泡运输中小G蛋白Arl1介导GEF蛋白BIG1定位在高尔基体反式面的分子基础。
丁建平研究组的王嵘等人运用结构生物学方法,解析了活性状态的Arl1与BIG1的DCB结构域的复合物(Arl1-GTP-DCB)晶体结构(图8-61),发现Arl1-GTP通过“分子开关”结构域,特异性地结合BIG1蛋白N端的DCB结构域,并进一步运用生物化学和共聚焦显微成像技术,验证和分析了Arl1与BIG1之间的相互作用关系,鉴定了参与特异性识别的关键位点,发现Arl1与BIG1的相互作用方式,跟之前已报道的Arl1与效应蛋白质复合物的相互作用方式具有较大差异,基于研究结果提出了Arl1通过与BIG1的相互作用,招募BIG1到高尔基体的反式面,从而级联激活Arf1的分子机制模型。以上研究结果不仅揭示了这些蛋白质在内吞体代谢和膜泡运输过程中的生物学功能,同时也为进一步阐明Arf家族成员之间,以及与其他家族小G蛋白之间功能差异的分子基础,提供了重要的信息。

图8-61 Arl1介导GEF蛋白BIG1定位到反式高尔基体的分子模型(详见下载图8-61,下载网址见31页脚注)
定位在高尔基体膜上的Arl1-GTP,能够与BIG1的DCB结构域结合,招募BIG1到高尔基体反式面上。BIG1的Sec7结构域继而发挥GEF活性,促使Arf1 GDP转变为活性状态的Arf1-GTP。然后Arf1-GTP可以招募一些效应蛋白质如COPI等,到高尔基体反式面,激活下游的膜泡运输过程。(图片引自[22])
8.5.7 蛋白质上海设施用户黄行许课题组成功揭示哺乳动物胚胎染色体三维结构的重编程规律
上海科技大学生命学院黄行许课题组与中科院北京基因组研究所刘江课题组合作,利用少量细胞Hi-C技术,成功地绘制了小鼠雌雄配子以及不同发育阶段胚胎中染色质相互作用的图谱,揭示了哺乳动物早期胚胎发育过程中染色质高级结构动态变化的规律,相关成果于2017年7月13日在国际专业学术期刊Cell上在线发表[23]。
精子和卵发生受精后,细胞核中的染色体如何变化,如何变成正常的细胞染色体,是个一直未破解的科学问题。同时,了解哺乳动物发育过程中染色体高级结构的变化,有利于理解人是如何从受精卵发育成个体的。最近的研究揭示,构成染色质三维结构的单元是拓扑相关区域(topologically associated domain,TAD),它与组蛋白修饰、基因表达以及DNA复制有关。以TAD为基础形成的更高级结构,可分为A组分和B组分(compartment A/B),A组分区域内的基因倾向于转录活化状态,而B组分倾向于失活状态。
基于该研究背景,黄行许课题组和刘江课题组合作,解决了使用少量细胞建立三维染色体结构图谱的难题,从而获得小鼠精子、卵子和早期胚胎染色体高级结构的高分辨率图谱。
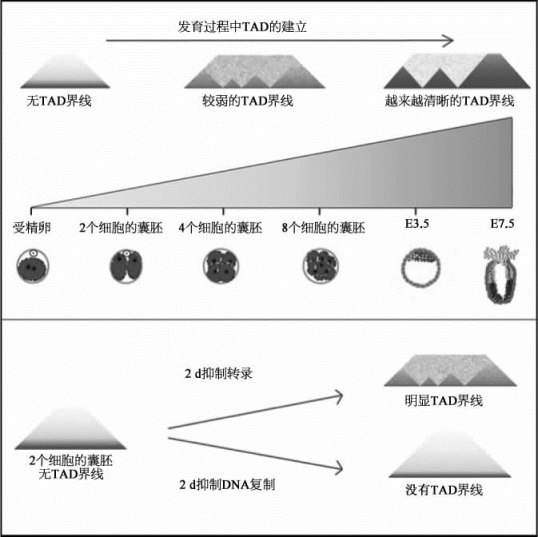
图8-62 早期胚胎发育过程中TAD建立的动态变化模式图(详见下载图862,下载网址见31页脚注)
卵细胞不含有拓扑结构域(TAD),而在精子中普遍存在超远程染色体的相互作用。同时,受精后随着亲本基因组的融合,父源和母源的高级结构变得模糊。但是在胚胎发育进程中,TAD逐渐建立,并在原肠胚阶段形成清晰的TAD界线。(图片改自[23])
研究结果显示(图8-62),卵细胞不含有拓扑结构域(TAD),而在精子中普遍存在超远程染色体的相互作用。同时,受精后随着亲本基因组的融合,父源和母源的高级结构变得模糊。但是在胚胎发育进程中,TAD逐渐建立;而且在原肠胚阶段,形成清晰的TAD界线。研究进一步显示,染色体高级结构的建立,不依赖于受精卵基因组转录的激活,而是依赖于基因组的复制。除此之外,本研究首次发现染色体的高级结构与DNA甲基化的关联,并且发现早期发育的DNA去甲基化,也与染色体的高级结构相关。
上海设施复合激光显微镜系统,针对本研究结果中小鼠胚胎不同细胞周期的统计工作,提供了重要的技术支持。该工作中PI染色后小鼠胚胎的高内涵成像,是在高通量细胞分析仪ThermoFisher Cellomics VTI 700上进行成像和数据分析后整理得到的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




