复合激光显微镜系统的成像及流式设备,由于其应用的范围和方法有所不同,故每一台设备的主要性能及测试指标均有所不同。下面将按照设备的性能进行归类,并阐述不同设备的测试方法及对应的验收指标。
8.4.1 设备测试
8.4.1.1 转盘式激光共聚焦显微成像模块
转盘式激光共聚焦显微镜Zeiss Cell Observer SD的Nipkow双转盘上,分布的针孔多达20 000个(图8-11)。每个针孔的大小是50μm,间隔为250μm,转盘的最大转速可达10 000 r/min。时间分辨率除了与曝光时间、硬件配置等因素有关之外,还与相机的采集速度有关。EMCCD的采集速度,单通道可达到33 fps(frames per second,帧/秒),因此在荧光强度足够的情况下,单通道在理论上的采集速度,最快为33 fps。全内反射荧光(TIRF)是观察细胞质膜表面蛋白质、囊泡等运动的非常好的技术手段(图8-12),对于此设备的测试,除了成像设备常规的x YZ轴分辨率、x Y采图、Z-stack、拼图、多通道采集、多点扫描之外,主要集中于活细胞的TIRF实验,以及在单通道和多通道下的时间分辨率。
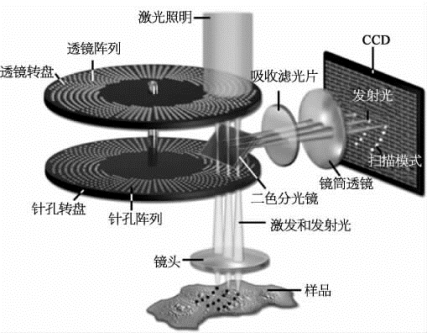
图8-11 转盘式激光共聚焦显微镜光路图(详见下载图8-11,下载网址见31页脚注)
图片改自http://zeiss-campus.magnet.fsu.edu/tutorials/spinningdisk/yokogawa/indexflash.html的Figure 1。
1.扫描速度检测
(1)单相机扫描速度检测
选用500 nm微球为检测样品,使用100×物镜,设置曝光时间为3 ms时单张图片最快扫描时间为34 ms。当把相机曝光时间设置成<3 ms时,测试发现单张图片的最快扫描时间依旧为34 ms(图8-13)。由此可见,由于荧光激发、相机的读出时间和数据传输等因素的限制,34 ms已经达到SD显微镜扫描速度的极限。根据该台设备最快全幅扫描速度30 fps的采集要求,该台设备的时间分辨率验收结果合格。
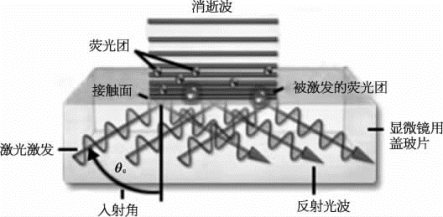
图8-12 全内反射荧光产生的示意图(详见下载图8-12,下载网址见31页脚注)
利用全内反射产生的消逝波照明样品,使照明区域限定在样品表面的一薄层范围内,因此具有其他光学成像技术无法比拟的高的信噪比和对比度,可以用来实现对单个荧光分子的直接探测。(图片改自https://www.microscopyu.com/techniques/fluorescence/total-internal-reflection-fluorescence-tirf-microscopy的Figure 1)

图8-13 单个相机(camera)的时间分辨率检测(彩图见图版第32页)
(a)图像采集的相对时间为0 s;(b)图像采集的相对时间为0.034 s;(c)图像采集的相对时间为0.069 s。
(2)双相机扫描速度检测
在发射光的光路上,放置了一个561 nm的分光镜。低于561 nm的发射光进入左侧相机,高于561 nm的发射光进入上方相机。在每个相机前,设置收集对应通道的滤色片,进一步对发射光进行筛选。因此,可同时进行双色(405/561 nm激发;405/635 nm激发;488/561 nm激发;488/635 nm激发)采集,而无损于时间分辨率(图8-14)。
2.TIRF活细胞成像(活细胞长时程拍摄)
用TIRF技术所激发的,仅是贴近培养皿底部120~200 nm厚的部分,因此尤其适合研究细胞质膜或膜内附近区域单分子的动态过程。用绿色荧光标记细胞质膜表面的受体蛋白,以检测TIRF效果。如图8-15所示,a图为TIRF光路成像的结果,b图为激光垂直照射到样品上的成像结果。由图可见,TIRF 488 nm所采集的图像,是一个圆的面;而EPI 488 nm采集的图像,是一个环。这说明,TIRF成像只激发和收集靠近玻璃底的样品荧光,而当激光垂直照射到样品上时,距离玻璃底200 nm以外、位于细胞质膜上的荧光蛋白也被激发,故而呈环形。因此可证明,TIRF实验可以在此设备上实现。
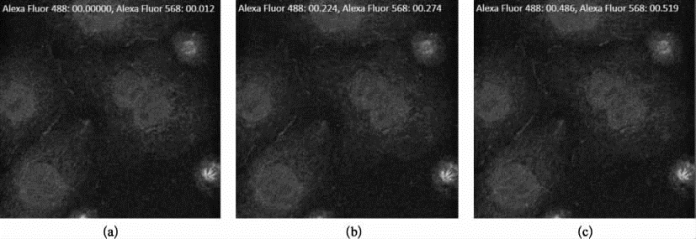
图8-14 双相机同时采集的时间分辨率检测(彩图见图版第32页)
从左到右依次为:(a)绿色荧光采集的相对时间为0 s,红色荧光采集的相对时间为0.012 s;(b)绿色荧光采集的相对时间为0.224 s,红色荧光采集的相对时间为0.274 s;(c)绿色荧光采集的相对时间为0.486 s,红色荧光采集的相对时间为0.519 s。
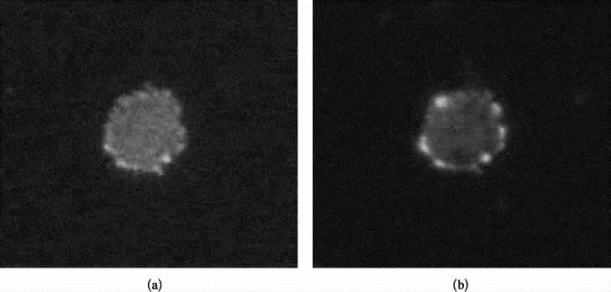
图8-15 TIRF成像与共聚焦成像比较(彩图见图版第32页)
(a)用TIRF光激发细胞质膜表面而产生的荧光成像;(b)激光垂直照射到样品上所产生的荧光成像。
3.SD活细胞的长时程成像
SD活细胞长时程拍摄的测试结果显示,对于胚胎干细胞连续拍摄72 h后,细胞活力未减退,荧光强度与上样之初基本一样(图8-16)。可见,SD上的活细胞培养装置,能够为细胞生长提供恰当的温度、湿度以及CO2浓度条件,且在一定的激光强度和一定的时间范围内光毒性和光漂白较小,仪器上所配置的完美聚焦系统能够保证焦平面不变。这就证明,SD能够用于活细胞的长时程拍摄。
测试的结论是:当满足测试所需的保障条件时,Zeiss Cell Observer SD的各项基本指标均满足要求,达到预期模块的相关设备工艺的验收指标要求;而且相对于普通共聚焦显微镜,有速度快的优势,可进行短时间内荧光信号变化的捕捉;配有TIRF光路,配合活细胞培养装置,可获得贴近培养皿细胞质膜上的蛋白质运动情况信息。主要用于膜蛋白运动的研究。

图8-16 SD研究单倍体胚胎干细胞的发育(彩图见图版第33页)
红色荧光标记为胚胎干细胞的组蛋白H2B,绿色标记为胚胎干细胞的蛋白激酶aurora A。从左到右依次是胚胎干细胞发育0、24、48和72 h后的荧光成像。

图8-17 共聚焦显微镜的光路示意图
8.4.1.2 双光子显微成像模块
双光子显微成像模块,包括单光子激光扫描共聚焦显微镜和双光子显微镜。单光子激光扫描共聚焦显微镜,以单光子激光作为光源。激光器发出的激光,通过照明针孔形成点光源,经过透镜、分光镜形成平行光之后,通过物镜聚焦在样品上,并对样品内聚焦平面上的每一点进行扫描(如图8-17)。样品被激发而产生的荧光,经过分光镜、透镜等被再次聚焦,到达探测针孔(pinhole)处,被后续的光电倍增管(PMT)检测到,而非聚焦光线则被探测针孔阻挡,不能通过探测针孔,因而焦面以外的荧光信号被屏蔽掉[67]。通过对样品x Y轴的逐点扫描,利用计算机进行图像处理并在显示器上成像,得到所需的荧光图像。
与单光子激光扫描共聚焦不同,在双光子荧光成像中,荧光分子在高光子密度的照射下,可以几乎同时吸收2个长波长的光子,发射出1个波长较短的光子(图8-18)[9]。为了能够激发荧光分子发射荧光,双光子成像中通常使用飞秒超短脉冲激光和高数值孔径的物镜。双光子激光经物镜聚焦到样品的一个点上,只激发样品上的一个点产生荧光,所以双光子显微镜不需要针孔滤掉非焦平面以外的光(图8-19)。与共聚焦扫描显微镜相比,双光子荧光成像具有以下特点:①激发、成像深度大;②激发-发射光易分离;③在焦点以外发生化学发光和荧光漂白的可能性小;④检测灵敏度与空间定位性高。
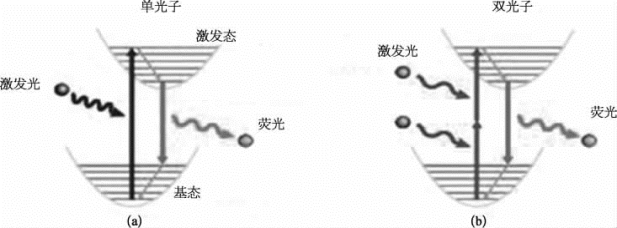
图8-18 单/双光子激发荧光产生的示意图(彩图见图版第33页)
(a)单光子激发产生荧光的示意图;(b)双光子激光产生荧光的示意图。
图8-19 双光子照射样品示意图(彩图见图版第33页)
和单光子显微镜不同的是,只有在焦点的荧光基团受到激发,其他区域都没有受到激发,有效地保护了样品。(图片改自http://www.pooher.com/xinwen/Technical/2013-06-11/434.html的图2)
双光子荧光显微镜分为正置和倒置2个部分。它们共享双光子光路,既可以各得50%的分光,用于两部分同时成像;也可将100%的双光子激光,用于双光子的正置或者倒置部分。其中,正置部分配置有数值孔径(numerical aperture,NA)值0.8、工作距离3.3 mm的40×红外高通水浸物镜,以及数值孔径值1.05、工作距离2 mm的25×红外多光子专用物镜。其中的25×红外多光子专用镜头,具有专门针对680~1 100 nm的红外光校对特性,保证了红外激光的平场性和高会聚性。
1.双光子显微镜
准备荧光标记细胞、组织切片样品或荧光标记的标准样品、荧光微球样品,进行双光子荧光成像。另外,利用转入荧光蛋白的小型实验动物的组织或胚胎,进行双光子显微镜成像实验。
(1)正置荧光显微镜部分(只可做双光子)
转入绿色荧光蛋白(green fluorescent protein,GFP)的小鼠大脑组织,经过透明化SCALE VIEW-A2处理后,放置在正置显微镜下。双光子激光器50%的光,分到此正置显微镜上,920 nm激发,用25×镜头进行深层扫描。扫描厚度为2.2 mm,帧尺寸为512×512(图8-20)。

图8-20 转入GFP的小鼠大脑深层扫描(彩图见图版第34页)
(2)倒置显微镜部分双光子成像
将双光子光路切换到Olympus FV1200的倒置部分,检测倒置部分的双光子实验是否可行。920 nm激发,570~630 nm及380~560 nm波段接收,用25×镜头进行扫描。帧尺寸为1 024×1 024(图8-21)。

图8-21 Olympus FV1200倒置部分的双光子成像检测(彩图见图版第34页)
(a)在倒置显微镜上收集380~560 nm波段所获的图像;(b)在倒置显微镜上收集570~630 nm波段所获的图像。
测试的结论是:当满足测试所需的保障条件时,Olympus FV1200的各项基本指标均满足要求,达到预期模块的相关设备工艺的验收指标要求。还配有活细胞装置,可进行活细胞的单、双光子拍摄。
2.单光子激光共聚焦显微镜
(1)空间分辨率
利用商业化的标准尺寸200 nm直径的荧光微球样品,使用63×物镜、488 nm激发光、512×512像素分辨率、区域放大17倍、400 Hz扫描速度,对其进行扫描,通过分析获取x Y轴和Z轴的分辨率。从x YZ扫描图像中随机选取5个荧光微球,测半高宽(FWHM)并计算平均值。现测得Leica SP8的x Y轴分辨率为247 nm。从x ZY扫描模式的图像中选取5个荧光微球,测Z方向FWHM并计算平均值,测得Z轴分辨率为754 nm。
(2)扫描速度
Leica SP8扫描一幅大小为512×512像素的图像,当点扫描速度为400 Hz时,成像速度达1.29s/帧。
(3)多通道扫描
选取标准样品,使用Leica SP8的10×物镜进行多通道扫描。采取依次线扫(between line)模式,扫描时利用4个数据采集器同时成像。对所得的图像进行观察,以确认每个采集器所获得的图像都无条纹,视场均匀,且可实现4个通道同时成像(图8-22)。
利用最常用的63×物镜,对1μm直径的四色荧光微球进行成像,然后将4个通道的图片进行叠加,应用Leica软件自带的分析功能,在荧光微球上画不同方向的直线,分析线上的荧光强度分布(line profile),从而判断4个通道的重合情况以及色差的有无。如图8-23所示,4个通道的重合情况较好,基本无色差。同理,可对其他物镜进行相同的测试,结果也很好,基本无色差。
(4)多维成像
样品选取同“(3)多通道扫描”。对其进行大区域拼图扫描及三维重构,可以观察设备是否能实现多维采集,并测试软件的自动拼图效果和三维重构效果。
利用Leica TCS SP8显微镜,选取63×物镜,512×512分辨率,400 Hz扫描速度,平均次数均为1。
①拼图扫描:区域放大倍数(zoom)值为1,对标准样品进行4个荧光通道(激发光波长分别为405、488、561和633 nm)与明场(激发光波长为488 nm)的拼图扫描,拼图视野大小为15×15幅。所获得的拼图图像见图8-24。通过对图像的观察,自动拼图的图像效果很好,无色差,无明显拼缝,无错位。
②三维重构:区域放大倍数值为0.75,对标准样品进行4个荧光通道(激发光同上)的三维成像,Z轴移动步径(Z-step size)为0.49μm,光切片49层,合计Z轴厚度23.5μm。重构后的图像如图8-25。软件自带三维重构模块,图像处理的效果佳。

图8-22 Leica标样(铃兰草根部切片)的多通道扫描(彩图见图版第35页)
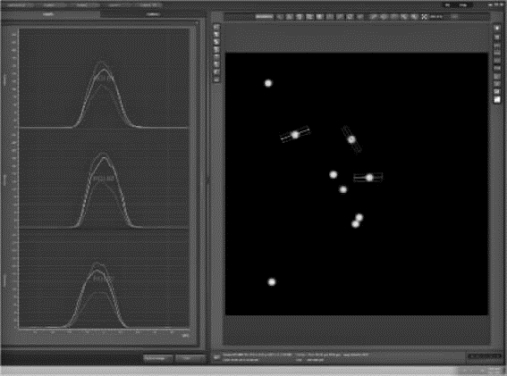
图8-23 荧光微球图像的线强度分析示意图(彩图见图版第35页)
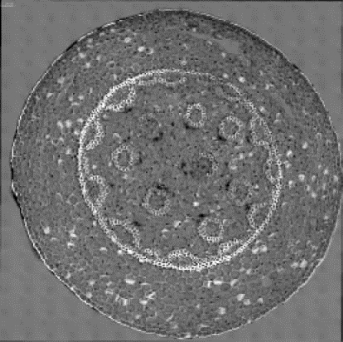
图8-24 4个荧光通道及明场拼图图像的重合(彩图见图版第36页)

图8-25 Leica标样的多通道三维重构立体图像(彩图见图版第36页)
(5)钙流实验
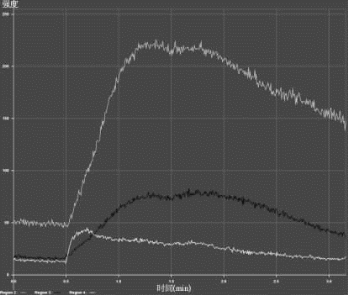
图8-26 钙流实验(详见下载图8-26,下载网址见31页脚注)
Fluo-4结合Ca2+,在0.5 s给药后,3个感兴趣区域内的荧光强度(分别以绿色、蓝色和黄色曲线表征)明显增强,说明Ca2+浓度增大。Region:区域。
Zeiss LSM710还配有活细胞培养装置,可进行活细胞的长时程拍摄。在此过程中可给予加药刺激,适用于钙流实验。样品来自中科院上海生科院生化细胞研究所许琛琦组的郭兴东,Fluo-4结合Ca2+,在0.5 s给药后,3个感兴趣区域内的荧光强度明显增强,说明Ca2+浓度增大(图8-26)。
(6)FRAP实验
样品为酵母,研究对象为纺锤丝,通过对感兴趣区域内的荧光进行漂白以及对恢复期的荧光强度进行检测,来判断纺锤丝上的蛋白质是否有运动或者相互作用。从图8-27可以看出,感兴趣区域在漂白后迅速恢复,说明运动剧烈。
(7)荧光共振能量转移实验
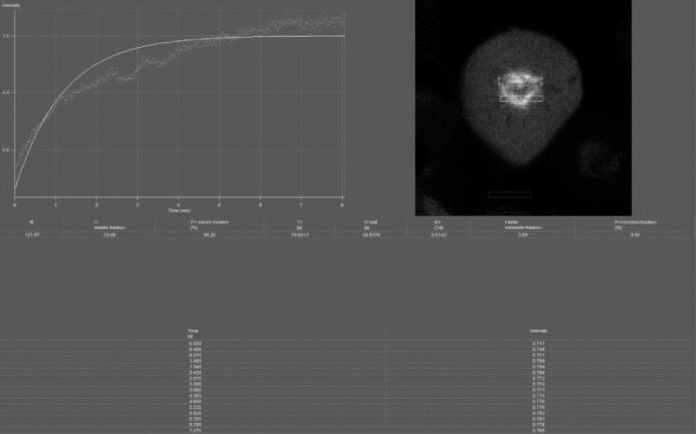
图8-27 FRAP实验(详见下载图8-27,下载网址见31页脚注)
酵母纺锤丝,通过对感兴趣区域内荧光漂白后恢复的荧光强度检测发现,恢复迅速,说明运动强烈。
荧光共振能量转移(FRET)是指在2个不同的荧光分子中,如果其中1个荧光分子(供体,donor)的发射光谱与另一个荧光分子(受体,acceptor)的吸收光谱有一定的重叠,则当这2个荧光基团之间的距离合适时,供体荧光分子的激发,能够诱发受体分子发出荧光,同时供体荧光分子自身的荧光强度衰减,即荧光能量由供体向受体转移。在生物体内,如果2个蛋白质分子的距离在10 nm之内,一般认为这2个蛋白质分子之间存在直接的相互作用。FRET的程度与供、受体分子的空间距离紧密相关,一般在7~10 nm时即可发生FRET;随着距离延长,FRET呈显著减弱。利用FRET实验,可以判断2种蛋白质在细胞内是否有相互作用。
本次试验采用受体荧光淬灭的方法(FRET acceptor photobleaching)。选定了待分析的区域之后,软件自带的分析功能可以直接算出FRET效率,选定区域(ROI.01)[6]的FRET效率达到25.9%,细胞上受体未淬灭的区域(ROI.02)为4.63%,而背景参照区域(ROI.03)为0。由此可知,这2种待研究的蛋白质存在明显的相互作用(图8-28)。
![]()
其中,D post是淬灭之后供体的荧光强度,D pre是淬灭之前供体的荧光强度。
(8)光谱扫描实验
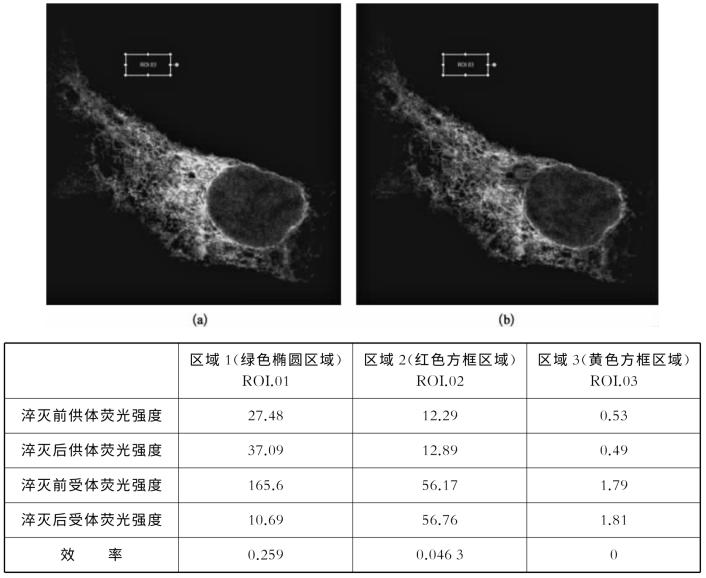
图8-28 荧光共振能量转移受体光漂白实验(彩图见图版第36页)
(a)淬灭之前的细胞图像;(b)淬灭之后的细胞图像。表格是选定的3个不同区域的荧光强度和FRET效率。淬灭前供体:donor pre;淬灭后供体:donor post;淬灭前受体:acceptor pre;淬灭后受体:acceptor post;效率:efficiency;ROI:感兴趣区域。
样品为中科院生化细胞所用户廖侃组所提供的原代小鼠毛细血管内皮细胞,被标记了某种荧光素,利用63×物镜、633 nm激光器激发,利用光谱扫描模式,对样品进行成像。设定收集波段的范围为640~745 nm,探测波宽5 nm,每步间距为5 nm。使用Leica软件自带的分析功能(stack profile),圈出一个感兴趣的区域,对所取得的图像进行荧光强度分析,可以绘制出该染料的发射波谱(见图8-29)。峰值位置在655 nm,而质心位置(center of mass position)在667.2 nm。
测试的结论是:当满足测试所需的保障条件时,2台Leica SP8和1台Zeiss LSM 710单光子共聚焦显微镜的各项基本指标均已满足要求,达到预期模块的相关设备工艺的验收指标要求。而且这3台显微镜的功能齐全,可进行多通道扫描、大区域拼图扫描、三维重构、长时程成像、光谱扫描、FRAP实验、FRET实验等,功能参数达标。
8.4.1.3 超高分辨率显微成像模块
1.结构照明超高分辨率显微镜(SIM)
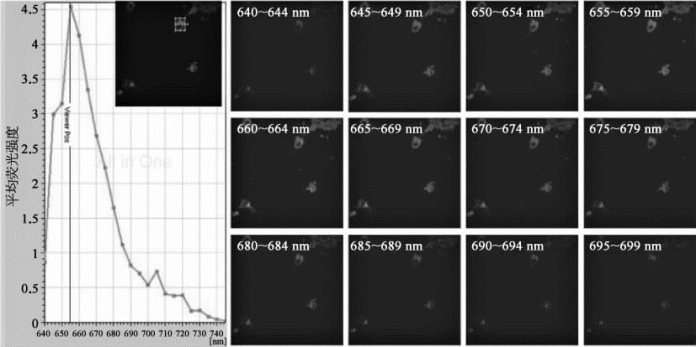
图8-29 荧光标记细胞样品的光谱扫描(彩图见图版第37页)
左边图指示的是框中区域平均荧光强度与接收波长的对应曲线;右边图像为不同接收波段的对应荧光图像。
在SIM成像中,照明光路中插入空间调制器(比如光栅),物体(包括荧光标记与非荧光标记的样本)被调制光(类似于条形码)所照明[10]。在实验中,不同相位与方向的结构光,依次照明物体(2D-SIM是3个角度、3个相位,3D-SIM是3个角度、5个相位)。它们和物体在不同的角度混频所产生的莫尔条纹(见图8-30)被相机依次采集,并通过特定的计算,生成超高分辨率的图像。最终重建的SIM图像,具有高于传统显微镜图像2倍的空间分辨率。SIM超高分辨率成像技术对样品的要求少,完全兼容现有的荧光分子和荧光染料,无须改变任何实验流程,时间分辨率高。利用标准尺寸荧光微球、标准荧光标记的细胞样品,以及用户提供的荧光样品,对该设备的各项性能及功能指标进行测试。主要测试结果如下。

图8-30 莫尔现象
(a)未知结构的样品;(b)已知结构的照明模式;(c)莫尔条纹:2个结构重叠,空间频率不同的地方会产生莫尔条纹,将高频信号转化为低频信号,从而可以被显微镜观察到[11]。
(1)空间分辨率
利用488 nm激发光,对100 nm直径的荧光微球成像。通过测量荧光信号的FWHM,检测SIM成像的空间分辨率。3D SIM模式成像的x Y轴分辨率可达到110~140 nm左右,Z轴分辨率可达到350~400 nm;2D SIM成像的x Y分辨率可达到100~130 nm;TIRF-SIM成像的x Y分辨率可达到85~90 nm。不同波长激发光成像的分辨率略有差别。
(2)成像速度
在3D-SIM拍照模式、曝光100 ms、10 MHz和14 B(比特)灰阶的情况下,获取1张超高分辨率原始图像需2.1 s。在2D-SIM拍摄模式的相同条件下,获取1张超高分辨率原始图片需1.34 s。合成、保存和导出图像共需5 min左右。根据不同的样品,需要调整重组图像的参数。因此,获得1张超高分辨率的图像,平均约需15 min。每次成像都须插入相应的光栅格子进行校正,校正一次大概需30 min。
(3)多维成像
①多通道扫描
利用对荧光标记样品的成像,检测仪器的功能指标。通过对已有样品的成像,证实该设备可以进行多通道、多层和时间序列的超高分辨率成像。利用尼康(Nikon)软件可以对取得的图像进行简单分析,例如三维重构、荧光强度、空间测量等。
对商业化荧光标记的标准固定细胞样品,进行SIM成像和宽场成像,对所得的图像进行对比。SIM图像的信噪比、对比度和分辨率均明显优于宽场图像。获得的图像如图8-31所示。
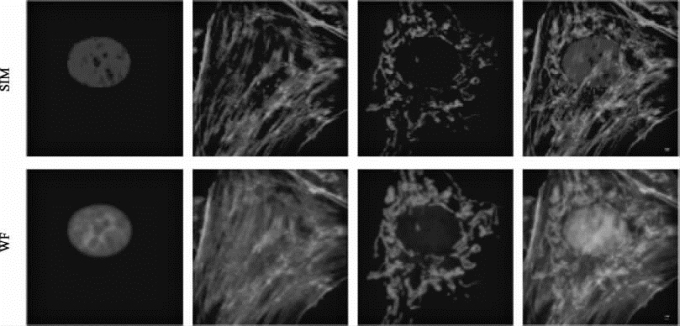
图8-31 固定细胞样品的宽场及SIM图像的对比(彩图见图版第37页)
蓝色标记细胞核,绿色标记肌动蛋白(actin),红色标记线粒体。上方代表3D-SIM所得的图像,下方代表宽场照明模式所得的图像。
在多色实验样品成像之前,利用校正小程序对荧光微球的多通道所得图像进行色差校正,所得校正参数可应用于实验样品的色差校正。从图8-32a可观察到488 nm(绿色)和561 nm(红色)通道重合较好,405 nm通道(蓝色)和640 nm通道(紫红色)偏离明显。经过校正程序对所得图像进行校正之后,图8-32b的4个通道重合良好。

图8-32 SIM多通道图像的色差校正(彩图见图版第38页)
(a)校正之前1μm直径荧光微球的四色叠加图像;(b)色差校正之后四色荧光微球的叠加图像。标尺为1μm。
②Z轴多层扫描(三维重构)
对四色固定细胞样品进行多层扫描,步距为200 nm。将整个细胞的厚度信息都覆盖,对所得的图像进行三维重构和最大荧光强度投影(见图8-33)。可用于研究细胞内蛋白质的分布及与细胞骨架相互间的关系,从而为蛋白质的功能研究提供有力证据。从所得的图像可以看出微管(绿色)清晰的网状结构,以及待研究蛋白质在细胞内的不同分布模式。
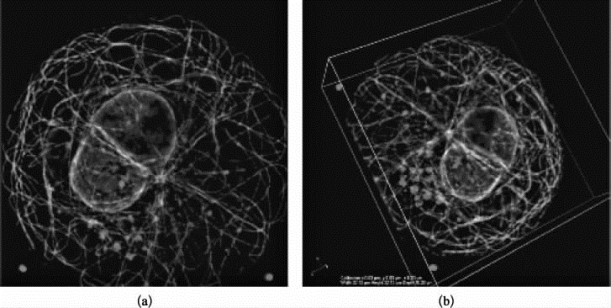
图8-33 四色荧光固定细胞样品的多层扫描图片(彩图见图版第38页)
绿色标记微管,蓝色标记细胞核,红色和紫色标记的是不同的2种待研究蛋白质。(a)多层图像的最大荧光强度投影;(b)立体三维重构图。
对多色固定细胞样品进行Z轴多层扫描,可以在超微结构上对蛋白质之间的位置和功能关系进行研究。如图8-34,可以从不同的角度和切面,去观察2种蛋白质之间的位置关系,发现红色标记的蛋白质包裹着绿色标记的蛋白质。

图8-34 不同蛋白质空间分布的SIM图像(彩图见图版第39页)
(a)G2时期的APRE19细胞中有被标记的FIGL-1(红色)和中心体蛋白(绿色),细胞核被标记蓝色。标尺5μm。(b)a图箭头放大部分的图像。标尺0.5μm。(c)b图箭头所指位置的纵切面图。(图片引自[12])
③时间序列扫描

图8-35 应用时间序列SIM图像观察MEF细胞中肌动蛋白的动态组装过程(标尺为1μm)(彩图见图版第39页)
该设备配备了活细胞培养装置,可以进行活细胞的超高分辨率成像。对转染了红色荧光蛋白(red fluorescent protein,RFP)融合蛋白的MEF细胞(由用户提供样品)进行超分辨率时间序列成像,观察活细胞中肌动蛋白(actin)的组装,时间间隔为每幅8.8 s(图8-35)。
测试的结论是:当满足测试所需的保障条件时,结构照明超高分辨率显微镜N-SIM的各项基本指标均满足要求,达到预期超高分辨率模块的相关设备工艺的验收指标要求。
2.随机光学重构超高分辨率显微镜(N-STORM)
利用荧光分子的亮-暗态转换,使用特定波长的光激活探针,再用另一个波长的光来观察、精确定位和漂白分子。每次随机地激活和激发部分荧光分子,通过特定的算法拟合标记其位置。重复此过程,采集成千上万幅图像,对样本所有的荧光分子进行定位,重构出超分辨率图像(见图8-36)。分辨率可以突破光学分辨率的极限,达到纳米的尺度级别[13]。STORM成像对样品要求比较高,需要具有光闪烁性质的荧光分子,用以标记样品,且成像时需要根据所用的荧光分子,使用特制的样品缓冲液。
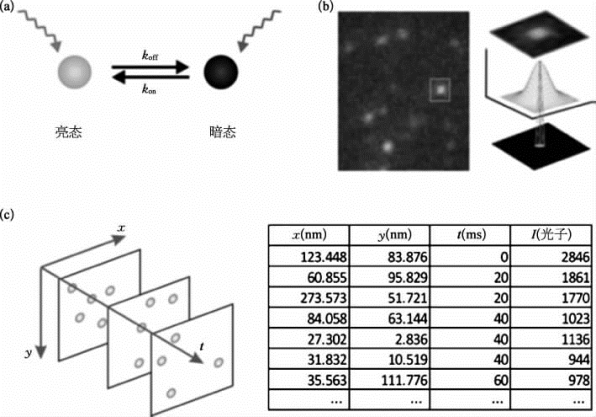
图8-36 单分子超高分辨率显微镜的成像原理(详见下载图8-36,下载网址见31页脚注)
(a)在照射光的作用下,光转换荧光分子实现亮-暗态的转换。(b)一次随机激活若干个荧光分子,通过拟合点扩散函数,确定单个荧光分子的位置。(c)通过单点的坐标,重构超高分辨率的图像。(图片引自[11])
(1)空间分辨率(https://www.xing528.com)
利用Alexa647标记的荧光二抗蛋白和N-STORM双标(Alexa405-Alexa647)荧光二抗蛋白,将制备的抗体均匀涂布在玻璃底的8孔板里。对其进行STORM成像,获取单分子点的定位信息,检测STORM成像的空间分辨率。根据单分子点坐标计算点的分布直径(FWHM即分辨率),x Y轴分辨率可达到25 nm,Z轴分辨率可达到50 nm。举例如图8-37。

图8-37 Alexa405Alexa647双标二抗的单分子点分布直径
(a)代表xy轴单分子点的分布直径;(b)代表Z轴单分子点的分布直径。数据是从15张STORM图像中选取55个荧光分子(对每个分子的闪烁有超过5次定位)进行分析的结果。(图片引自[14])
(2)STORM的成像速度
在每帧256×256像素大小情况下,收一张单分子图所需的时间是52~53 ms,一般获得1张超高分辨率图像,需要获取1万~5万张单分子图,采图一般耗时10~30 min,分析、合成、保存和导出图像共需要15 min左右,因此获得1张超高分辨率图像至少需要40~60 min。而且每次成像都须配制新鲜的成像缓冲液,缓冲液的有效时间约1~2 h。
(3)多维成像(功能测试)
①双色成像研究细胞骨架
使用经Alexa405-Alexa647和CY3-Alexa647染料成对标记的二抗,分别对COS7细胞中的微管和线粒体进行免疫荧光标记。通过N-STORM成像模式,对样品进行2D-STORM成像(图8-38)。

图8-38 COS7细胞中微管和线粒体的形态(彩图见图版第40页)
(a)微管(绿色);(b)线粒体(红色);(c)重合图像。图中标尺为1μm。
②通过三维重构研究染色质上蛋白质的分布
使用经Alexa405-Alexa647和CY3-Alexa647染料标记的二抗,分别对染色体上2种蛋白质进行免疫荧光标记(样品由南京医科大学用户提供)。通过N-STORM成像模式,对样品进行三维扫描。研究2种蛋白质在染色质上的分布情况(图8-39)。
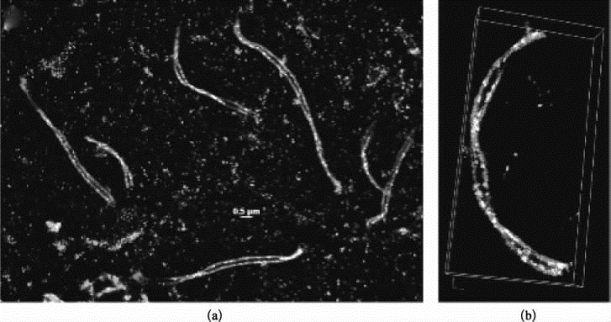
图8-39 染色体上的蛋白质分布(彩图见图版第40页)
(a)大视野下二维图像显示染色体上2种蛋白质的不同分布;(b)放大的一条染色体的三维立体图。
③结合全内反射照明,研究细胞质膜上受体蛋白质的分布
在淋巴细胞中转染m Eos融合蛋白,并且用Alexa647标记细胞质膜上的某种受体蛋白质(中科院生化细胞研究所许琛琦组的样品)。调整入射光角度,在全内反射(TIRF)照明的角度范围下,利用STORM对细胞质膜附近的荧光分子进行成像。研究2种分子在淋巴细胞质膜上的分布(图8-40)。

图8-40 淋巴细胞质膜上2种分子的不同分布模式(彩图见图版第40页)
(a)转染的m Eos融合蛋白在细胞质膜上的分布;(b)Alexa 647标记的某种受体蛋白质在细胞质膜上的分布;(c)2个通道的叠加图像。标尺为1μm。
通过对已有样品的成像,证实可以进行2D-STORM和3D-STORM模式的扫描,可以做单色和双色的STORM成像,而且均能得到不错的图像。
测试的结论是:当满足测试所需保障条件时,随机光学重建超高分辨率显微镜NSTORM的各项基本指标均已满足要求,达到预期超高分辨率模块的相关设备工艺的验收指标要求。
8.4.1.4 高通量细胞分析模块
1.高通量细胞分析仪
高通量细胞分析仪(ThermoFisher Cellomics Array Scan VTI 700)通过自动化的细胞成像,综合生物信息学,对群体细胞表型进行定量分析,将细胞图像转化为数值数据。
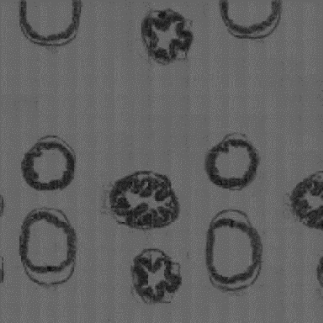
图8-41 载玻片小肠绒毛石蜡切片5倍镜下成像后进行拼图
可以对不同规格微孔板和载玻片的组织样品,对固定细胞样品、固定组织样品和活细胞样品,进行最大视野校正后的扫描成像,以及进行生物学图像分析和数据统计。
(1)硬件聚焦模块测试
①测试Greinar、Corning等品牌的6、12、24、48、96和384孔微孔板和载玻片组织样品,均可以进行最大视野校正后扫描,并可以通过微调Offset(补偿)以提高成像的聚焦效果,如图8-41。
②多通道荧光扫描。同时进行6个通道的检测,包括5个荧光通道和1个明场透射光通道。各通道的荧光信号以及明视野图像,可以叠加效果,如图8-42所示。

图8-42 用高通量细胞成像仪进行多通道成像(彩图见图版第41页)
(a)筛选小分子化合物库神经干细胞增殖的影响;(b)通过观察巨噬细胞吞噬荧光标记微球,来监视淋巴细胞的活化和黏附。
③单通道荧光扫描。以Hoechst染细胞核的96孔板细胞样本,10×物镜每孔5个视野,连续测试4块孔板,扫描时间分别为7′31″、6′55″、13′6″、9′48″,平均速度为9′20″,可以达到45块96孔板/d(耗时约7 h,不包括换样品时间)。
④测试2.5×、5×、10×、20×、40×和63×长工作距离的自动对焦物镜,以及各数值孔径参数。CCD冷却温度<-30℃,有效像素达到1 024×1 024。
(2)明场相差观察模块
安装LED白光光源,对无荧光标记时细胞的生长和形态进行观察,消除色差、DIC相差,可与荧光图片进行叠加展示及分析。
(3)共聚焦模块
对于Cr EST-X Light Confocal高速双孔转盘共聚焦系统,在测试时配合LED固态光源,利用40和70μm双孔设计、防反射转盘,调节转速在10 000~18 000 r/min。测试共聚焦成像在不同Z片层间距的精度值,精度达到0.1μm。
(4)在位液体处理工作站
①在4位的样品台上,将96孔板放置于4位样品台的1号位,孵育温度设置为37℃。专用一次性枪头,以双蒸水(dd H 2 O)作为测试样品,测试加样体积3、10、50和200μl,吸液速度为50μl/min,加至96孔板中,并重复做3次。与校正好的同量程的Eppendorf移液器取液进行比较,结果均一致。
②再取100μl的dd H 2 O,以每孔20μl分液至96孔板中,比较5个孔的差异,结果均一致。
③连续取样20μl,选择东南西北4个方位的角度进行靠壁加样,至96孔板中。反复观察20次,无液滴悬挂现象。
(5)活细胞模块
①三维恒湿控温设置37℃,CO 2浓度5%,相对饱和湿度接近100%。观察软件界面中温度和CO2浓度波动。-0.2℃≤温度误差≤+0.2℃;CO2浓度误差≤0.1%。
②测试Hoechst标记的活体样品293T细胞。连续检测72 h,未发现细胞有污染死亡现象。同倍数、同视野下的细胞核数目持续增长,并至饱和。
③为检测活细胞实时监控图像,获取Hoechst单染的293T细胞,利用在位液体工作站自动加样,采用动力学扫描(kinetic scan)的模式,每孔选取1个视野,在10×物镜下连续观察10 s。96孔板的完成时间为50′35″,每天可完成8块96孔板,如图8-43所示。
(6)分析工作站
①利用系统图库中的标准图片来进行。采取HCS View查阅软件及DiscScan软件,完成19大类生物学应用的图像分析。
②完成测试图像工作站、控制主机与服务器的网络通信以及与外网的连接,在网关(gate)开放的前提下,利用HCS Explore Software软件来进行远程分析、远程诊断和远程访问,确保随时随地可以通过互联网使用网络浏览器进行控制、分析、数据统计,进行高内涵筛选(high content screening,HCS)计算。

图8-43 活细胞经机械臂的实时药物刺激
动力学扫描成像,利用HCSExplore Software软件,计算细胞质内Ca2+内流入核的状态。
2.自动移液工作站
自动移液工作站配置96通道移液器、移板机械手、吸头装载、条形码识别、振荡孵育、抽滤模块和红外漫反射安全保护装置,整合自动分液仪和洗板机。通过程序控制,完成高通量实验过程中所需的几乎所有液体处理工作。
(1)编制并运行所有工具的抓取及放回程序,工具架位置识别准确性要达到100%。
(2)编制并运行Gripper抓板程序,将96孔板放置到所有可放置的自动定位器(ALP)上,检测所有的ALP位置,准确性要达到100%。
(3)针对用户所配置的所有工具,编制并运行移液150、50、10、1μl的测试程序。用水和柠檬黄水溶液进行实际液体测试,150、50、10、1μl的准确性误差要均小于3%,移液精度误差均小于5%。并进行连续梯度稀释,在检测仪器的线性范围内,稀释梯度CV<5%,如表8-2所示。
表8-2 柠檬黄吸收光法梯度稀释后8个重复孔所测光吸收值的比较

(续表)
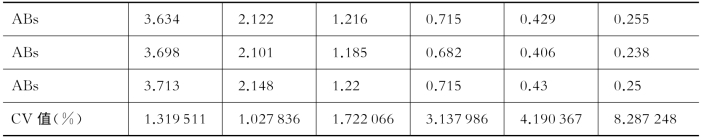
ABs:吸光度值。
(4)编制所有主动ALP(如Shaker、Peltier等)的运行程序。各主动ALP的联机情况良好,位置识别的准确性达到100%。
(5)测试条形码读码器,测试运行在30%、50%、80%、100%速度下的扫描正确率达到100%。
(6)测试整合的Multidrop Combi自动分液器,编写程序:移板→连续自动分液→自动加样→微孔板归位,整体运行速度和连贯性均须正常。
测试的结论是:自动移液工作站、自动分液仪、电动移液器和洗板机经测试,工作正常。以重量法和比色法测试得到的标准曲线误差以及重复性,在正常范围之内。其他的辅助设备层流罩、不间断电源(UPS)和CO 2培养箱的安装测试正常,使用良好。①在高通量细胞分析仪Cellomics单通道荧光扫描模式下,96孔标准样品的单视野成像时间为3.8 min,在多通道双荧光扫描模式下为4.2 min,基本可达到单通道和双通道扫描速度的标准。对于单通道荧光扫描,以Hoechst染色、96孔板为样本,采取10×物镜,每孔5个视野,连续测试4块孔板,平均速度为9′20″,可达到45块96孔板/d。②对于活细胞实时监控图像,获取Hoechst单染的293T细胞,采取动态扫描(kinetic scan)的模式。96孔板的完成时间为50′35″,一天可以完成8块96孔板。高通量细胞分析仪及配套设备自动移液工作站的各项基本指标均满足要求,达到预期系统模块的相关设备工艺的验收指标要求。
3.荧光激发细胞分选仪(BD Influx)
流式细胞仪是在光电子技术、激光技术、荧光化学、单克隆抗体技术及计算机技术等交叉融合的基础上,发展起来的一种先进的生物医学仪器设备。流式细胞术就是利用流式细胞仪对细胞进行快速、多参数分析或分选的技术。
流式细胞仪的工作原理是(图8-44):待测样本的细胞悬液,受到鞘液的包裹和约束,形成细胞液柱,当通过流式细胞仪的检测区时,细胞液柱中的细胞在入射的激光束照射下,产生前向散射(forward scatter,FSC)光和侧向散射(side scatter,SSC)光,若带有荧光素标记还会发射特定波长的荧光。这些光信号经过光电转换、放大及计算机分析系统等的处理后,以流式分析特有的数据格式储存起来。若要对目标细胞进行分选,可通过分选系统对含有目标单细胞的液滴进行充电。当液滴通过由平行板形成的静电场时,带正(负)电荷的液滴即向负(正)极偏转,没有充电的液滴垂直下落,从而使目标细胞因与其他细胞和空白液体在电荷上存在差异,而被区分并被收集[8]。
(1)优化激光荧光通道
配制彩虹校准微球(rainbow bead)溶液,在BD Influx上检测微球的RCV值[7]。

图8-44 细胞分选原理图(详见下载图8-44,下载网址见31页脚注)
单细胞悬液染色后经过喷嘴,在低压高频振荡后,多荧光激发检测后判断是否为所圈定的细胞群,经充电后在电场内偏转流入细胞收集管,完成细胞分选。(图片引自[15])
表8-3 彩虹校准微球在不同激光器下的不同荧光通道的RCV值
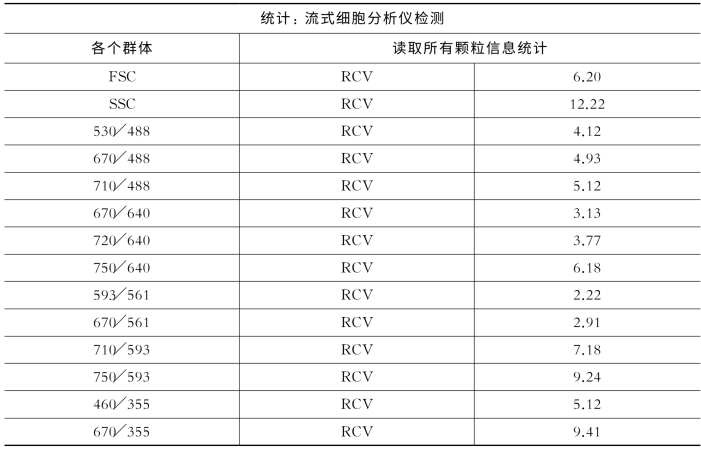
图8-45中所显示在不同激光器下的不同荧光通道的二维散点图中,彩虹校准微球的聚集状态非常好。表8-3显示所得到的RCV值大部分均小于8%,只有几个长通通道下彩虹校准微球的RCV值偏大。所以,仪器状态符合使用要求。
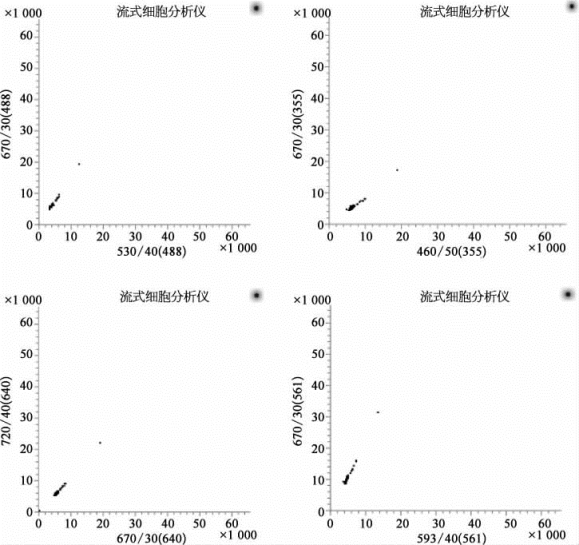
图8-45 彩虹校准微球在不同激光器下的不同荧光通道的二维散点图
(2)优化液滴的延迟时间
配制液滴延迟校准微球(accudrop bead)溶液,在分选仪BD Influx上检测微球,在分选分布(Sort Layout)窗口下选择液滴延迟时间设置(Accudrop Setup),通过调节分选设置(Sort Settings)窗口中的计算(Calculate)值,完成液滴延迟时间,以提高分选纯度。
如图8-46所示,经过液滴延迟优化以后,使用488 nm激光器分选胶质瘤干细胞的GFP阳性细胞群。在分群不明显的情况下,回测后的细胞纯度均能达到90%以上。所以,通过调节液滴的延迟,能有效提高分选纯度。
(3)乳腺干细胞的分选
使用561、640 nm激光器,对双色标记的小鼠乳腺干细胞的单细胞悬浮液进行分析,对目标细胞的设门进行两路分选。
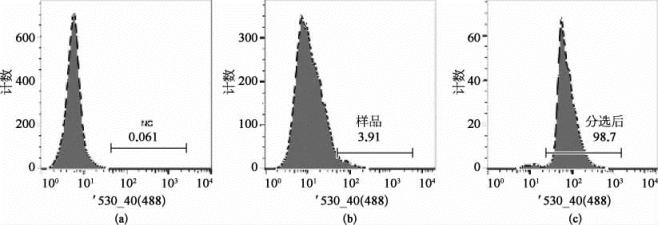
图8-46 胶质瘤干细胞GFP阳性群在分选前后的结果
(a)阴性对照流式检测图;(b)流式分选前进行检测的结果;(c)细胞悬液经分选后对所得分选细胞进行流式检测仪回测的结果图。
如图8-47所示,FSC-SSC散点图中的细胞分为3群,用P1门选中乳腺干细胞,再用P2门去掉黏连的细胞,使用P3门将PI阳性的死细胞去掉,最后用P4、P5门分别圈出APC弱阳性和强阳性的细胞。

图8-47 PI、APC标记的小鼠乳腺干细胞(彩图见图版第41页)
从图8-47可以看出,在640 nm激光器下,标记APC的乳腺干细胞弱阳性和强阳性细胞的分群状况明显,且实验分选效果良好。
(4)肌肉干细胞的分选
使用488、561和640 nm激光器对FITC、PerCP-Cy5.5、PI、APC、Alexa Fluor 700标记的小鼠肌肉干细胞的单细胞悬浮液进行分析,对目标细胞设门进行两路分选(图8-48)。
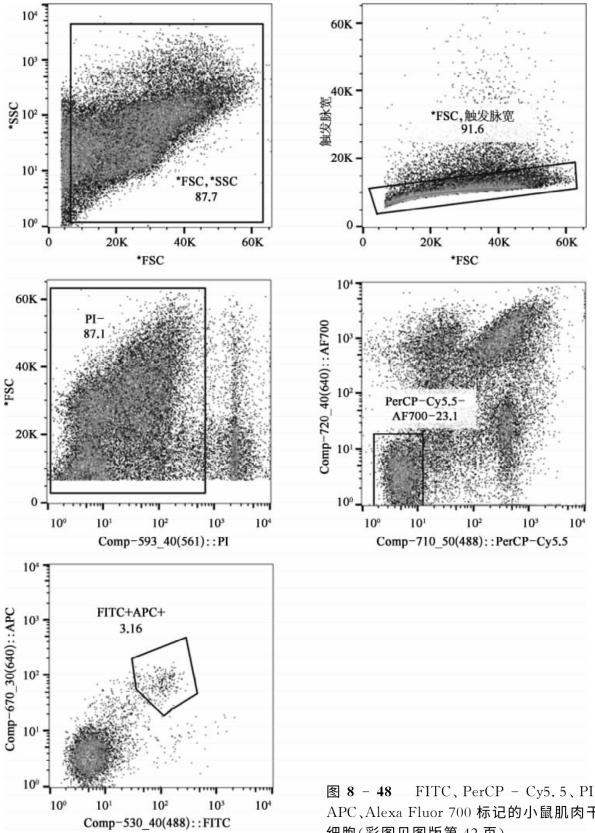
图8-48 FITC、PerCP-Cy5.5、PI、APC、Alexa Fluor 700标记的小鼠肌肉干细胞(彩图见图版第42页)
如图8-48所示,在FSC-SSC散点图上选中主细胞群后去掉黏连的细胞,在单细胞中圈出PI阴性的活细胞,进而圈出PerCP-Cy5.5和Alexa Fluor 700双阴性的细胞,最后圈出FITC和APC双阳性的目标细胞群。从图中可以看出,肌肉干细胞的分群状况明显,还可以看到各个细胞群所占的比例,且分选效率达到80%以上。
(5)小鼠睾丸单倍体细胞的分选
如图8-49所示,首先使用PE标记,通过设P3门,找到活的小鼠睾丸DNA倍性细胞。在P3门下通过355 nm激光器激发,可以将细胞分为单倍体、二倍体、四倍体的细胞,分别是P4、P7、P8门中的细胞群。从上述测试结果可以看出,BD Influx可以检测和分选出Hoechst标记的单倍体、二倍体和四倍体细胞。
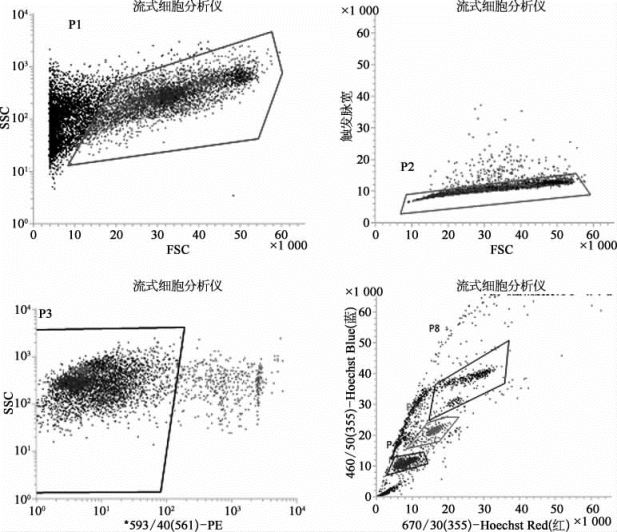
图8-49 PI和Hoechst标记的小鼠睾丸DNA倍性细胞(彩图见图版第43页)
经荧光激发分选仪(BD Influx)检测碘化丙啶(PI,检测通道为PE通道)相对荧光强度为阴性的活细胞。利用355 nm激光器检测Hoechst荧光强度成线性分布的DNA倍性细胞群,再进行下一步的分选。(图片引自[16])
测试的结论是:荧光激发细胞分选仪(BD Influx),可以进行多路和多孔板分选,平均每个样品大约1.5 h,每天约可以做5个样品。进行96孔板分选时,除去分析所用的时间,平均每个板仅需0.5 h。用标准荧光微球校准时,除去长通的荧光通道,RCV值都能够小于8%,分选纯度能保证大于90%。对单倍体细胞、乳腺干细胞、肌肉干细胞的单细胞悬液进行分选,也得到比较好的分析和分选结果,说明荧光激发细胞分选仪(BD Influx)符合设备工艺之各项验收指标。
4.流式细胞分析仪BD Calibur和BD LSR Fortessa
以标准尺度的荧光微球样品测试荧光检测灵敏度;以PI染色的小鸡红细胞核(chicken erythrocyte nucleus,CEN)样本测试仪器荧光分辨率;对细胞样本进行免疫染色后,通过流式检测,对2台流式分析仪检测的数据进行分析对比。
①荧光检测灵敏度:以标准尺度的荧光微球样品,经荧光检测,灵敏度可以达到:FITC通道≤80MESF[8];PE通道≤30MESF;APC通道≤70MESF;PE-Cy5通道≤10MESF。
②分析速度:BD Calibur的最大分析速度≥10 000细胞/s,最大流速≥60 L/min;BD LSR Fortessa的最大分析速度≥40 000细胞/s,最大流速≥60 L/min。
③荧光分辨率:PI染色的CEN样本,G0/G1期全峰宽PI-Area CV实测为1.63,<3.0%(488 nm激光),如图8-50。
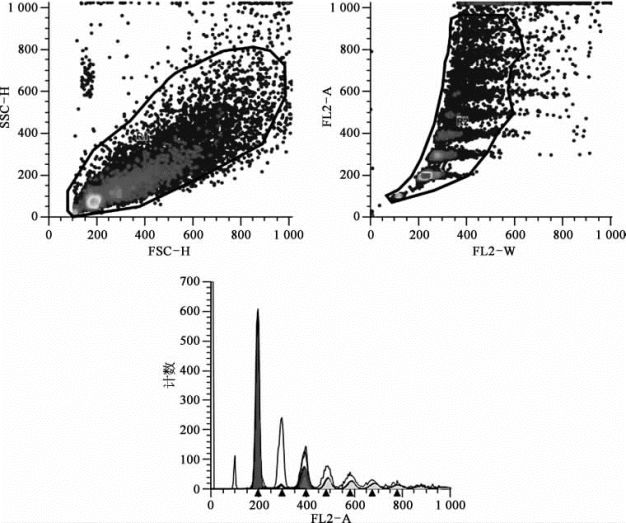
图8-50 利用流式分析仪检测碘化丙啶(PI)染色小鸡红细胞(CEN)样本(彩图见图版第44页)检测其DNA含量,并进行有丝分裂周期拟合,计算各周期比例。
④信号处理系统:经实验,BD LSR Fortessa可以在硬件上的任意荧光间补偿,也可以进行软件脱机补偿,可以完全实现网络补偿。
⑤功能实验:观察三色免疫标记FITC/APC/Per CP。通过流式细胞分析仪BD Calibur与BD LSR Fortessa的测试结果进行比较,2台设备的分析图形和由分析结果得到的统计数值均一致,如图8-51和图8-52。
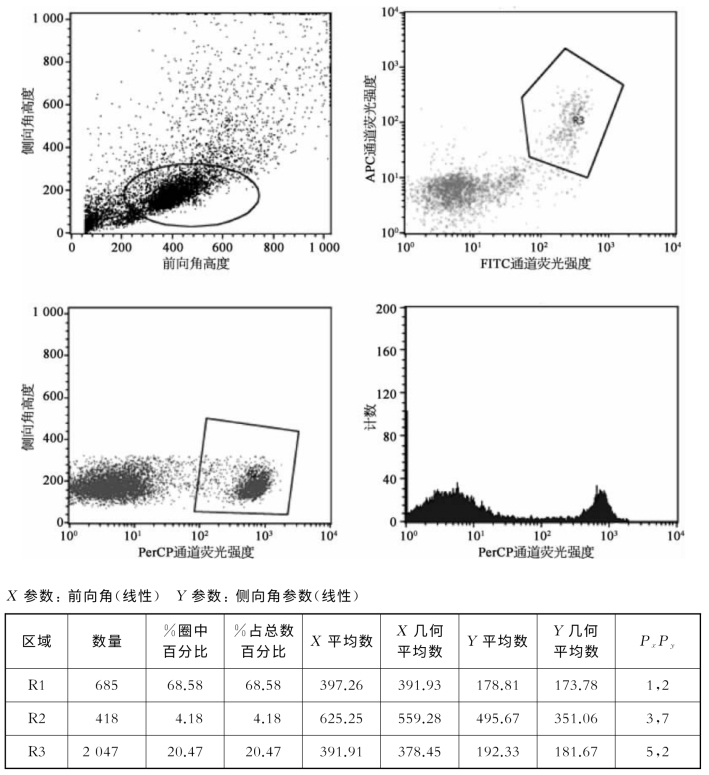
图8-51 流式细胞分析仪BD Calibur测试三色免疫标记FITC/APC/PerCP样品(彩图见图版第45页)
FITC、APC和PerCP5.5相对荧光强度均呈阳性的细胞,占总细胞的比例为4.18%。
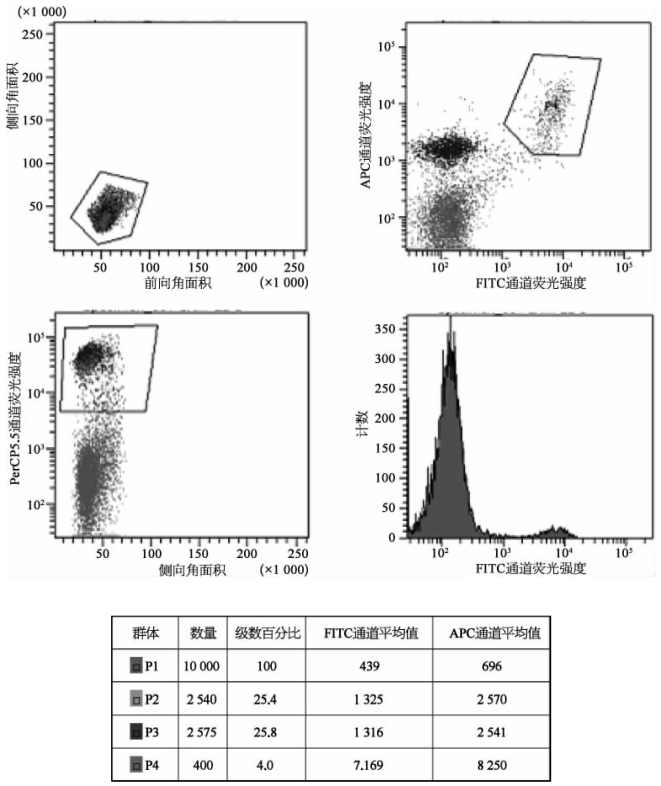
图8-52 BD流式细胞分析仪BD LSR Fortessa(彩图见图版第46页)
测试三色免疫标记FITC/APC/PerCP样品FITC、APC和PerCP5.5相对荧光强度均呈阳性的细胞,占总细胞的比例为4.0%。
⑥用单细胞悬液进行蛋白质表达的定量检测和分析、细胞周期分析等实验。连续测试20个样品,平均每个样品约4.2 min,每天可检测100个样品。
测试的结论是:流式细胞分析仪BD Calibur和BD LSR Fortessa多色微球试剂盒的检测结果均能通过;仪器的线性度和分辨率良好。经实验统计,平均每个样品约4.2 min,可达到单台流式细胞分析仪每天检测100个样品。各项基本指标均满足要求,达到预期系统模块的相关设备工艺之验收指标要求。
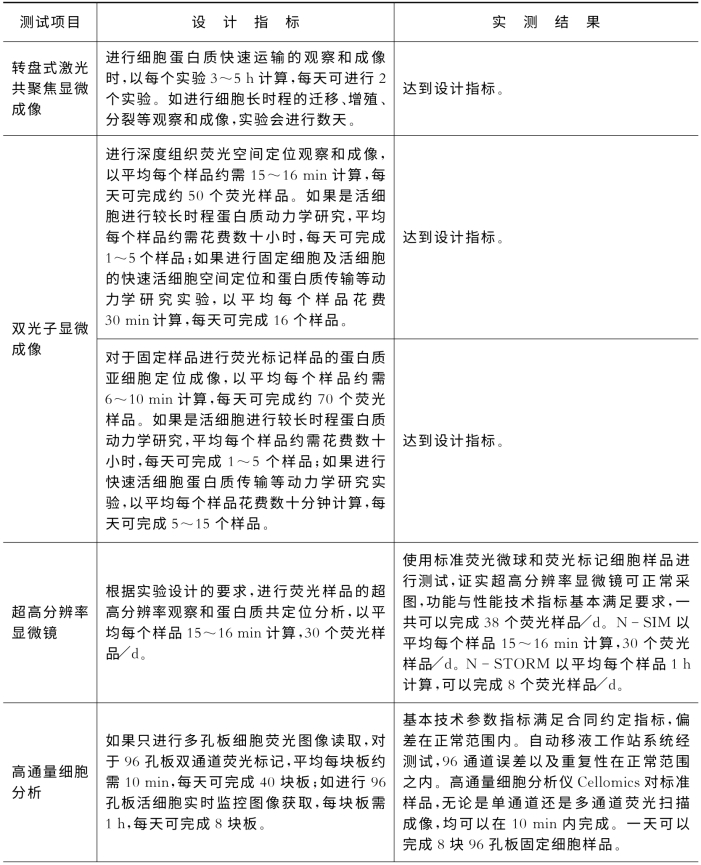
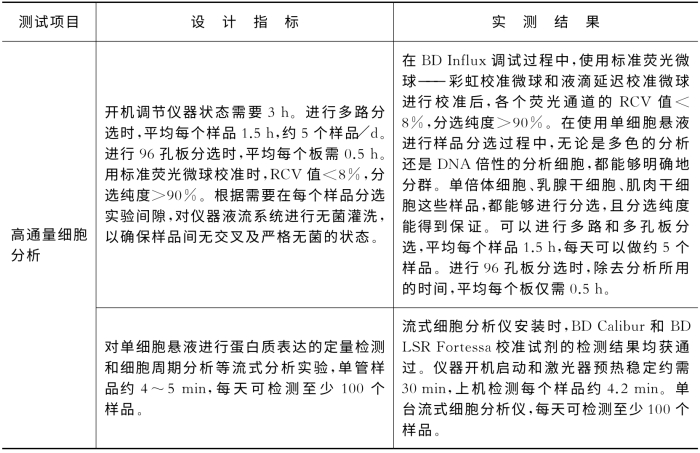
8.4.2 设备验收
测试结论如表8-4。
表8-4 各功能项目根据设计指标进行测试所得的实测结果
(续表)
测试专家的意见如下:对于复合激光显微镜系统各项指标的测试结果表明,系统各项指标均满足要求,达到工艺验收指标的要求。测试专家为邵志峰、郑平、易静。
8.4.3 档案验收
在一个设施平台系统的建设过程中,档案的管理自始至终都是非常重要的。它不仅可以完整地体现整个系统建设的过程,还可以在设备出现问题时寻根溯源,做到有据可查,有法可依,同时也可以防止人员变动所带来的信息交接疏漏。档案管理尽管过程烦琐,涉及的人员较多,但仍是不可或缺的重要一环。
8.4.3.1 建设过程档案
主要包含系统自规划建设之初的设计思路、规划方案、会议纪要、调研记录、论证报告及商务沟通和商务谈判记录。复合激光显微镜系统顺利建设完成,并对外开放良好,这离不开先行者们前期反复推敲与论证,为后续的建设指明方向。
8.4.3.2 随机资料档案
随机资料档案是指设备自入场开始,所有的设备及其包装上随带的资料,如配置单、设备使用说明书、光盘、配件、彩页等项资料。大部分用户使用的往往是比较主要的功能;但有些功能不是经常用到,就算技术人员也要从这些档案资料中查找、参考、设置,才能够使得设备百分之百地发挥其功能。同时,对于新进的技术人员来说,这些档案资料是非常好的学习和积累知识的源泉。
8.4.3.3 运行记录档案
建议为每1台大型设备(金额超过50万元人民币),设立1本单独的档案本、1本实际运行的记录本和1个文件夹。
(1)档案本:记录从设备到货之后的所有大事,以及其中发现的问题和拟定的解决方案,如设备入场时箱体倾斜的标志变红,记录当时的情况和解决方法,让所有参与人员签字。再如正常运行以后,若光纤损坏,要相应地启动在质保期内或者非质保期内的解决方案,它们各有时间周期。设备运行几年后,需要作出适当的维修升级。如果添加某个功能模块即可解决特定的问题,则记录何时升级、升级后的结果如何等。
(2)实际运行记录本:包含但不限于档案本的内容,记录此设备上发生的所有行为,主要有用户的使用登记及工作人员的维护记录。它们是监督用户按照规章制度和预约规则使用设备的保证。如遇设备出现问题,则可以按图索骥,锁定责任人。它们也是提醒工作人员周期性维护设备与培训用户的重要设置。用户往往会不屑于详细填写,这时就需要系统的工作人员告知其必要性,比如在机时紧张无法保证其使用同一台设备的情况下,查看设备使用设置的主要参数,在另外的设备上继续试验,也是很多用户在写科研报告时重要的参考资料。
(3)文件夹:包括设备主要配置单、厂家工程师出具的维修单、软件及数据备份、其他与此设备相关的零散资料。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




