上海设施的质谱系统自2014年12月对用户开放以来,陆续为全国及其他国家超过100个用户的500余个课题提供了技术服务。用户分别来自高等院校、研究院和医院等相关企事业单位。所参与用户的合作课题组已经在Science[10,11]、Nature[12]、Nature Immunology[13]、Nature Communications[14-16]、Molecular Cell[17,18]、PNAS[19]、JACS[20]等国际著名期刊上发表了近40篇文章,为多领域科学家的研究提供了有力的技术支持。
质谱系统通过对蛋白质的高分辨、高准确性的谱鉴定,可以大规模确定功能系统中起重要相互作用的蛋白质化合物;通过质谱分析来定位发生在蛋白质上的修饰位点,进一步指导蛋白质结构的测定和功能分析。此外,通过对重要功能蛋白质的精确定量分析,追踪在不同时间和处理条件下的蛋白质结构变化,可为解释细胞活动的分子机制,筛选疾病生物标志物和药物靶点,提供分子基础。
质谱系统自开放以来,为广大用户提供了蛋白质的全方位鉴定、修饰分析、定量分析和相互作用分析,为细胞活动的分子机制研究,疾病生物标志物的筛选和药物靶点的发现,提供技术平台。质谱系统还同时致力于新型质谱技术的开发与方法学研究。兹列举各分析方法的典型成果于下。
7.8.1 高分辨、高准确性的质谱分子量测定
7.8.1.1 蛋白质大小与纯度表征的辅助新材料开发
功能性水凝胶具有很多独特的功能,如生物相容性、可注射性、刺激响应性及自愈性等。这些特性使得此胶在生物医学领域具有非常广泛的应用前景。
研究人员利用生物化学工程方法,开发了一种新型的有机/无机复合水凝胶。此新型水凝胶是由类弹性蛋白多肽(elastin-like polypeptide,ELP)和生物玻璃(bioglass,BG)通过醛亚胺动态交联而成。研究人员通过多项实验证明,ELP/BG生物复合材料的可调节凝胶特性和机械特性,具有一定的成分与浓度依赖性。其中,修饰前后多肽的质量和纯度,都是通过基质辅助激光解吸电离飞行时间质谱(MALDI-TOFMS)来验证的(图7-36)。同时,ELP/BG水凝胶具有很好的自愈性,可以通过流变学,成功地重新连接切断的碎片。不仅如此,研究人员也验证了复合材料的生物相容性,可支持细胞的生长和附着。在未来,原位成型的ELP/BG复合水凝胶,有望作为可注射支架来运输细胞和药物分子,以此来促进软组织的再生[21]。
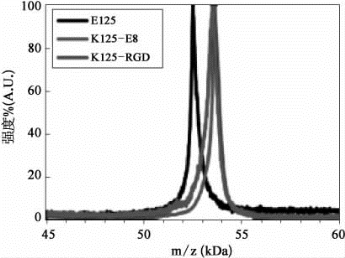
图7-36 修饰前后多肽的MALDI-TOF-MS谱图(彩图见图版第27页)
7.8.1.2 高通量筛选方法助力重要酶活功能的研究
以基因组DNA和组蛋白的共价修饰为主要标志的表观遗传调控研究,已成为生命科学前沿快速发展的热点领域。其中,组蛋白的甲基化对于基因的转录表达、细胞的增殖分化等起着至关重要的调控作用。相关甲基化酶基因的突变,会导致多种遗传病和癌症。MLL家族蛋白(MLL1/2/3/4、SET1A/B)是一类特异性地针对H3K4的甲基转移酶,其甲基转移酶活性依赖于C端的一个保守的SET结构域。
研究人员成功解析了MLL家族蛋白质中一系列蛋白质单体及蛋白质复合物的结构。其中,MLL家族蛋白质的分子量,由质谱系统的MALDI-TOF仪器在反射模式下分析得到(图7-37)。通过对比甲基化反应过程中不同阶段的MLL家族蛋白质和apo MLL蛋白质的质谱图,研究人员得出MLL家族蛋白质比apo MLL蛋白质具有更高的甲基转移酶活性。进一步,研究人员利用每个阶段质谱图中未修饰的H3肽段的相对信号强度的衰减,通过单指数衰减模型,得到总反应速率常数。该研究成果为深入了解MLL家族组蛋白甲基转移酶在复合物正确组装、活性精确调控等方面的作用,提供了坚实的结构基础[12]。
7.8.2 高精确性的生物分子定量分析
7.8.2.1 通过差异蛋白质组学解析传统的中药药理
随着传统中医药的发展,社会对中药复方的处方科学性、生产工艺的合理性、质量标准的规范化以及中成药质量稳定性等,要求日益提高。但是长期以来,由于中药复方具有成分复杂,有效成分较难确定,疗效标准不唯一等特点,中医药的国际化发展道路受到严重阻碍。
研究人员结合疏风解毒胶囊的中药药性理论,通过超高效液相色谱串联四极杆-飞行时间质谱技术(UPLC/Q-TOF-MS)整合双荧光素酶(nuclear factor-kappa B,NF-κB)报告基因系统的筛选体系,快速准确地筛选鉴定了疏风解毒胶囊中96种主要的化合物成分,以及潜在的10种抗炎活性物质,首次明确疏风解毒胶囊药效的物质基础。进而,通过Pharm Mapper数据库[20],对抗炎物质进行反向分子对接,预测出疏风解毒胶囊潜在的作用分子靶点。同时,通过构建多种脂多糖(lipopolysaccharides,LPS)诱导的大鼠肺损伤的组织模型以及和炎症相关的巨噬细胞模型,结合多维蛋白质鉴定技术(MudPIT)和定量蛋白质组学技术(label-free quantification),得到疏风解毒胶囊治疗大鼠肺损伤模型后的差异蛋白质表达数据(图7-38)。最后,通过对差异蛋白质的生物信息学分析,明确了丝氨酸/苏氨酸蛋白激酶B(AKT1)在疏风解毒胶囊治疗大鼠急性肺损伤(acute lung injury,ALI)中的核心调控作用。进一步的生物学实验证明,有多条与免疫和炎症相关的信号通路,参与了这一调控过程。该研究针对疏风解毒胶囊的药理和药效分析流程,为中药复方分析领域提供了全新的理念与标准[22]。
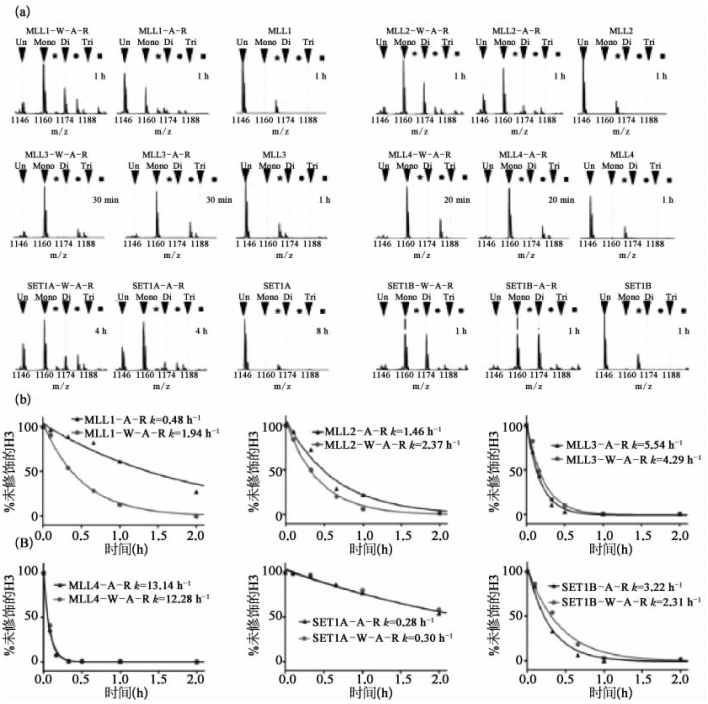
图7-37 MLL家族组蛋白甲基转移酶的活性分析(彩图见图版第28页)
(a)不同时间点下,MLL蛋白复合物和MLL蛋白自身参与的甲基化反应的质谱图。(b)在WDR5-ASH2LRBBP5或ASH2L-RBBP5存在时,不同MLL蛋白催化下,甲基化反应的速率。未修饰的:unmodified。
7.8.2.2 通过小分子定量技术诠释蛋白质的催化功能
DNA双加氧酶Tet3是Tet蛋白家族的一个重要成员。有研究发现,Tet 3全身性敲除的小鼠,有部分可以发育到出生,但在出生后24 h内死亡。因此,若想研究Tet3在成年小鼠中的功能,须借助Cre/lox P系统[21]在不同的组织中进行特异性敲除。这就带来了一系列的问题:待研究的组织中是否存在特异性的Cre小鼠资源?若想在不同的组织中研究基因的功能,则需要不同的Cre小鼠,而条件性敲除的小鼠,交配周期长。
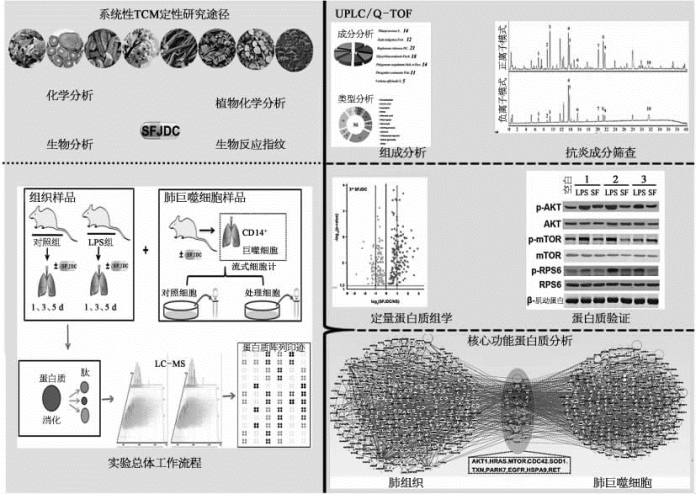
图7-38 疏风解毒胶囊治疗大鼠急性肺损伤的分子机理研究(详见下载图7-38,下载网址见31页脚注)
基于此,研究人员利用CRISPR/Cas9技术[23]和细胞谱系示踪技术,对小鼠2个细胞胚胎中的单个卵裂球,进行了基因敲除。一步法获得了Tet 3基因敲除的健康嵌合小鼠,并对Tet 3基因敲除后大脑皮层和海马神经元的突触传递进行了探究。在研究过程中,为检验Tet3蛋白在突变细胞中的功能变化,研究人员通过质谱定量分析,发现了嵌合突变小鼠体内5-羟甲基胞嘧啶的含量显著降低,验证了突变细胞中Tet3蛋白的功能衰退[24]。
7.8.3 蛋白质互作网络的鉴定能力
7.8.3.1 受体研究
人体每天有大量细胞死亡。对死亡细胞的识别和清理,是维持机体稳态和避免自身免疫等疾病所不可或缺的。该过程通常是由树突状细胞、巨噬细胞等吞噬细胞参与完成的。吞噬细胞对死亡细胞的识别,需要利用其表面受体分子来实现。DEC205(CD205)是作为树突状细胞的主要标志物和胞吞受体之一,被广泛用于免疫疗法中。
研究人员通过一系列生物化学和生物物理学实验,寻找人源DEC205在细胞上的配体。研究人员通过质谱技术(图7-39),分析了用生物素化DEC205与凋亡的HEK293细胞孵育后的分离产物,以及DEC205-Fc与Jurkat细胞裂解液的免疫共沉淀样品。结果发现,角蛋白(keratin)是DEC205的内源性配体。进一步的实验表明,人源DEC205分子,可以在酸性条件下通过其N端结构域,特异性地识别角蛋白的C端结构域。这项工作表明,角蛋白作为细胞骨架的重要组成部分,不仅在维持细胞和组织的结构上起重要作用,也可作为细胞死亡的标志物被免疫系统识别,并介导一条依赖酸碱性的死亡细胞识别和清理的通路。另外,角蛋白和肿瘤之间也存在着密切联系,并被用于多种肿瘤的临床诊断。因此,DEC205作为角蛋白受体的这一发现,也为肿瘤及相关疾病的诊疗提供了新的思路[25]。
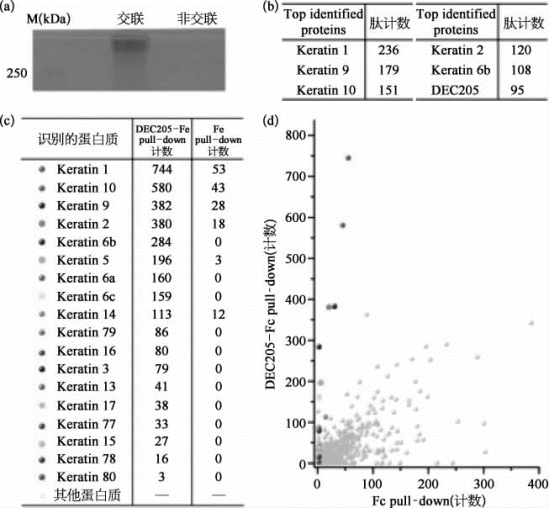
图7-39 角蛋白(keratin)是DEC205的内源性配体实验[22]
Top identified proteins:得到鉴定次数最多的蛋白质。
7.8.3.2 环状RNA编码新肽段
环状RNA在某些病毒中普遍存在。然而,近年才在真核生物中发现这种非主流RNA大量存在,其生物功能尚无定论。人细胞中所有的已知m RNA,都含有5′端帽结构。这一帽结构是大部分m RNA翻译所必需的。然而,在一些特殊情况如细胞应激的条件下,有些m RNA可以不依赖于帽结构而靠一个叫IRES[23]的顺式调控元件,从mRNA的中间启动翻译。这种IRES驱动的蛋白质翻译,在RNA病毒中很常见,但只在一小部分的真核细胞m RNA中发现。
在王泽峰组的前期工作中,发现插有IRES的编码绿色荧光蛋白(green fluorescent protein,GFP)的环状RNA,可以在细胞中被翻译。而在他们新的工作中,研究人员发现了大量的环状RNA可作为m RNA来编码蛋白质。这些环状m RNA通过一种常见的RNA甲基化修饰m6A,来驱动非帽依赖性的翻译机制,来合成蛋白质。为进一步鉴定环状RNA编码的内源性蛋白质,研究人员构建了一个特定的数据库,该数据库中包含了横跨全部环状RNA剪接位点的序列所编码的肽段。同时,结合此肽段数据库和UniProt中全部人源蛋白质信息,检索了HEK293细胞全部裂解物的串联质谱数据(图7-40)。研究人员鉴定到了33条环状RNA剪接位点的序列所编码的肽段,并且它们都不来自任何人源蛋白质。该研究进一步拓展了环状RNA的功能,给蛋白质来源的多样性带来了新认识,具有重要的理论意义[26]。
7.8.3.3 生物标志物的筛选
随着医学的不断发展,人们渐渐认识到,哮喘能以不同的形式出现。哮喘的典型症状为,发作性伴有哮鸣音的呼气性呼吸困难。但是临床上,也存在没有喘息症状的不典型哮喘,其中以咳嗽为唯一症状的不典型哮喘称为咳嗽变异性哮喘(cough variant asthma,CVA),另一种以胸闷为唯一症状的不典型哮喘称为胸闷变异性哮喘(chest tightness variant asthma,CTVA)。进而,研究人员推测,这些不同形式的哮喘病例,可能具有其独特的细胞和分子特征。
为了验证这项推测,研究人员邀请了30名典型哮喘(classic asthma,CA)患者、27名CVA患者、30名CTVA患者、30名健康对照成人来参与这项研究,并测定了每一病人的多项指标,其中包括血清中的Ig E含量、肺功能、痰液中的嗜酸性粒细胞数量、呼出气体中的一氧化氮(NO)含量等。同时,研究人员进一步用质谱法对诱导痰液的上清液进行了蛋白质组学分析。通过对比各项试验结果发现,CA、CVA和CTVA患者血清中的IgE含量、痰液中的嗜酸性粒细胞数量、焦虑和抑郁评分,均明显升高,都具有嗜酸性气道炎症的普遍临床特征,而3类患者的样本之间并无差异。这些发现证实了,这3种不同的哮喘表现,具有相同的发病机理,都与嗜酸性粒细胞增多症所伴随的T辅助2型细胞(helper T lymphocyte 2,Th2)增强有关。质谱分析显示(图7-41),CA、CVA、CTVA等患者的诱导痰液上清液样本中,含有超过1 000种蛋白质,其中有23种分泌蛋白质明显高于健康患者的对照组样本。根据此结果,研究人员确定了一组新的生物标志物,用于诊断哮喘,并且标记其亚型[27]。
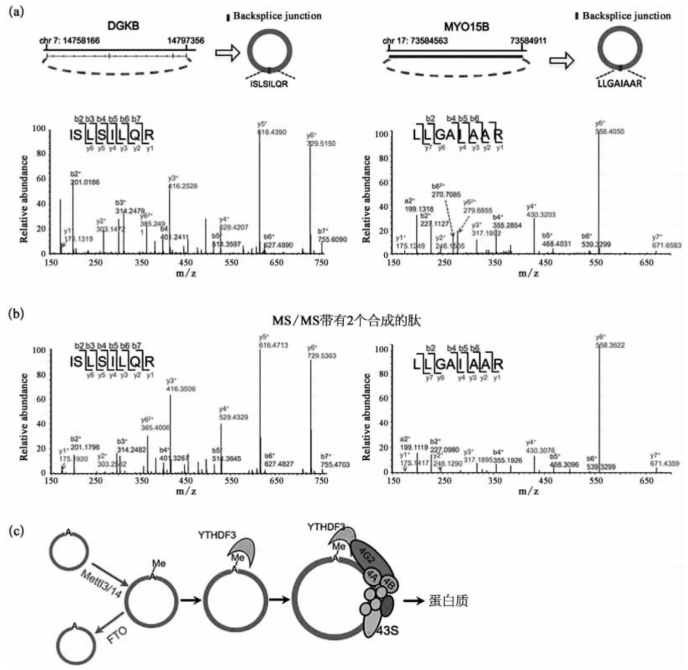
图7-40 环形RNA编码的内源性蛋白质鉴定(详见下载图7-40,下载网址见31页脚注)
(a)2个人源蛋白质cDGKB和c MYO15B的天然肽段的碰撞诱导解离质谱图;(b)2个人源蛋白质cDGKB和c MYO15B的人工合成肽段的碰撞诱导解离质谱图;(c)m6A驱动下的环形RNA翻译过程原理图。Relative abundance:相对丰度;Backsplice junction:反向剪接点。
7.8.4 蛋白质后修饰的解析能力
7.8.4.1 抗病毒研究
有相关的研究报道,维甲酸诱导基因Ⅰ-线粒体抗病毒信号蛋白(RIG -Ⅰ-MAVS)介导的抗病毒免疫反应,在宿主对抗病原体入侵的过程中发挥重要作用,但其作用机理并未完全得到解释。
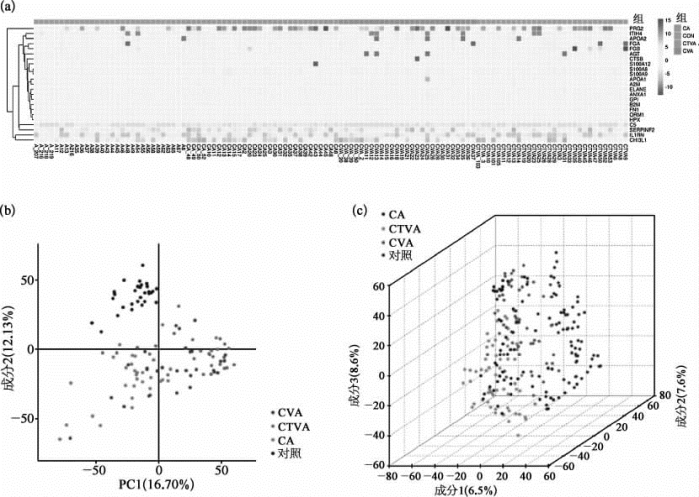
图7-41 三类哮喘患者和健康对照组痰液的蛋白质组学分析(详见下载图7-41,下载网址见31页脚注)
首先,研究人员以维甲酸诱导基因Ⅰ(retinoic acid-induced geneⅠ,RIG-Ⅰ)为诱饵,利用质谱技术研究RIG -Ⅰ的相互作用对象。他们发现,含缬酪肽蛋白p97和RIG-Ⅰ有一定的相互作用关系。紧接着,研究人员发现,p97复合物类似于一个“分子桥梁”,能够同时直接结合RIG-Ⅰ及其E3泛素化连接酶RNF125,从而促进RIG-Ⅰ发生泛素化修饰。进一步,利用质谱分析确定了RIG-Ⅰ的第181位赖氨酸为其泛素化位点(图7 42)。后续的研究发现,病毒侵染引起的RIG-Ⅰ分子构象变化,使得其胱冬肽酶募集结构域(caspase activation and recruitment domain,CARD)暴露出来,并发生泛素化,进而大大增强RIG-Ⅰ与p97复合物之间的相互作用,RIG-Ⅰ的活性会得到实时抑制。进一步的动物实验表明,利用靶向p97的小分子化合物抑制其ATP酶活性,能够促进RIG-Ⅰ-MAVS信号通路的激活,增强小鼠的抗病毒免疫反应。这些发现均提示,p97复合物是抗病毒治疗的一个新的潜在药物靶点。考虑到之前已有研究表明,p97可以作为一个抗肿瘤药物靶标,并已研发了特异性抑制剂,而且肿瘤患者在临床上往往同时需要结合抗病毒治疗,因此针对p97复合物的药物,有可能具有多重功能,开发前景值得期待[28]。
7.8.4.2 细胞自噬研究
自噬是广泛存在于真核细胞内的一种溶酶体依赖性降解途径,目的是实现细胞稳态和细胞器的更新。在生理条件下,细胞的基础自噬活性能够清除细胞内老化、受损的生物大分子和细胞器等,以维持正常的细胞生物学功能。在饥饿、能量缺乏等代谢应激状态下,细胞通过自噬,降解老化及受损的生物大分子和细胞器等,可获得能量来源和重建的物质,以维持细胞的基本生命活动。

图742 RIG-Ⅰ的泛素化位点分析(详见下载图7-42,下载网址见31页脚注)(https://www.xing528.com)
(a)对共转染后RIG-Ⅰ泛素化位点的质谱分析;(b)对野生型和突变型RIG-Ⅰ的免疫印迹分析;(c)对野生型和突变型RIG-Ⅰ的泛素化分析。
去乙酰化酶1(Sirt1)是一种依赖于NAD+的组蛋白去乙酰化酶,参与了许多重要生理功能的调节。尽管研究证实,Sirt1激活是真核生物启动自噬,以应对外部营养物质缺乏的必要条件,但其潜在机制仍不是很清楚。
研究人员通过实验证实,糖酵解酶——甘油醛-3-磷酸脱氢酶(GAPDH),是AMP依赖的蛋白激酶[adenosine 5′-monophosphate(AMP)-activated protein kinase,AMPK]驱动Sirt1激活的一个关键介质。在葡萄糖饥饿的情况下,激活的AMPK使得胞质GAPDH磷酸化,并重新分配到细胞核中。利用质谱分析技术鉴定了GAPDH的磷酸化位点为Ser122(图7-43)。在细胞核内,GAPDH与Sirt1直接互作,取代了Sirt1的抑制蛋白质,使得Sirt1被激活。阻止GAPDH的这种转换,可以破坏Sirt1的激活和自噬;而通过过表达细胞核定位的GAPDH来促进这种转换,则可以推动Sirt1的激活和自噬。因此,研究结果表明,GAPDH是在葡萄糖缺乏条件下一个关键及中心的自噬调控因子,它经历AMPK依赖性的磷酸化及核转位,激活了Sirt1的去乙酰化酶活性[17]。
7.8.4.3 RNA调控机制的研究
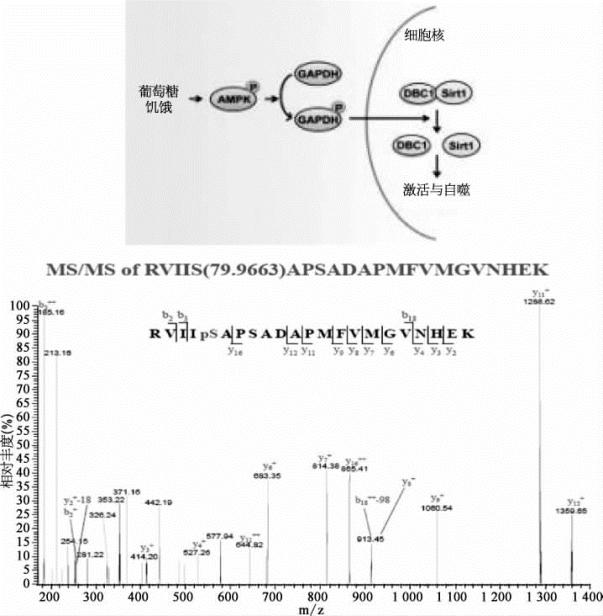
图7-43 GAPDH-Ser122磷酸化位点的质谱分析(详见下载图7-43,下载网址见31页脚注)
哺乳动物的细胞核,是细胞内最复杂的细胞器。它不仅含有遗传物质的染色体,也包含具有不同组分和功能的细胞核亚结构。paraspeckle(核旁斑点)是在2002年被发现和命名的细胞核亚结构,由长非编码RNA的NEAT1和DBHS家族蛋白质PSP1a、p54nrb和PSF等共同组成。NEAT1作为paraspeckle的骨架分子,决定了该细胞核亚结构小体的形成。在之前的研究中发现,paraspeckle的重要功能之一是通过核心蛋白质p54nrb,参与调控3′UTR区域中含有IRAlus的m RNA的核滞留。当细胞受到刺激时,这些核滞留的m RNA会被运出细胞核并得到翻译。但是,对于这一过程是如何调控的,仍然未知。
研究人员通过充分的实验,阐明了蛋白质精氨酸甲基转移酶CARM1通过甲基化细胞核亚结构paraspeckle小体的核心蛋白质组分p54nrb,并同时抑制paraspeckle骨架长非编码RNA NEAT1的转录,协同调控滞留在paraspeckle中含反向重复Alu序列(IRAlus)的m RNA在不同生理条件下的出核活动。不仅如此,在研究过程中,研究人员还利用质谱技术鉴定了p54nrb上的多个甲基化位点(图7-44)。
该研究阐明了细胞核亚结构paraspeckle小体调控m RNA出核之谜,丰富了人们对paraspeckle功能、蛋白质翻译后修饰调控蛋白质-RNA复合物、长非编码RNA的转录以及基因表达调控的认识[29]。
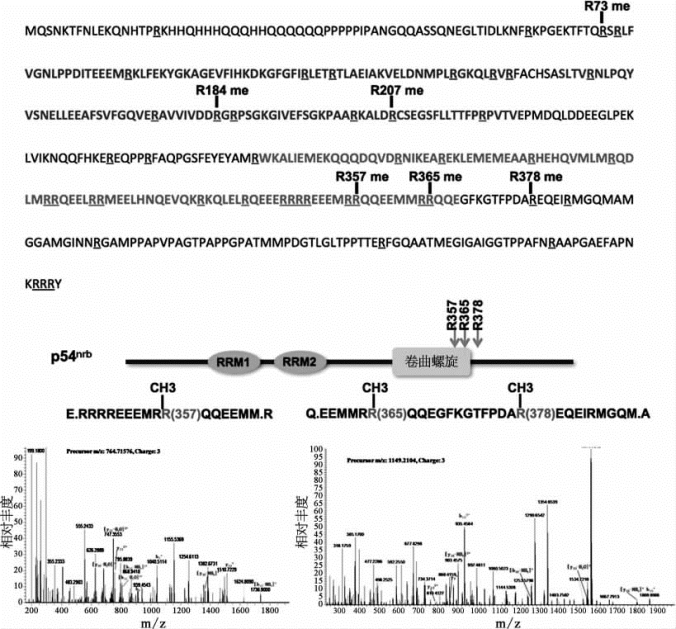
图7-44 p54nrb甲基化位点的鉴定(详见下载图7-44,下载网址见31页脚注)
7.8.4.4 新型蛋白质翻译后修饰类型
自1996年以来,hedgehog(Hh)蛋白一直被认为是唯一的胆固醇修饰蛋白。20多年来,虽然关于新的胆固醇修饰蛋白的猜想一直都有,很多实验室也不断尝试,但是从来没有新的胆固醇修饰蛋白被报道。相对于经典的翻译后修饰,胆固醇修饰作为一种特殊的修饰,一直没有很好的鉴定方法。
研究人员设计并合成了新的胆固醇分子探针。通过质谱实验(图7-45),可以清晰地发现蛋白质smoothened(SMO)的Asp95(D95)残基上有一个368.344 3的质量数位移,刚好符合一个胆固醇的分子量(386.354 8)减去一个H 2 O的分子量(18.010 5),表明SMO通过Asp95(D95)残基上的羧基和胆固醇上的羟基形成脂键,实现胆固醇的共价修饰。这是时隔20年后,继第一个被胆固醇修饰的蛋白质Hh被发现以后,又一个被共价修饰的蛋白质,颠覆了长久以来认为Hh是唯一被胆固醇修饰的蛋白质的认识。同时还发现,胆固醇除了导致心脑血管病外,它在发育过程中也起重要作用。SMO的胆固醇化,对于Hh信号传导和胚胎发育至关重要。胆固醇修饰对SMO的活化有重要意义,提示SMO的胆固醇修饰,可以作为治疗Hh相关癌症的一个新靶点[18]。
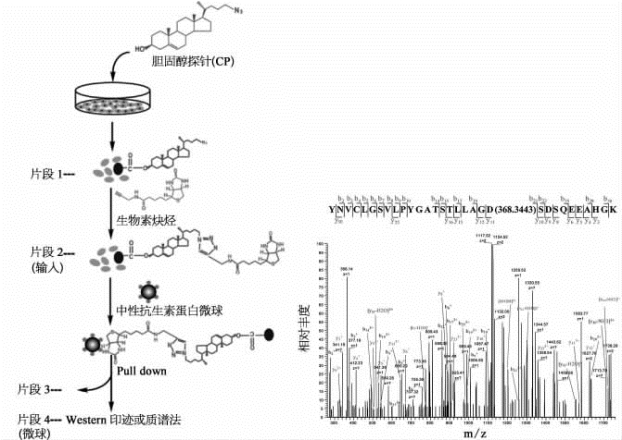
图7-45 SMO的胆固醇修饰分析(详见下载图7-45,下载网址见31页脚注)
片段:fraction;胆固醇探针:cholesterol probe(CP)。
7.8.5 完整蛋白质及蛋白质复台物的精确分析
7.8.5.1 结构生物学
剪接体作为真核细胞中催化前体m RNA剪接过程的执行者,是真核生物最基本的分子机器之一,对于正常生命活动起着至关重要的作用。基因的错误剪接或剪接体的错误调控,与许多疾病相关。剪接体成分复杂多变,构象高度动态,所以对于剪接体组装及催化过程中各复合物的结构生物学研究,是最基础也最富挑战性的生物学难题之一。
质谱分析系统用户清华大学施一公课题组在Science上报道了酿酒酵母剪接体组装过程中的一个关键复合物U4/U6.U5 Tri-sn RNP的冷冻电镜结构,并在此基础上分析了剪接体的组装机制。该研究过程中,研究人员利用高分辨质谱技术,对剪接体复合物的成分进行了准确鉴定(图7-46),并利用交联质谱技术,对剪接体复合物组成蛋白的分子间相互作用进行了分析。质谱数据为蛋白质复合物的结构搭建,提供了分子基础,更为酿酒酵母剪接体的结构搭建,提供了除冷冻电镜之外的最直接有效的证据[10,11]。
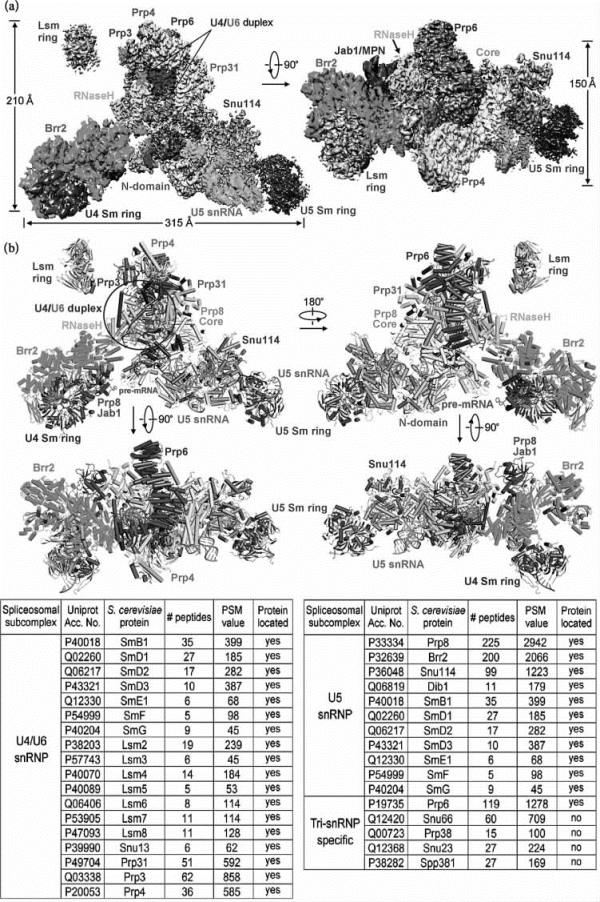
图7-46 剪接体复合物组成蛋白的鉴定及其分子间相互作用的分析(彩图见图版第29页)
ring:环;duplex:二聚体;RNAse:RNA酶;N-domain:N-结构域;snRNA:小核RNA;Core:核;pre-mRNA:前体mRNA;spliceosomal subcomplex:剪接体亚复合物;S.cerevisiae protein:酿酒酵母蛋白质;peptides:肽;PSM value:PSM值;Protein located:蛋白质定位;Tri-snRNP specific:TrisnRNP专一;yes:是;no:否。
7.8.5.2 药物研发(小分子-蛋白质复合物)
溴结构域蛋白4(bromodomain containing protein 4,BRD4),是一种在哺乳动物细胞中广泛表达的染色质“适配器”,可以在整个有丝分裂过程中始终结合于染色体上,募集不同的染色质修饰蛋白,广泛调控基因的表达,从而在细胞周期进程的调控、转录以及炎症等方面发挥重要作用。近年来,很多学者对BRD4进行了深入系统的研究,发现其表达水平失调或者功能紊乱,与多种肿瘤的发生和发展密切相关,有望成为治疗肿瘤的新靶点。
研究人员发现一种铱(Ⅲ)[Ir(Ⅲ)]配合物,它是第一种基于金属的、不可逆的BRD4抑制剂。通过时间分辨荧光共振电子转移实验(time-resolved fluorescence resonance energy transfer,TR-FRET),结合液相色谱串联质谱(LC-MS/MS)实验分析(图7 47),研究人员发现,这种Ir(Ⅲ)配合物在体外能够阻止BRD4与乙酰化的组蛋白之间的蛋白质-蛋白质相互作用,并且在纤维素中可以与BRD4结合,从而下调致癌基因的表达。染色质免疫共沉淀(chromatin immunoprecipitation,ChIP)分析结果表明,这种Ir(Ⅲ)配合物可以调节黑色素瘤细胞中BRD4与染色质之间的相互作用,尤其是原癌基因的启动子。最后,在小鼠体内模型中,这个配合物在对抗黑色素瘤异种移植时,显现出有效的活性。这是第一次提出第九族金属配合物可以抑制含溴结构域和额外终端域家族蛋白质中的蛋白质间相互作用。这种Ir(Ⅲ)配合物对于发现更多有效的抗肿瘤表观遗传药物起到很好的支撑作用[30]。
7.8.5.3 抗生素的生物合成
FR901464是由假单孢菌Pseudomonas sp.No.2663产生的具有高效抗肿瘤活性的天然产物。研究表明,FR901464及其类似物,可以抑制真核细胞中前体m RNA的剪接,进而抑制癌细胞的生长。其良好的生物活性和独特的作用机制,吸引了化学合成、药物化学及化学生物学等学科的广泛关注。
在Ⅰ型聚酮合酶(polyketidesynthase,PKS)催化的生物合成途径中,硫酯水解酶(thioesterase,TE)功能域通常分布于PKS的末端,在链延伸完成之后,催化聚酮链的水解或者进一步的大环化。研究人员通过实验,首次证实了在FR901464聚酮链延伸的过程中,位于PKS内部的一个TE功能域行使脱水酶(dehydratase,DH)的功能,催化了顺式双键的生成。
进一步利用LC-MS(图7-48),分析酮体合成酶(ketosynthase,KS)介导的酰基转移反应产物。结果证明,位于TE功能域下游的KS,可以选择性地将脱水之后含有顺式双键的PKS链,转移到后续的酰基载体蛋白(acyl carrier protein,ACP)上,进而进行下一步的链延伸。该结果不仅表明,PKS功能域可能具有全新的功能,同时也揭示了聚酮天然产物中顺式双键形成的一种新机制[20]。
7.8.6 新型质谱技术开发

图7-47 TR-FRET实验结合LC-MS/MS实验分析Ir(Ⅲ)配合物在体外对BRD4与乙酰化组蛋白之间的蛋白质-蛋白质相互作用的影响(详见下载图7-47,下载网址见31页脚注)
(a,b)2种BRD4的时间分辨荧光共振电子转移实验结果;BRD4(c)、BRD4加上Ir(铱)配合物(d)和仅含有Ir配合物(e)的LC-MS/MS分析结果。
糖蛋白对维持人体正常的生理功能,发挥着举足轻重的作用。但是,糖蛋白的鉴定仍是目前蛋白质组学中最困难的部分。组成糖蛋白的糖原类型多样、糖链结构复杂等原因,是阻碍糖蛋白组学研究的主要障碍。传统的糖肽鉴定的方法,分为糖原鉴定和肽段骨架鉴定两步。近年来,科学家们研发了多种质谱技术和解读完整糖肽的生物信息工具。一种方法是利用碰撞诱导解离串联质谱(collision-induced dissociation tandem mass spectrometry,CID-MS/MS)结合电子捕获解离串联质谱(electron capture dissociation tandem mass spectrometry,ETD-MS/MS)或靶向MS3技术,直接解读完整糖肽的质谱数据。另一种比较流行的质谱方法是利用HCD-子离子-ETD(HCD-pd-ETD)方法鉴定完整糖肽。然而,用这些方法鉴定到的糖肽,即使在肽段谱图匹配分数高时,仍会发生FDR高的情况。
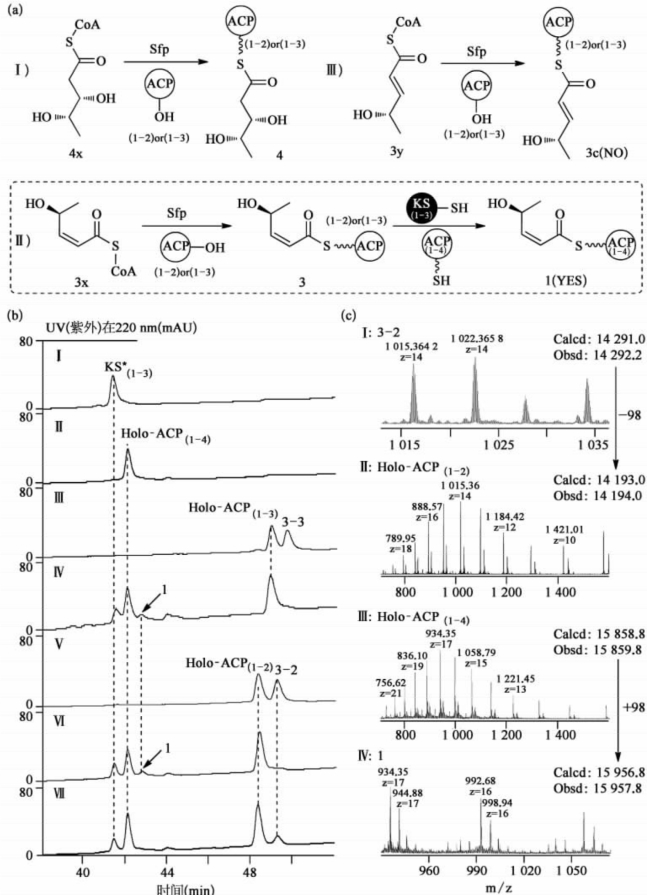
图7-48 KS催化的体外聚酮链转移反应过程(a)及过程中各成分的液相色谱(b)和质谱(c)分析
研究人员合作研发了一款解析完整N-糖肽质谱数据的软件——p Glyco(图7-49)。该软件利用了质谱采集数据的高能碰撞解离(high collision dissociation,HCD)和碰撞诱导解离(collision-induced dissociation,CID)碎片信息,实现了糖肽的鉴定解析。该软件能够解决糖蛋白组学研究中最困难的问题——糖肽骨架鉴定和高FDR。
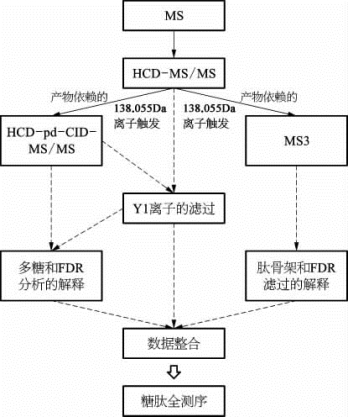
图7-49 pGlyco的工作流程
首先样品用HCD-MS/MS的方法分析,然后分别进行子离子依赖的CID-MS/MS与数据依赖的MS3的数据采集。pGlyco整合3种互补的质谱数据所包含的独特信息。这些信息基于肽段骨架的质量数和保留时间。实线表示数据采集,虚线表示数据解读。
p Glyco具有如下一些特点:①利用来自HCD-MS/MS和CID-MS/MS的2种互补的碎片信息,来鉴定糖原;②引入一个全新目标-诱饵库(target-decoy)方法,来计算糖原的假阳性率(false discovery rate,FDR);③将HCD-MS/MS产生的响应最高的质谱峰,在数据依赖的采集模式下进行MS3信息采集,从而对糖肽进行鉴定。pGlyco通过整合上述3个特点,就能够用详细的质谱图谱信息,同时鉴定糖肽和肽段[31]。
接下来,研究人员广泛测试了目前最新的质谱仪器所支持的各种碎裂方式,并进行了系统性的分析与模拟,最后挑选了经过优化的阶梯能量HCD,作为糖肽的质谱图采集方法。这种方法能够获得丰富的完整糖肽碎片信息,同时保证数据采集的效率。随后,研究人员开发了具有自主知识产权的完整糖肽检索引擎p Glyco 2.0。p Glyco 2.0能够充分利用阶梯能量HCD糖肽谱图中的碎片信息,并且在糖链、肽段和糖肽3个层面都进行质控,从而获得高质量的鉴定结果(图7-50)。通过测试,p Glyco2.0的假阳性率<1%。而目前最常见的商用软件Byonic,其假阳性率在特定情况下高达20%。该质控流程为完整糖肽分析领域提供了全新的工具和标准,可以作为后续方法发展的评价指标之一。最终,研究人员使用p Glyco2.0的整套流程,在小鼠5个脏器(心、肝、脑、肺、肾)中鉴定了超过10 000条非冗余糖肽,是目前最大的完整糖肽数据集[16]。
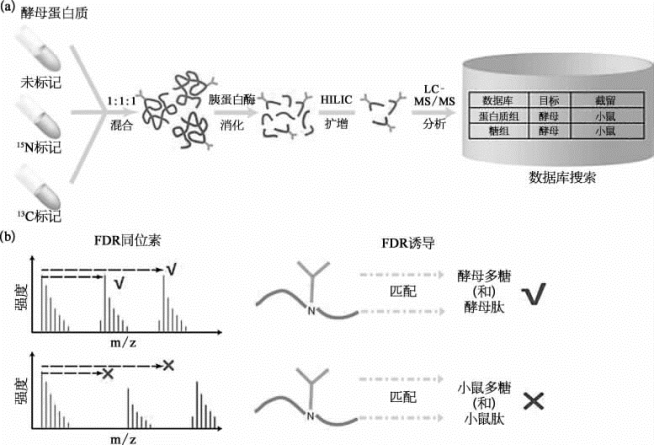
图7-50 基于重标技术的糖肽质控新方法(彩图见图版第30页)
胰蛋白酶:tripsin;截留:entrapment。
总之,经过2年的运行,本系统用户在各个方向上都取得了较好的成果。随着本系统技术方法的进一步提升与扩展,有理由相信,将会有更多的优秀成果涌现出来。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




