质谱仪属于高精密性设备。为保证设备在安装以后能够正常运行,并产生高质量的数据,必须从设备到货之时起就做好充分的准备。根据现场建设安装的情况、本系统的技术人员配备情况、每台设备的工程师情况、每台仪器的特性和对电路、气路、温度、湿度的不同需求,以及运输等因素,合理安排各台仪器的到货、安装及调试时间,并整体编排时间表,提前通知相关部门的人员,做好每个环节的准备工作。
7.6.1 设备到货
(1)要求的现场人员:供货方(仪器安装的现场工程师或相关技术人员)、外贸公司、工程管理办公室相关人员、本系统负责人员、运输方。本系统负责人员须做好前期联络工作。
(2)到货:尽量考虑天气因素,避开大雨天气。事先多方沟通,明确送货人、到货地点、具体时间。
(3)卸货:参与人员明确卸货平台的位置、卸货后仪器存放的位置,保证仪器和人身的安全。必要时本系统负责人员协助联络,准备小型液压车或者推车等运输工具。
(4)验收:检查外包装情况,拍照,填写到货验收报告(图7-23)。
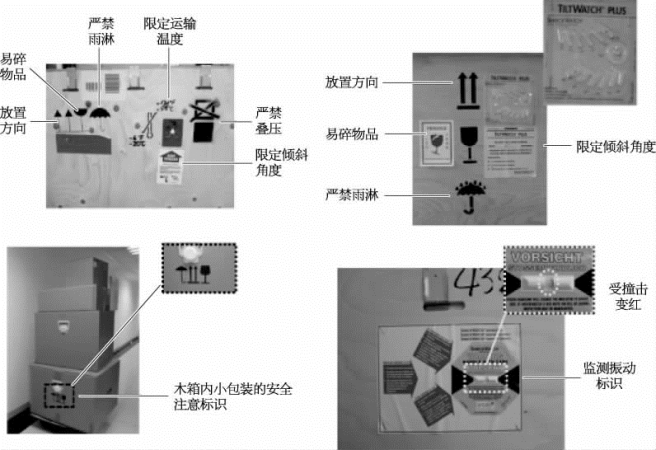
图7-23 外包装安全标识举例
7.6.2 设备安装
这个环节要求的现场人员有:供货方现场工程师、本系统负责人员、建筑安装辅助人员。本系统负责人员做好设备安装的前期准备及配合工作。
7.6.2.1 安装条件
设备安装前,保障建筑安装工作具备仪器进场条件。根据本系统仪器的安置布局图,落实每台设备安装的具体保障条件(见表7-12)。并请各家仪器公司相应的工程师,实地测试电路、气路是否符合要求,提前解决相关的问题。
(1)水:在本系统的仪器安装过程中需要提供超纯水。
(2)电:检查供电状态,包括容量、电压、电流、稳定情况等。
①采用380 V三相交流电,并注意电压是否与仪器安装的要求相符。零地电压须小于1 V;如果实测达不到要求,则各个房间要各配置1台隔离变压器。
②不间断电源(uninterruptible power system,UPS)容量、安装状态、运行情况:B2-01室配备60 kVA的UPS,B2-02室配备30 kVA的UPS,B2-03室配备80 kVA的UPS。
表7-12 具体每台仪器的用电和气体需求
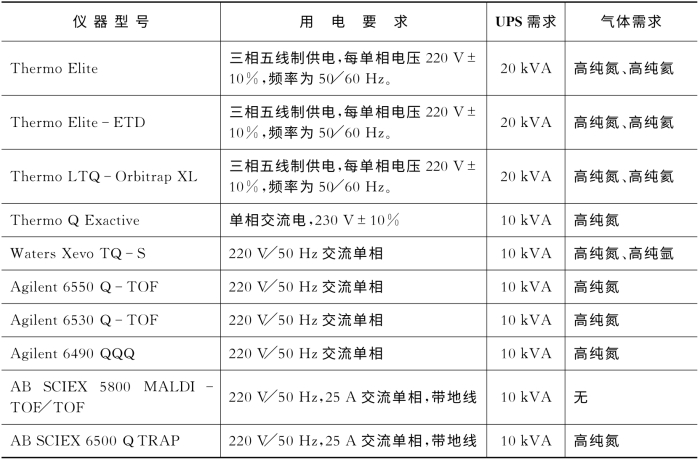
③电源插座的安装位置、规格及个数:根据各个仪器,配备足够个数的16 A插头。
(3)用气
①B2-01室准备氮气(N 2)、氦气(He)和氩气(Ar);B2-02室准备N 2;B2-03室准备N2和He。
②排气:质谱的真空机械泵需要对外排气,墙面须预留10~20 cm排气孔。
(4)温度:3个仪器间温度保持在20±2℃,配备独立大功率空调。
(5)湿度:仪器间的相对湿度保持在20%~40%,准备了除湿机。
(6)所有3个仪器间都要配备遮光窗帘。
(7)承重:600 kg/m2。B2-03室未达到要求,故重新安装了散力架。
(8)防尘:所有仪器房间均做了防尘处理。
(9)网络:每个房间都为设备预留了局域网接口。
11台仪器安装的具体时间,由系统负责人员与各家工程师协调,加以有序安排。
7.6.2.2 设备进场
事先根据现场建筑安装的情况、仪器的特性等因素,确定搬运至目的实验室的具体路线,由物流公司送至指定地点,然后由工程师进行仪器的搬运、拆箱及安装。
7.6.2.3 安装验收
所有仪器设备(包括国内和国外)的安装和调试,在采购合同中有明确规定,由供应商负责提供,采购方负责验收是否符合要求。
本系统负责人员和技术人员参与检验设备安装状态,进行部件及文件的清点、拍照、文件存档,填写安装验收报告,并在仪器供应商的协助下,对各仪器进行串联和整合。以设备为最小单元,保证各设备实现初步设计的各项最低技术指标。
7.6.3 设备调试
由生产厂家出具相应的安装和调试报告,确保各安装仪器达到运行的设计要求。这个环节要求现场人员为工程师和本系统负责人员。在保障水、电、气、温度、湿度等建筑安装条件的前提下,根据系统负责人员与各家工程师的协调,有序安排仪器调试的具体时间。本系统负责人员做好设备调试的试剂耗材准备及其他配合工作,记录设备开机运行的状态,做好实验记录。
在仪器调试阶段,厂商工程师和系统技术人员提前准备试验样品,所有的调试样品(包括利血平、咖啡因、血管紧张素等)由厂商提供。系统技术人员和厂商工程师一起,按照标准流程对相应仪器的技术指标进行测试,主要性能技术指标参照每台仪器的性能说明(灵敏度、信噪比、分辨率、指定峰强度、质量稳定性等)。相关技术参数指标达到标准后,形成正式的验收报告,并由系统负责人验收。
通过对以下不同复杂程度样品的分析,调试仪器参数,使之实现预期的功能,并为每台仪器建立相应的基准。因此,系统技术人员必须配合物资供应的相关人员,在调试功能技术指标之前,备齐以下的试剂耗材。
①不同浓度下的单一肽段(例如血管紧张素)。
②标准肽段混合物(主要考察肽段的保留时间)。
③单一蛋白质酶解物(例如牛血清白蛋白[10],考察其标志肽段的出峰时间、峰强度、峰宽和序列覆盖率等指标)。
④16种蛋白质酶解物的混合物。
⑤复杂性较小的系统(例如细菌等)。
⑥复杂系统(例如酵母、HEK细胞等)。
7.6.4 设备调谐校正
质谱仪主要通过控制传输过程中各个元器件的加载电压和时间,来完成离子束的高效传递、聚焦、分离以及检测。对于电压的精确控制,会大大影响最后的检测结果。所以,质谱仪需要定期对各个元器件的参数设定进行必要的优化,这个过程是质谱仪高效准确检测的基本条件。对这些参数的优化调谐,是仪器开始正常使用的必备步骤。并且,需要使用各自仪器要求的指定标准调谐液,开展相关的调试工作。
7.6.4.1 Thermo Q Exactive系列质谱仪
(1)离子传输(ion transfer)效率优化:质谱仪主要是利用进入检测器的离子来进行测量的。只有进入足够多的离子,才能精确得到相应物质的准确信息。工作人员通过调节控制离子传输中各个元件上所加载的电压,以控制在足够短的时间内,累积到足够多的离子进行检测。
(2)离子分离能力(quad iso mass/res cal-rough/narrow):四极杆主要用于传输过程中的离子筛选工作。进入质谱仪的离子束成分比较复杂,需要除去一些杂质离子信号的干扰,或者筛选出需要进行后续检测的离子。四极杆过滤则是筛选过程中的核心步骤。相关的调谐步骤分为粗调和细调两步,来优化筛选步骤的精确性。
(3)质量偏差校准(mass calibration):校准仪器实际测试离子分子量大小的质量轴,偏差须小于0.5 ppm。
7.6.4.2 Thermo Orbitrap系列质谱仪
①信号稳定性评价(API stability evaluation)用于诊断信号稳定性,波动要小于10%。
②离子传输透镜(transfer lens)各项参数的调谐,保证检测器的离子传输效率最大化。此参数一般要大于70%。
③在离子肼扫描模式(IT mass and resolution)下进行正常频率扫描(normal scan rate type),检测不同离子的质量准确度和分辨率。
④在离子肼扫描模式(IT mass and resolution)下进行快速频率扫描(rapid scan rate type),检测不同离子的质量准确度和分辨率。
⑤离子肼中隔离离子的波形(isolation waveform),为离子保留在离子肼和甩出离子肼时的百分比,用于检测离子的损失情况。
⑥优化离子肼中激活17%离子时需要的能量(activation waveform),同时用于检测仪器的状态。
⑦优化离子存储传输(storage transmission)参数,即FT模式[11]下存储离子时的离子传输情况。
⑧优化报告离子的处理情况(advanced signal processing)。
⑨优化FT模式下高能量碰撞诱导解离后离子的传输情况(HCD transmission)。
⑩优化FT模式下各离子测试值与真实值的偏差,对于仪器测量的精确度进行校准(mass calibration)。
 评估优化FT模式下荧蒽激发的离子传输效率(reagent source transfer multipole RF[12]frequency)。这种电子转移解离碎裂方式,在检测样品的翻译后修饰中,可以提供一种新的碎裂能量,降低多肽离子的碎裂程度,是其他碎裂方式的一个很好补充。
评估优化FT模式下荧蒽激发的离子传输效率(reagent source transfer multipole RF[12]frequency)。这种电子转移解离碎裂方式,在检测样品的翻译后修饰中,可以提供一种新的碎裂能量,降低多肽离子的碎裂程度,是其他碎裂方式的一个很好补充。
7.6.4.3 Agilent Q-TOF系列质谱仪(6530和6550)
质量轴校准(单位:ppm)主要利用校正液中各个离子的真实分子量和测出的分子量进行对比,用于检测仪器的精度,要求小于0.5 ppm(表7-13、图7-24)。
表7-13 Agilent Q-TOF系列质谱仪仪器校正后标准品的测量偏差和实际测定数值
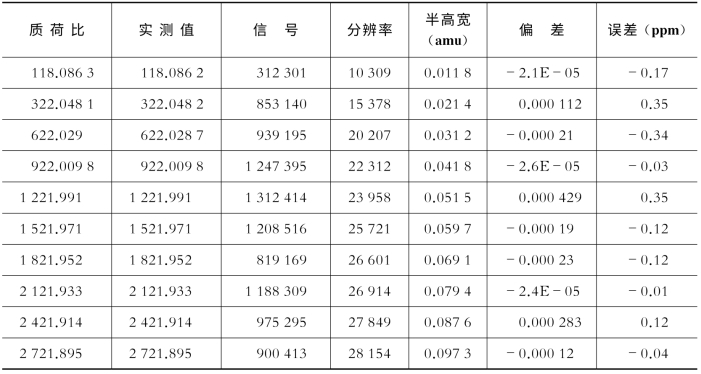
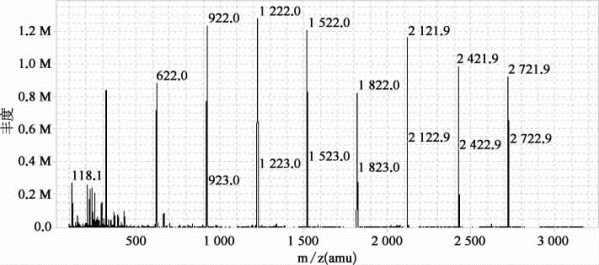
图7-24 Agilent Q-TOF系列质谱仪的调谐优化结果
表7-13和本图列举了仪器校正后标准品的测量偏差和实际测定谱图。由本图中的实测值计算出表7-13中的误差值,结果显示标准品测定误差均在0.5 ppm以内。M:百万(million)。
7.6.4.4 SCIEX 5800 MALDI-TOF/TOF质谱仪
为检测仪器精确度,用已知不同成分的混合物样品进行测试,要求仪器能够精确检测出来,如果检测有偏差可以自行校正(图7-25)。采用不同大小的化合物,可以测试仪器的检测范围。
混合物为:Des-arg1-bradykinin(标准多肽,序列:Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg),分子量904.468 0;血管紧张素(angiotensin),分子量1 296.685 0;ACTH(18-39)(促肾上腺皮质激素),分子量2 465.199 0。

图7-25 SCIEX MALDI-TOF/TOF质谱仪调谐优化结果
Final-Shots:总次数;Mix Cal-5:混合标样板5;Run#3:序号#3;Label:样品位置;Mass:质量。
7.6.4.5 Agilent QQQ系列质谱仪(型号6490)
分别调节仪器在正常模式(图7-28)、宽窗口模式(图7-29)和增强模式(图7-26、图7-27)时一级质谱和二级质谱的分辨率。仪器分辨率是分辨混合物中相邻2个组分的分离情况之主要指标。
1.增强模式
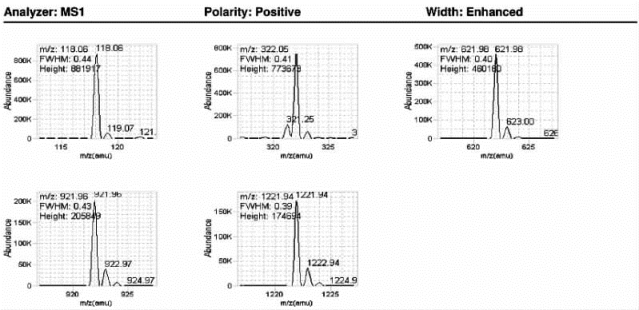
图7-26 Agilent QQQ系列质谱仪一级质谱调谐优化结果(增强模式)
图中列举了仪器校正后标准品的测量偏差和实际测定谱图,半峰全宽(FWHM)[13]符合预期值。Abundance:丰度;Height:高度。
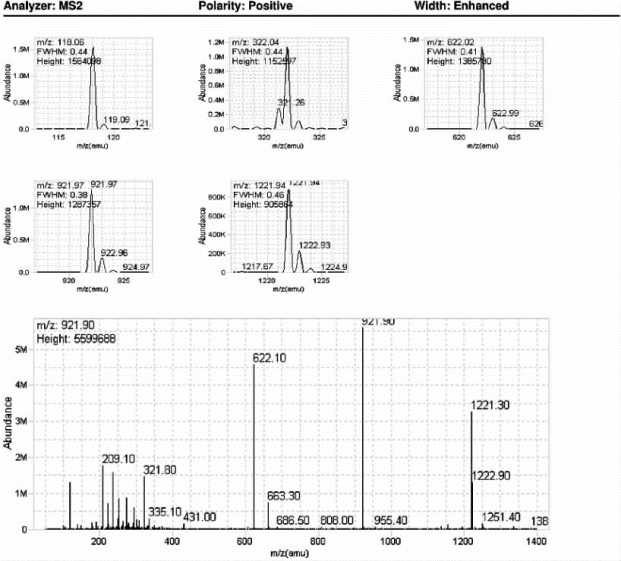
图7-27 Agilent QQQ系列质谱仪二级质谱调谐优化结果(增强模式)
图中列举了仪器校正后标准品的测量偏差和实际测定的谱图,半峰全宽(FWHM)符合预期值。Analyzer:分析器;Polarity:Positive,极性:正;Width:Enhanced:增强模式;Abundance:丰度。
2.正常模式
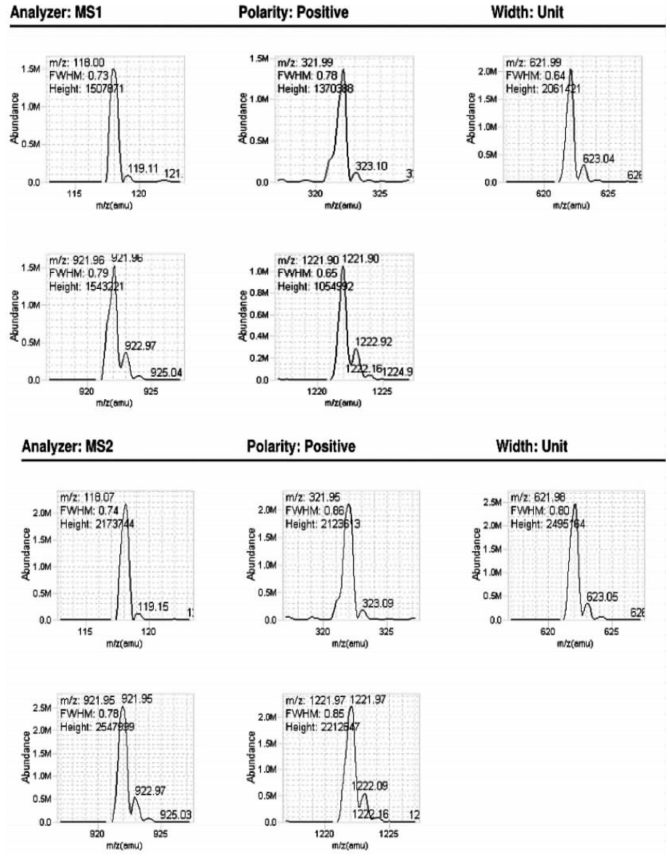
图7-28 Agilent QQQ系列质谱仪一级二级质谱调谐优化结果(正常模式)[14]
图中列举了仪器校正后标准品的测量偏差和实际测定的谱图,半峰全宽(FWHM)符合预期值。Width:Unit:正常模式。
3.宽窗口模式
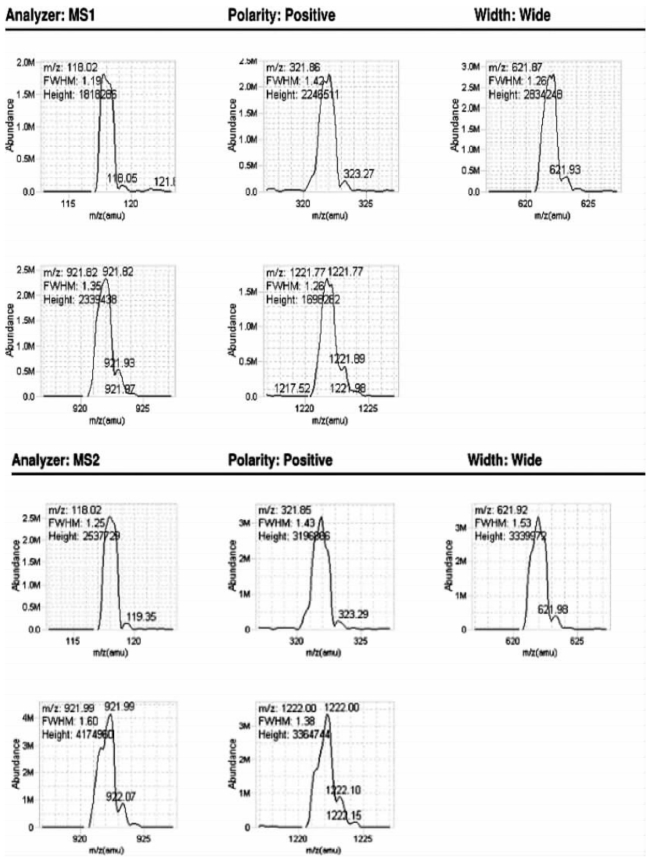
图7-29 Agilent QQQ系列质谱仪一级二级质谱调谐优化结果(宽窗口模式)[15]
图中列举了仪器校正后标准品的测量偏差和实际测定的谱图,半峰全宽(FWHM)符合预期值。Width:Wide:宽窗口模式。
7.7 测试验收
7.7.1 样品制备能力
7.7.1.1 性能指标
综合利用配备的相关仪器,通过各种技术方法的优化,完成相关样品制备体系方案的建立,使得对细胞样本的蛋白质提取通量可达到10批/d。常规蛋白质酶解通量可达到24个/h,酶解时间从常规的16 h缩短到0.5 h以内完成,并保证相同的样品处理的效率,实现一次同时处理样本数12个。
7.7.1.2 测试方案
测试主要采用HEK293细胞裂解液为模式生物,来研究样本。取相同质量的样品,平行处理样品,进行蛋白质沉淀、酶切和脱盐。在用胰酶酶切的过程中,比较蛋白质酶解仪微波55℃、酶解25 min和常规37℃、酶解16 h的样品。经过相同条件的质谱分析以后,鉴定到蛋白质和肽段的数量,用以验证短时间的微波酶解所提高的酶解效率,比起常规的酶解方法高效而省时。
实验中使用以C18为填料的毛细管分析柱(内径100μm、外径360μm、长15 cm),结合HCD[16]离子碎裂模式,来测试高分辨质谱仪对蛋白质所进行的鉴定。
具体说来,同时处理双样本,取HEK293细胞裂解液,冰水浴解冻后,加入三氯乙酸(trichloroacetic acid,TCA;6.1 mol)至终浓度25%。冰水浴上放置4 h,使蛋白质完全沉淀,离心去上清。沉淀物用预冷的丙酮清洗3次后,干燥;加入8 mol/L尿素的Tris-HCl(pH=8.5)缓冲液,溶解蛋白质并使之完全变性。然后经过5 mmol/L的三(2-羧乙基)膦[Tris(2-carboxyethyl)phosphine,TCEP]室温下反应20 min,来还原蛋白质中的二硫键,以及10 mmol/L碘乙酰胺(IAA)来烷基化产生巯基后,按照蛋白质﹕酶=1﹕50的比例加入胰蛋白酶,其中一半样本在37℃下反应16 h,另一半在微波酶解仪的作用下在55℃下反应25 min。对蛋白质酶解产物进行脱盐处理后,在质谱仪上进行上机分析。具体仪器条件设置如表7-14、表7-15所示。
表7-14 关键色谱参数(Easy n LC1000)
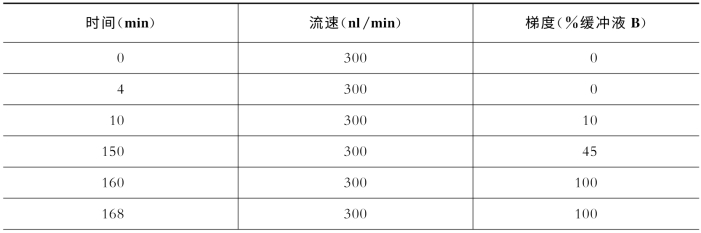
(续表)

缓冲液A:99.9% H 2 O,0.1%FA(v﹕v);缓冲液B:99.9% ACN,0.1%FA[17](v﹕v)。(https://www.xing528.com)
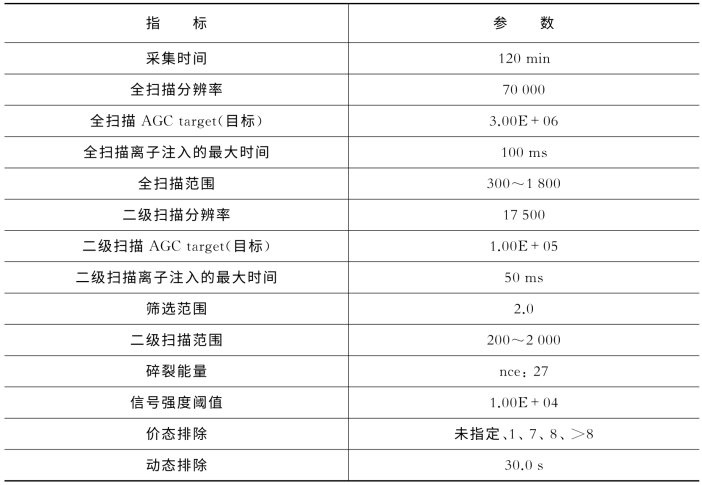
表7-15 关键质谱参数(Q Exactive)
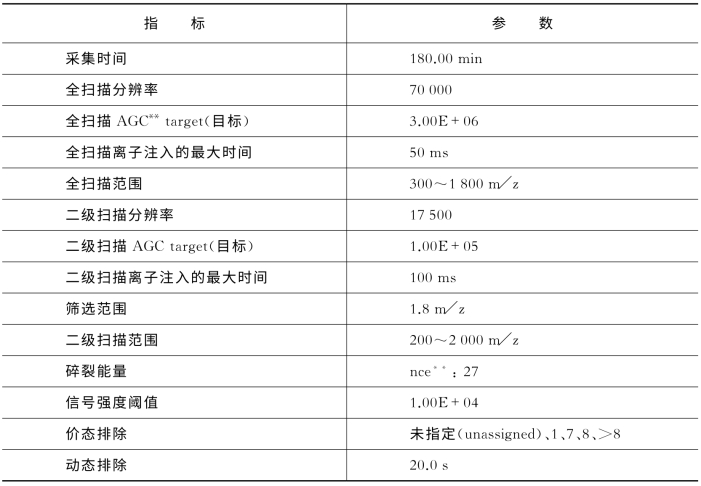
**AGC:autogain control(自动化离子捕获阈值)。nce:normalized collision energy(归一化碰撞能量)。
所采集的原始数据,通过蛋白质组学研究专业软件IP2进行数据解析。
7.7.1.3 测试设备及结果
(1)大型设备
Thermo Q Exactive。
(2)辅助设备
4℃冰箱、低温离心机、超声仪、分析天平、涡旋仪、常温离心机、移液器、CEM蛋白酶解仪、超低温冰箱、激光微喷雾管拉制机、显微镜、填柱泵、液相色谱仪、真空泵、烧杯、量筒、磁力搅拌器、磁力搅拌子、pH计、恒温水浴、通风橱、微量药匙、洗瓶等。
(3)主要试剂耗材
HEK293细胞裂解液、超纯水、质谱级乙腈、质谱级甲醇、三羟甲基氨基甲烷(Tris)、尿素、醋酸铵、碘乙酰胺、三(2-羧乙基)膦(TCEP)、二硫苏糖醇(dl-dithiothreitol,DTT)、甲酸、丙酮、三氯乙酸、胰酶、NH 4 HCO 3等。
(4)耗材
载玻片、封口膜、0.6 ml离心管、1.5 ml离心管、15 ml离心管、50 ml离心管、移液管、100和250μm毛细管、C18填料、无尘纸、各种量程移液器吸头、宽口瓶、棕色宽口瓶、C18脱盐小柱、三氟乙酸、内衬管、进样瓶、色谱柱。
(5)环境保障条件
实现稳定可控的温湿度、无尘条件、UPS电源等。
(6)测试结果及结论
常规37℃酶解16 h样品,与用CEM蛋白酶解仪在55℃酶解25 min,在相同条件下进行鉴定,用相同的IP2软件进行数据处理,得到的结果是:通过2种预处理方法鉴定出的蛋白质数量分别为1 842和1 978个蛋白质。用微波加速酶解能达到与常规酶解法一样的理想效果(见表7-16)。
表7-16 CEM蛋白酶解与常规酶解对比
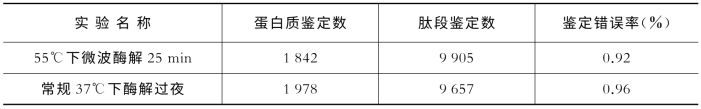
采用微波模式可以使酶解速度最快达到0.5 h以内,比现有常规速度提高约32倍。采用多通道微波酶解模式,能够同时处理的样本达24个/h。按照样品数量,每天可处理10批样品。
7.7.2 对蛋白质的高通量鉴定能力
通过质谱仪对蛋白质进行鉴定,最普遍的方法称为“鸟枪法”(shotgun)[1]。这是由美国斯克里普斯研究所的J.Yates于1998年提出的。其基本原理是,先对有待分析的蛋白质复合物进行特异性酶切,产生具一定特征的肽段复合物,并进行质谱分析,得到肽段以及肽段碎片的图谱信息。然后通过蛋白质组学软件,将理论信息和实际信息进行比对,得到蛋白质鉴定的结果。对一个蛋白质来说,2条以上的肽段被鉴定到,就认为该蛋白质鉴定成功。在高分辨质谱技术高速发展的今天,蛋白质鉴定的数量、质量和通量也在飞速发展。
有关蛋白质鉴定能力的考察,涉及液相色谱仪的灵敏度、鉴定目标蛋白质的序列覆盖率(鉴定到的氨基酸序列占全长的百分比),以及一次性鉴定到的蛋白质数目。仪器的灵敏度对微量蛋白质的鉴定至关重要,通常使用低浓度的标准肽复合物,经液相质谱系统的分离分析之后,以复合物中所有肽段的色谱峰全被鉴定到的最低浓度,为该仪器的灵敏度标准。考察目标蛋白质的覆盖率,可全面评估蛋白质样品前处理过程和液相色谱质谱方法,其基本原理是应用“鸟枪法”的流程,对蛋白质进行鉴定,在结果中考察目标蛋白质的覆盖率。一次性蛋白质鉴定的数目是对蛋白质鉴定综合能力的全面考察。在这项考察中,质谱检测前的液相色谱分离至关重要。为了鉴定到尽可能多的蛋白质数目,二维色谱分离的方法应运而生[7,8]。此法是在常规酸性pH条件下的反相色谱分离(第二维)之前,根据肽段性质进行预分离,如碱性pH条件或者不同的盐浓度(第一维)。通常,二维分离分为在线和离线两种。在线分离是指通过设置液相色谱方法,在色谱仪上连续完成二维分离过程;而离线分离的第一维则在“线下”完成,使用固相柱或半制备液相完成对样本的第一维分离,一维分离后的样本再在液相色谱质谱系统上进行反相第二维分离。离线与在线的二维分离技术,都有很广泛的实际应用,从样本的损失和人工的方面考虑,在线二维分离无疑是具有其优势的。
7.7.2.1 灵敏度测试
使用以C18为填料的毛细管分析柱(内径100μm,外径360μm,长15 cm),结合纳喷软电离技术与液质分离分析技术。具体过程是:取商业化标准肽段试剂盒(peptide retention time calibration mixture,5 pmol/μl),逐级稀释至终浓度5 fmol/μl。通过自动进样器进样1或2μl(即5或10 fmol),进行在线梯度洗脱质谱检测。具体参数如表7-17、表7-18所示。
表7-17 关键色谱参数(Easy n LC1000)
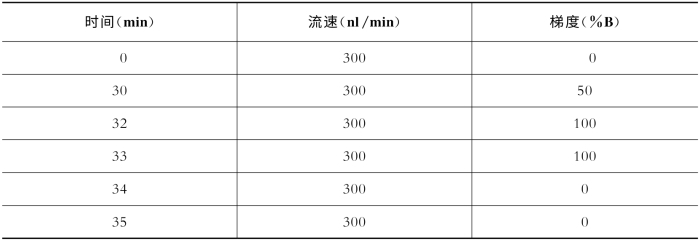
缓冲液A:99.9% H 2 O,0.1%FA(v﹕v);缓冲液B:99.9% ACN,0.1%FA(v﹕v)。
表7-18 关键质谱参数(Q Exactive)
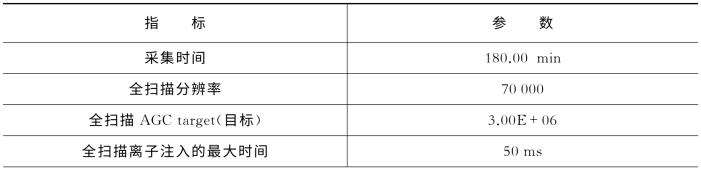
(续表)
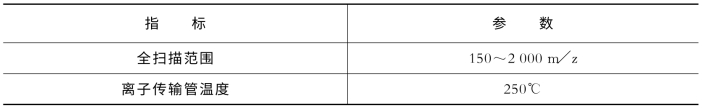
通过Xcalibur软件,对15条标准肽进行峰提取。测试设备为液相色谱仪Easy n LC 1000与质谱仪Thermo Q-Exactive联用。
7.7.2.2 结果分析
从标准蛋白质的肽段混合物出发,检测质谱仪的灵敏度。进样5 fmol可测到大部分肽段(13/15)。进样10 fmol可测到所有肽段(15/15),峰提取如图7-30所示。

图7-30 15条标准肽段的检测结果(灵敏度测试)(彩图见图版第26页)图内大写字母是氨基酸的单字母符号表示。
7.7.2.3 蛋白质覆盖率测试
使用C18为填料的毛细管反相色谱分析柱(内径100μm,外径360μm,长15 cm),结合纳喷软电离技术与液质分离分析技术,检测蛋白质覆盖率。具体地说,将标准蛋白质牛血清白蛋白(BSA)溶于水,配制成1μg/μl的溶液。加入TCA(6.1 mol)至终浓度25%。冰浴条件下放置4 h,使蛋白质完全沉淀,离心去上清。沉淀物用预冷的丙酮清洗3次后,在空气中使丙酮挥发;加入8 mol/L尿素的Tris-HCl(pH=8.5)缓冲液,溶解蛋白质并使之完全变性。蛋白质的尿素溶液,经过5 mmol/L TCEP(室温,20 min)二硫键的还原反应和10 mmol/L碘乙酰胺(IAA)巯基上的烷基化反应后,按照蛋白质﹕酶的比例为1﹕50(质量﹕质量)加入胰蛋白酶(trypsin),37℃酶切过夜。处理好的酶切混合物上样至C18反相分析柱上,脱盐后在线梯度洗脱,进行质谱检测。具体仪器条件设置如表719和表7-20所示。
表7-19 关键色谱参数(Easy n LC1000)
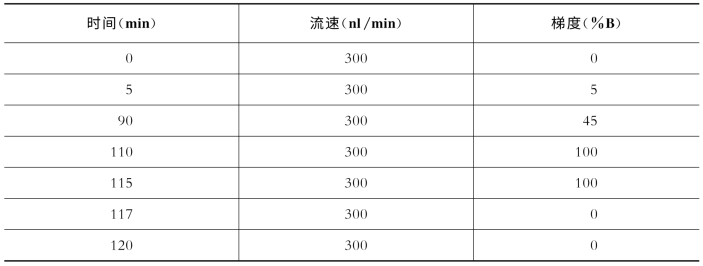
缓冲液A:99.9% H 2 O,0.1%FA(v﹕v);缓冲液B:99.9% ACN,0.1%FA(v﹕v)。
表7-20 关键质谱参数(Q Exactive)
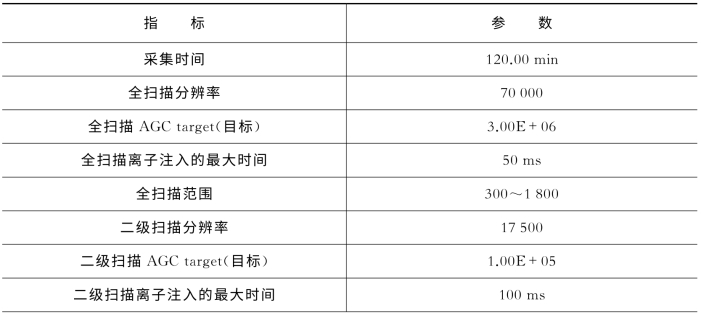
(续表)
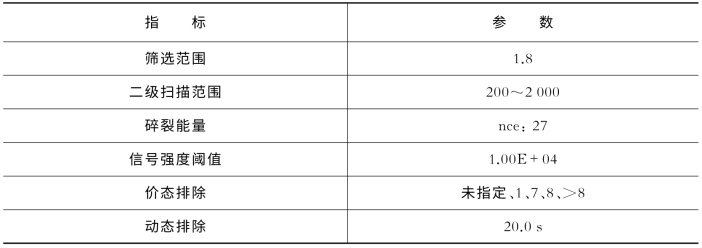
所得的原始数据通过蛋白质组学研究专业软件IP2,进行数据分析。
7.7.2.4 结果分析
通过纳喷液质谱分析,鉴定到牛血清白蛋白(BSA),且覆盖率达到70%以上(表7-21)。
表7-21 BSA覆盖率检测结果

7.7.3 蛋白质鉴定的综台能力测试
7.7.3.1 测试方案
从提高蛋白质鉴定的数量和效率上考虑,选择在线二维色谱分离技术。其中,多维蛋白质鉴定技术(MudPIT)可实现采用串联SCX柱和C18反相分析柱的方式,简称SCX-RP[18]。通过依次从低浓度到高浓度的盐,对结合在SCX上的肽段进行分批洗脱。每次从SCX洗脱下来的肽段,随后进行反相C18分离,并进行质谱检测。在这个方法里面,由于肽段在SCX和反相C18的分离属于正交分离,因此分离效果非常理想。Mud PIT技术的缺点是,盐会直接进入质谱。如此造成的不良后果有:①高浓度盐容易污染质谱仪,缩短质谱仪的维护周期;②盐的选择范围受限,必须为挥发性盐,如乙酸铵等,这在一定程度上减弱了第一维分离的洗脱能力,因此对离子化强的盐如NaCl等,不能应用本技术。除SCX柱,高pH洗脱也成为第一维分离的选择,简称反相-反相分离(high pH reverse-low pH reverse phase,RPRP)[9]。在此系统中,第一维色谱柱为高pH色谱柱。样品进入第一维色谱柱后,第一维梯度泵可以按使用者要求,自动地、阶梯式地提高有机相的比例,以便将样品中不同的疏水性肽段分批洗脱下来。从高pH反相柱上洗脱下的多肽,会被富集柱捕获。每批次被富集的多肽,将在第二维泵的线性梯度模式下,进入低pH反相分析柱,在这里经过充分分离后,样品到达离子源,进入质谱分析器。
使用SCX和C18为填料的多维液相毛细管分析柱(内径250μm,外径360μm,长约5 cm;内径100μm,外径360μm,长15 cm),结合纳喷软电离技术与液质分离分析技术进行检测。具体地说,HEK293细胞的全细胞蛋白质,加入TCA(6.1 mol)至终浓度25%。采用与344页第5—9行描述相同的样品处理方式。处理好的酶切混合物上样至C18-SCX-Trap柱上,脱盐后在线进行二维梯度洗脱(流速:300 nl/min)。SCX柱的洗脱液为乙酸铵溶液,以50、100、200、300、400、500、450 mmol/L(含10%乙腈)乙酸铵溶液作为7步,依次将结合在SCX柱上的肽段,洗脱至反相分析柱上进行分离。除SCX-RP二维分离之外,同时测试RPRP二维分离的效果,将肽段在高pH和低pH条件下分别进行分离。原始质谱数据通过专业软件IP2进行数据分析,最后对2种在线二维分离方法下质谱检测到的结果数据进行比较。测试设备为Thermo Q Exactive质谱仪。
7.7.3.2 结果分析
从人源HEK293全细胞蛋白质出发,考察蛋白质的样品制备、酶解以及蛋白质质谱分析鉴定的综合能力。通过90 min梯度的反向色谱柱分离(见图7-31、表7-22、表7-23),从0.5μg HEK293全细胞蛋白质酶解产物中鉴定到2 645个蛋白质、19 204条肽段,假阳性率小于1%。
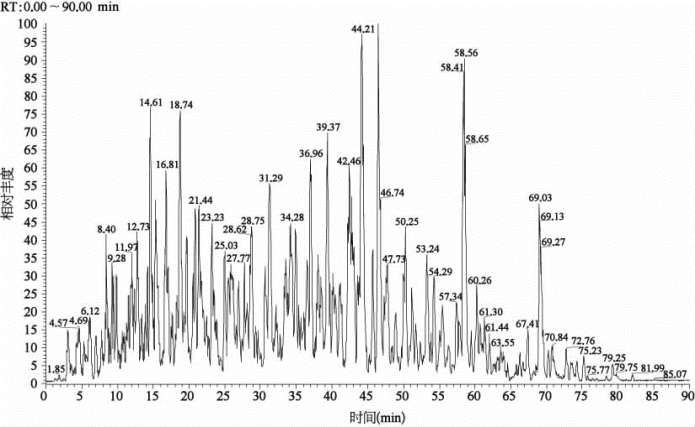
图7-31 0.5μg HEK293全细胞蛋白质酶解产物90 min反相分离的色谱图
RT:保留时间(retention time)。
表7-22 关键色谱参数(Easy n LC1000)

缓冲液A:99.9%H 2 O,0.1%FA(v﹕v);缓冲液B:99.9%ACN,0.1%FA(v﹕v)。
表7-23 关键质谱参数(Q Exactive)

7.7.3.3 MuDPIT与RPRP两种技术的比较
在MudPIT技术条件下(图7-32、图7-33、表7-24、表7-25),从10μg的HEK293全细胞蛋白质中一次鉴定到5 754个蛋白质、38 808条肽段,鉴定蛋白质的假阳性小于1%。在RPRP技术条件下(图7-34、表7-26、表7-27),从10μg的HEK293全细胞蛋白质中一次鉴定到5 667个蛋白质、61 451条肽段,鉴定蛋白质的假阳性小于1%。
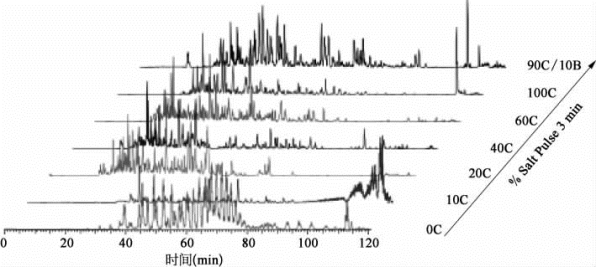
图7-32 以MudPIT为基础的蛋白质鉴定(彩图见图版第27页)
Salt Pulse:盐脉冲梯度洗脱。
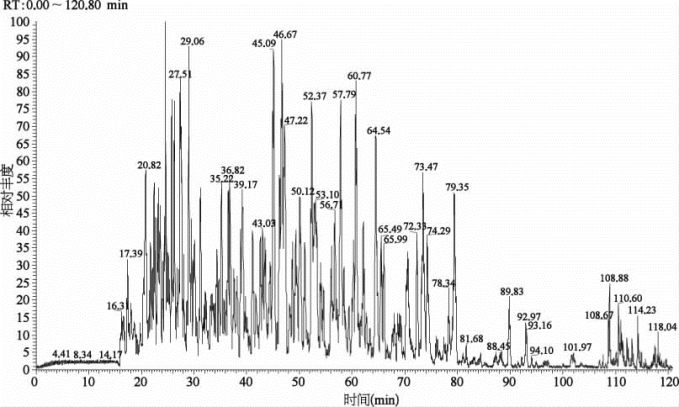
图7-33 SCX柱20%缓冲液C(100 mmol/L乙酸铵溶液)洗脱馏分反相分离分析120 min的色谱图举例
表7-24 关键色谱参数(Agilent 1200)

(续表)
缓冲液A:99.9%H 2 O,0.1%FA(v﹕v);缓冲液B:99.9%ACN,0.1%FA(v﹕v);缓冲液C:500 mmol/L乙酸铵。
表7-25 关键质谱参数(Q Exactive)
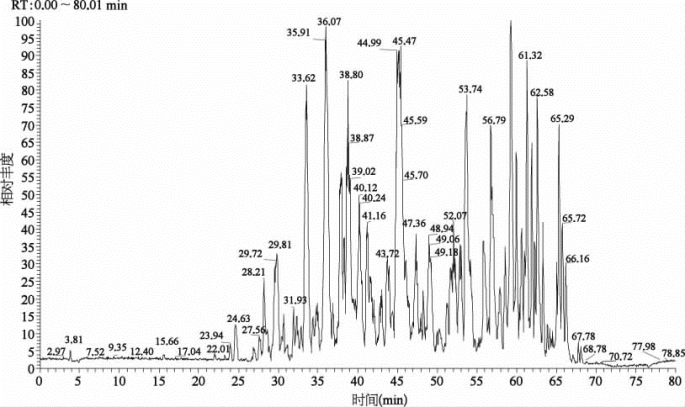
图7-34 反相反相分离分析80 min的色谱图
表7-26 关键色谱参数(Eksigent 425 LC)

缓冲液A:99.9%H 2 O,0.1%FA(v﹕v);缓冲液B:99.9%ACN,0.1%FA(v﹕v)。
表7-27 关键质谱参数(Q Exactive)
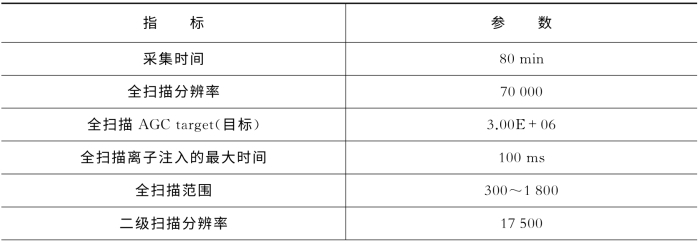
(续表)
7.7.4 功能蛋白质及其相互作用的定量分析
近10年来,随着生物质谱技术的发展和生物信息学技术的进步,规模化地精确测量细胞内蛋白质组的表达变化,已经成为现实。与传统的蛋白质定量方法(如免疫学手段等)相比,组学规模的蛋白质定量,可以在一次实验中实现对成百上千个蛋白质的定量测定和比较分析,为规模化发现和验证疾病诊断的生物标志物,以及发展新的药物靶标,提供了重要的手段。
根据是否对蛋白质/多肽进行标记,定量蛋白质组学方法可分为标记和非标记两类;而根据定量目的之不同,又可分为相对定量和绝对定量。前者是对不同样本中相同蛋白质群表达量的相对变化进行分析,而后者是对样本中单个蛋白质或蛋白质组的绝对量或浓度进行测定。根据是否有目标蛋白质信息,可将相对定量分为非靶向相对定量和靶向相对定量。应用较为广泛的策略,也就是运用非靶向相对定量来筛选目标蛋白质序列,结合对目标蛋白质的靶向绝对/相对定量分析,为筛选潜在的疾病标志物提供数据支持。
标记定量方法是基于在蛋白质或肽段中引入稳定同位素标记(如13 C和15 N)。对肽段的同位素标记,常用的分析方法有同位素标记相对和绝对定量技术(i TRAQ)及串联质谱标签(TMT)两种。它们原理相似,标记试剂具有相同的分子质量,与肽段的伯胺发生缩合反应带上标签。进行质谱分析时,肽段标签通过合适的碎裂,产生具有差异分子量的报告离子。根据各通道的报告离子强度,进行肽段定量。关于蛋白质的同位素标记方法,应用最为广泛的是SILAC法,由德国马普研究所的M.Mann团队开发[5]。其原理简单地说,是用带有不同同位素组合的氨基酸(通常为精氨酸和赖氨酸)饲喂细胞,使各个实验条件下的细胞标记状态变得不同。在收获细胞时,按照相同的细胞数进行混合,继续后续的样品前处理以及质谱分析。由于SILAC技术从实验设计的源头上控制了实验误差,因而被认为是最准确的定量方法。标记定量方法保证了在同一次质谱扫描中,标记“轻”和“重”同位素的多肽具有相同的色谱行为和离子化效率。成对出现的质谱峰信号的相对强度,可以精确反映样品中多肽的丰度比例(蛋白质的比例)。
靶向绝对定量分析是对通过相对定量分析找到表达量显著变化的蛋白质,设计靶向定量方法,进行更为精准的质谱确证。常用的方法有选择性反应监测扫描(SRM)、多反应监测扫描(MRM)和平行反应监测扫描(PRM)[19]。平行反应监测建立在高分辨质谱平台之上,利用Orbitrap对某肽段的母离子和子离子进行监测。Orbitrap提供精准的子离子信息,使PRM在精准度上优于MRM。
7.7.4.1 TMT标记定量分析实验方案
以哺乳动物的细胞蛋白质酶解肽混合物为样本,加入稳定同位素TMT,检测质谱体外相对定量的能力及准确性。
提取丙型肝炎病毒感染和未感染的细胞的总蛋白质,酶切后进行TMT稳定同位素标记。然后将标记后的蛋白质进行等量混合,采用MudPIT方法进行质谱分析(图7-35、表7-28、表7-29),通过IP2软件进行数据分析,由此比较丙型肝炎病毒感染不同时期细胞以及未感染细胞的蛋白质表达差异。采取测试设备Easy n LC1000与Orbitrap QE质谱联用。
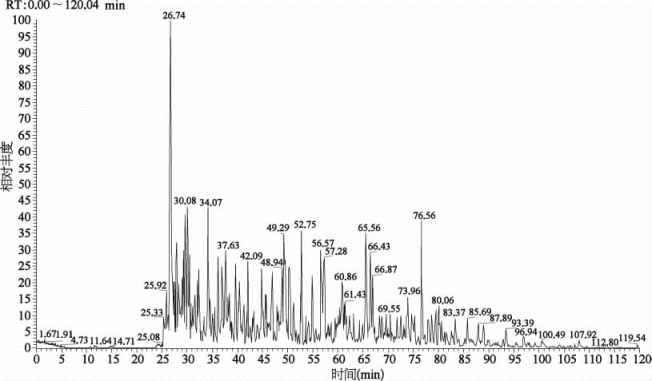
图7-35 SCX柱60%缓冲液C(300 mmol/L乙酸铵溶液)洗脱馏分反相分离分析120 min的色谱图举例
7.7.4.2 结果分析
通过一次实验共鉴定到4 954个蛋白质,其中假阳性率均低于1%,3 854个蛋白质可用于定量研究。
表7-28 关键色谱参数(Agilent 1200)
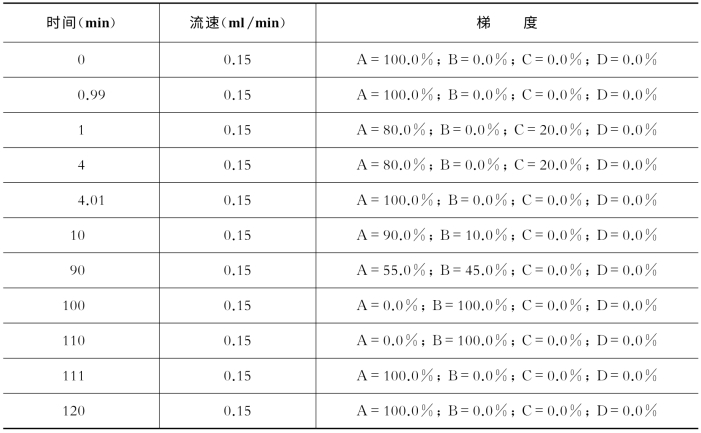
缓冲液A:99.9%H 2 O,0.1%FA(v﹕v);缓冲液B:99.9%ACN,0.1%FA(v﹕v);缓冲液C:500 mol/L乙酸铵。
表7-29 关键质谱参数(Q Exactive)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




