电镜系统包含有3个模块——样品制备模块、数据收集模块(电镜)和数据分析处理模块。关键设备包括3台冷冻透射电镜、若干台高配置的制样设备以及高性能运算处理设备。
6.5.1 电子断层的三维重构分辨率
6.5.1.1 验收指标
完成1个或多个分辨率在2~10 nm的细胞或细胞器等大尺度生物结构的电子断层三维重构。
6.5.1.2 测试方法:电子断层三维重构与冷冻透射电镜观察
1.脂质体样品制备
(1)分别取DOPC 60μl和Ni-DOPC[10]20μl,混匀之后放置在通风橱中约2 h。
(2)待干燥后加入Tris-NaCl[11]缓冲溶液(pH 8.0),用移液枪枪头吹打均匀之后,转入脂质体微型挤出仪(Avanti Original mini-extruder design)的250μl注射器中。按照脂质体微型挤出仪的使用说明,来回抽吸10 min左右(使用0.2μm规格的过滤膜过滤)。待乳白色的脂质体液体变得均匀透明之后,转移到离心管中备用。
(3)取直径为10 nm的纳米金颗粒100μl,超声破碎30 min备用。
(4)取制好的脂质体6μl,加入金颗粒14μl,进行制样;或者取制好的脂质体6μl,加入1μl(浓度0.5 mg/ml)对照蛋白质SDK1[12],5 min后加入金颗粒13μl,进行制样。
2.快速冷冻样品制备
(1)清洗铜网:将Quantifoil铜网(400目)放置于干净玻璃皿内,用丙酮浸泡1 d之后取出铜网,用无水乙醇清洗3次,自然晾干。
(2)亲水化铜网:取清洗过的干燥铜网1枚,利用光学显微镜观察碳膜状态,确定铜网上碳膜完整,无大面积破裂。将铜网放置于等离子清洗仪内,氢气(H 2)和氧气(O 2)为1﹕1的比例。铜网亲水化10 s。
(3)用自动冷冻制样仪制备样品:用液氮液化乙烷气体,使之形成液态乙烷。利用自动冷冻制样仪快速冷冻制样设备。将点在铜网上的脂质体样品,经由液态乙烷冷冻,在毫秒时间内制成冷冻样品,使样品得以保存在与水环境极为相似的环境中。自动冷冻制样仪参数设定为:滤纸吸附时间(blot time)5 s,滤纸吸附力度(blot force)0。制样之后,样品放入液氮中保存,待电镜观察。
3.冷冻电镜观察
设备参数与设置为:加速电压200 kV;放大倍数50 000倍;运用FEI TEM Tomography(X射线断层摄影)软件,正负倾转65°。调节相应参数,收集数据。
4.软件重构
将电镜采集得到的mrc格式文件导入Ispect 3D软件,通过计算处理,得到样品倾转的动态结果,保存为avi格式导出。也可以重构得到rec格式文件后,再导入Amira软件渲染,最终保存为avi格式导出。
6.5.1.3 测试设备及结果
(1)测试设备:Tecnai G2 F20冷冻透射电镜。

图6-30 脂质体电子断层三维重构示意图(用上海设施Tecnai G2 F20冷冻透射电镜拍摄)
(2)测试结果:如图6-30所示,脂质体双层膜结构清晰可见,分辨率在2~10 nm左右。
6.5.1.4 测试结论
测试结果满足测试指标。
6.5.2 可解析的分子量范围
6.5.2.1 验收指标
利用负染等方法,将可解析的分子量范围进一步延伸到100 kDa。
6.5.2.2 测试方法:负染与常温透射电镜观察
1.蛋白质样品
蛋白质DEC-205是免疫细胞表面受体蛋白,胞外区域有180 kDa,通过镍柱亲和纯化。纯化后经过稀释,制备成浓度约50μg/ml的蛋白质样品。
2.负染样品制备
(1)用蛋白质样品湿润铜网:取铜网1张,用移液枪滴一滴蛋白质样品在铜网上,用滤纸将残余蛋白质样品吸走。之后,再在铜网上加入5μl样品,静置1 min。
(2)染色:在静置1 min之后,滤纸吸走残余蛋白质溶液。加入5μl醋酸铀染液,然后用滤纸将残余染液吸走。再次加入5μl醋酸铀染液,静置1 min以后用滤纸吸干。
3.透射电镜观察
高压120 kV,放大倍数为96 000倍。相机参数为像素合并(binning)1,曝光时间1 s。
6.5.2.3 测试设备及结果
(1)测试设备:Tecnai G2 Spirit冷冻透射电镜。

图6-31 DEC-205蛋白的负染样品在电子束照射下的形态特征(用上海设施Tecnai G2 Spirit冷冻透射电镜拍摄)
结合单颗粒重构技术,可以得到样品的三维形貌特征。
(2)测试结果:如图6-31所示,白色衬度显示为蛋白质样品,深色衬度为背景。蛋白质形貌清晰可辨。
(3)测试结论:在实验过程中,使用了分子量在130~180 kDa左右的蛋白质样品。运用负染方法能够清晰地拍摄到蛋白质样品的形貌特征。进而使用该方法可以将解析的分子量范围延伸至100 kDa左右。满足设计指标。
6.5.3 单颗粒三维重构能力(https://www.xing528.com)
验收指标是:完成1个或多个分辨率在0.8~1.2 nm,分子量为200 kDa以上的生物大分子复合物(如蛋白质分子机器、膜蛋白复合物或病毒等)的单颗粒三维重构。
6.5.3.1 肠道病毒EV71冷冻电镜单颗粒三维重构测试
1.测试方法:单颗粒重构与冷冻透射电镜观察
(1)类病毒样样品:肠道病毒71(enterovirus71,EV71),分子量达到5 MDa。
(2)电镜快速冷冻样品制备:参见6.5.1.2的“2.快速冷冻样品制备”(295—296页)。
(3)冷冻电镜观察:设备参数与设置为:加速电压300 kV;使用低电子剂量模式来控制样品曝光的时间和总电子剂量;使用欠焦值为1~2μm;Falcon相机像素合并为1,曝光时间为1 s。放大倍数为69 000倍左右。收集数据时,选择最佳区域,确保每张照片上大约显示50个病毒样单颗粒。
(4)单颗粒重构:运用EMAN软件,挑选电镜照片中的颗粒,通过参数输入与计算机运算,重构出样品结构,并得到相应的分辨率信息。
2.测试设备及结果
(1)测试设备:Titan Krios冷冻透射电镜。
(2)测试结果:如图6-32所示,经过EMAN软件处理和计算之后的EV71类病毒样样品的形貌特征,可以清晰辨认为球形颗粒状。重构后得到的分辨率如图6-33所示,为1.145 nm。

图6-32 单颗粒重构结果(彩图见图版第23页)
(a)EV71病毒的三维重构结果,为球形颗粒状;(b)类病毒样样品EV71的重构结果与EV71原壳体晶体结构的比对结果。
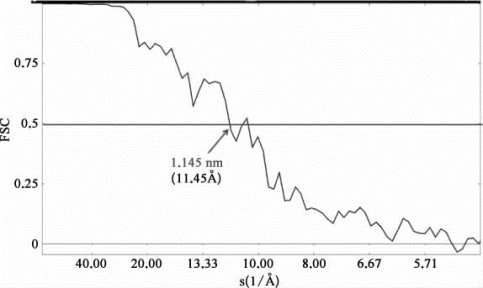
图6-33 EV71样品重构后的分辨率
这里分辨率取值依据傅里叶壳相关曲线(Fourier shell correlation,FSC)为0.5的标准。1Å=0.1 nm。
6.5.3.2 鲍鱼血蓝蛋白Ht H1冷冻电镜单颗粒三维重构测试
1.测试方法:单颗粒重构与冷冻透射电镜观察
(1)超大分子复合物样品:鲍鱼血蓝蛋白Ht H1,分子量为8 MDa,D5对称性。
(2)电镜快速冷冻样品制备:参见6.5.1.2的“2.快速冷冻样品制备”(295—296页)。
(3)冷冻电镜观察:设备参数与设置:加速电压300 kV;使用低电子剂量模式,使用欠焦值为1~3μm;Falcon相机像素合并为1,曝光时间为1 s。放大倍数为47 000倍(0.142 nm/像素)。收集数据时,选择最佳区域,确保每张照片上大约显示30个单颗粒。
(4)单颗粒重构:综合运用EMAN1及EMAN2单颗粒重组软件包,共挑选电镜照片中的3 600个颗粒,通过参数输入并应用电镜系统的图形界面化工作站,进行三维重构运算,重构出样品的低温电镜三维结构。
2.测试设备及结果
(1)测试设备:Titan Krios冷冻透射电镜。
(2)测试结果:如图6-34所示,图为最终经过EMAN1软件处理和计算之后的Ht H1样品的形貌特征,从中可以清晰辨认呈圆桶状。重构后螺旋(helix)的棒状结构清晰可见,此为解析水平达到亚纳米(<1 nm)量级的判断标准。根据此二级结构特征判断,分辨率在0.8~0.9 nm(图6-34c)。

图6-34 HtH1样品冷冻电镜三维重构后的结构(彩图见图版第24页)
(a)为俯视图。(b)为侧视图,其中一个非对称性结构单元中置入了相应的同源类似物原子模型[蛋白质银行识别号(PDB ID):4 bed]。(c)为其中一个亚基结构细节的放大图。
3.测试结论
运用病毒样品EV71以及超大分子复合物Ht H1进行实验,经过单颗粒重构后得到分辨率为1.145 nm以及大约0.8~0.9 nm,满足设计要求。
6.5.4 生物大分子三维重构能力的测试结论
①样品为脂质体双层膜,采用电子断层三维重构,可清晰看到双层膜结构,分辨率达到2~10 nm。满足设计要求。
②利用负染方法,可清晰拍摄分子量在130~180 kDa之间的蛋白质样品。可进一步将解析分子量延伸至100 kDa,以满足设计要求。
③运用病毒样品EV71与超大分子复合物Ht H1进行实验,经过单颗粒重构后所得到的分辨率结果满足设计要求。
④每季度能测定20个三维结构,分辨率在1 nm或更高的达到2个。在样品本身的浓度与状态满足电镜数据收集的条件下,从测试过程中数据收集的时间判断,解析容量满足设计指标。
6.5.5 测试专家意见
对上海设施集成化电镜分析系统各项指标的测试表明:系统各项指标均达到工艺验收指标要求,并可以得出以下结论。
①系统具备对生物大分子复合物、膜蛋白复合物、蛋白质分子机器、病毒(分子量为200 kDa以上)等,以及对细胞、细胞器等大尺度三维结构的解析能力。
②对单颗粒三维重构的分辨率达到0.8~1.2 nm。
③对大分子复合物的电子断层三维重构的分辨率达到2~10 nm。
④可解析的分子量范围进一步延伸至100 kDa。
⑤利用冷冻电镜,每年具备解析至少80个分子量为200 kDa以上的生物大分子复合物、膜蛋白复合物、病毒和细胞器等的空间结构的能力,其中分辨率在1 nm或更高的有6~8个或更多。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




