2.4.1 技术方案
目前的蛋白质表达系统,主要有大肠杆菌表达系统、酵母表达系统、昆虫细胞表达系统、哺乳动物细胞表达系统以及较为新颖的无细胞表达系统等[46]。鉴于无细胞表达系统消耗高、产量低、重复性差等不利因素,而酵母表达系统的作用完全可以被昆虫细胞表达系统和哺乳动物细胞表达系统所替代,设施科技人员在设计方案上引入了大肠杆菌表达系统、昆虫细胞表达系统和哺乳动物细胞表达系统与自动化蛋白质表达系统相结合。
随着机械工程和自动化相关技术及方法的不断更新,以及它们与生命科学众多研究领域不断地深入交叉,高通量和自动化已经渗透到生命科学的各个分支当中,并且在生命科学的众多领域得到广泛应用。如何利用真核表达系统进行高通量、自动化的大规模蛋白质样品表达筛选,是蛋白质科学相关领域科学家所关心的问题之一。之前受制于传统克隆构建方法的低下效率,以及自动化技术不成熟导致的高额成本,上述问题一直未能得到很好解决。如今,在高通量自动化克隆构建系统的基础上,设施科技人员与相关自动化生产厂家共同开发了高通量自动化真核细胞表达系统,该系统可以实现高通量的蛋白质真核细胞表达和可溶性检测,快速筛选目标蛋白质的表达条件,为放大实验进行大量和规模化的蛋白质制备打下基础。

图2-10 多种体系蛋白质表达模块的构成及设计流程图
所谓多种体系蛋白质表达模块,包括原核细胞(大肠杆菌)和真核细胞(昆虫细胞、哺乳动物细胞)两大系统。由于蛋白质的表达具有个性化的特征,因此难以建立普适性的解决方案。采用多种体系的蛋白质表达模块,可以综合各种表达系统的特点,发挥体系集成的优势。在该模块中,科技人员会优先尝试将目标蛋白质在大肠杆菌系统中进行可溶性表达的筛选,如果成功则进行后续的蛋白质纯化、表征和结晶实验,反之则将目标基因克隆至昆虫细胞、哺乳动物细胞等真核细胞表达系统中,重新筛选蛋白质的可溶性表达情况。多种体系蛋白质表达模块的构成及设计流程请见图2-10。
2.4.2 原核细胞表达系统

图2-11 原核细胞表达系统设计流程图
虽然原核细胞(大肠杆菌)表达系统容易形成包涵体,无翻译后修饰功能,但由于其遗传背景清楚,基因工程操作方便,商品化表达载体种类齐全,表达效率高,应用也最广泛,因此科技人员会优先尝试将目标蛋白质在大肠杆菌体系中进行可溶性表达的筛选。科技人员决定选择大肠杆菌作为表达系统后,首先需要进行质粒构建,进一步将重组质粒转化到大肠杆菌菌株中,转化后,采用微生物高通量筛选设备进行自动化的克隆挑选,之后通过加入IPTG[5]对这些质粒上自带的启动子进行诱导,从而使得目标蛋白质得以大量表达。这部分工作可以利用规模化克隆和可溶性表达筛选模块的相关设备来完成,最后运用自动化蛋白质纯化系统从表达产物细胞中小量纯化出目标蛋白质,快速获得目标蛋白质可溶性表达条件。原核细胞表达系统设计流程见图2-11。
2.4.2.1 安装和调试
经设施科技人员与厂家工程师紧密合作,通过严格的FAT及SAT验收流程,并经仔细严谨的调试,顺利完成了高通量自动化大肠杆菌表达系统的安装调试(图2-12、图2-13、图2-14)。
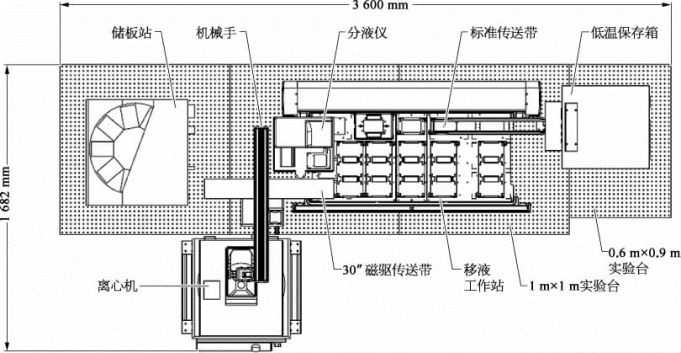
图2-12 高通量自动化大肠杆菌表达系统设计平面图

图2-13 高通量自动化大肠杆菌表达系统立体效果图

图2-14 高通量自动化大肠杆菌表达系统安装调试
2.4.2.2 原核细胞表达系统的实验流程
①微生物高通量筛选系统将待表达的克隆挑取至96孔深孔板(1 ml/孔)。
②经自动化培养箱过夜培养后,用高通量自动化原核细胞表达系统进行转接培养。
③酶标仪(酶联免疫检测仪)自动监测OD[6]值0.5,移液工作站加入IPTG至终浓度100μmol/L,经16℃自动培养过夜后,转入储板站。
④从储板站中取出细胞培养板,在常温下以6 000g的离心力,离心5 min。
⑤离心后将细胞培养板放在移液工作站上,吸取上清液并丢弃。
⑥使用自动分液仪,将200μl裂解液加入细胞培养板中。
⑦将细胞培养板置于移液工作站的低温模块上,重悬细胞悬液。
⑧从储板站中取出超声操作板,置于移液工作站的低温模块上。将细胞培养板中所有悬液,转至超声操作板。
⑨将超声操作板放在4℃振荡低温保存箱内。
⑩离线(手动)操作[7]:手动操作取出超声操作板放在冰盒上,并手动封上膜,置于超声破碎仪上进行超声操作,超声完成后在低温下以1 000 r/min转速离心1 min,手动撕去膜。
 从4℃振荡低温保存箱中取出超声操作板,以4 600g的离心力,离心5 min。
从4℃振荡低温保存箱中取出超声操作板,以4 600g的离心力,离心5 min。
 将超声操作板置于移液工作站的低温模块上,从4℃振荡低温保存箱中取出大肠杆菌表达产物板,放在移液工作站的低温模块上。将超声操作板的上清液全部吸出至大肠杆菌表达产物板。
将超声操作板置于移液工作站的低温模块上,从4℃振荡低温保存箱中取出大肠杆菌表达产物板,放在移液工作站的低温模块上。将超声操作板的上清液全部吸出至大肠杆菌表达产物板。
 将大肠杆菌表达产物板,放回4℃振荡低温保存箱中。
将大肠杆菌表达产物板,放回4℃振荡低温保存箱中。
2.4.2.3 测试方法和结果
用微生物高通量筛选系统,将待表达克隆挑取至96孔深孔板,过夜培养后,使用高通量自动化原核细胞表达系统进行转接、培养、OD值检测、诱导表达和培养。根据上述自动化实验流程,使用专业的自动化控制软件系统进行图形化实验编程(参见“下载图2-5abc 高通量自动化大肠杆菌表达程序”,下载网址见31页脚注),并按照顺序开展相应的生物样品实验。
采用高通量自动化蛋白质纯化系统,对原核细胞表达系统产生的菌体进行蛋白质抽提,以验证原核表达效果,蛋白质电泳结果如图2-15。由此可见,本系统能成功进行高通量原核细胞的小量蛋白质表达,以及蛋白质可溶性筛选。
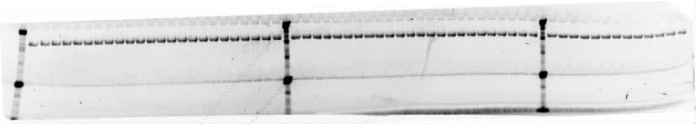
图2-15 高通量自动化蛋白质纯化系统的蛋白质电泳图
2.4.3 昆虫细胞表达系统
昆虫细胞表达系统是一种广泛使用的真核细胞表达系统。与原核细胞表达系统相比,昆虫细胞表达系统的最大优点是,外源蛋白质可进行真核的翻译后修饰,使蛋白质的表达量与可溶性得到改善。目前,昆虫细胞的大规模悬浮培养技术已较为成熟,广泛应用于科研和生产等领域。相比于原核细胞表达系统,昆虫细胞对设备的要求相对较高,其培养和传代等基本操作要求严格的无菌环境,须在恒温无菌室和生物安全柜中进行。
本系统引入自动化机械臂完成病毒扩增、昆虫细胞感染以及荧光定量PCR鉴定等操作。为提高细胞表达的通量,并且适用于自动化仪器的处理,使用6孔板进行昆虫细胞培养和病毒扩增。首先,科技人员将规模化克隆和蛋白质可溶性筛选模块产生的重组杆状病毒质粒(bacμlovirus plasmid,bacmid)转染进入昆虫细胞,病毒生成后自动完成滴度(titer)测定及病毒浓缩收集。用收集的病毒感染昆虫细胞以表达蛋白质,自动化地进行细胞培养,使蛋白质得以充分表达,之后进行细胞破碎离心,取裂解上清液,进入大规模蛋白质纯化模块。同时,这套系统还兼有病毒扩增的功能。昆虫细胞表达系统的设计流程见图2-16。
自动化液体处理设备是系统的核心运行部分,执行各种复杂的移液任务,如qPCR[8]反应体系构建、病毒感染等工作。自动化细胞培养及恒温孵育的设备,能够完成细胞培养、反应孵育等实验任务。自动化离心机进行病毒的收集。自动化实验室耗材供给设备作为整个模块的资源供应核心,自动将指定的板来往运输于存储架和工作站台面的指定板位(图2-17、图2-18)。同时,配套辅助设备还有荧光定量PCR仪、培养摇床、生物安全柜、倒置显微镜、培养箱、细胞计数仪等。
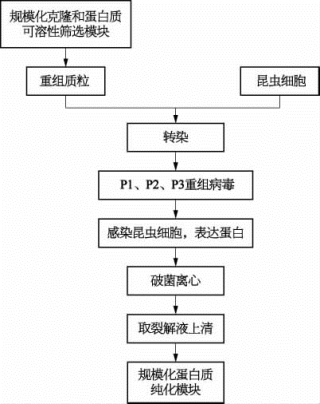
图2-16 昆虫细胞表达系统设计流程图

图2-17 高通量自动化昆虫细胞表达系统设计平面图

图2-18 高通量自动化昆虫细胞表达系统立体效果图
2.4.3.1 安装和调试
设施科技人员与厂家工程师紧密合作,通过严格的FAT及SAT验收流程,并经仔细严谨的调试,顺利完成了高通量自动化昆虫细胞表达系统的安装调试(图2-19)。

图2-19 真核细胞表达系统(昆虫细胞)安装调试
2.4.3.2 昆虫细胞表达系统的实验流程
1.转染和P1病毒产生
①使用自动分液仪在6孔板里加入2 ml昆虫细胞液。
②将6孔板置于27℃的振荡培养箱培养1 h。
③培养完成后,将6孔板中的培养基全部吸出丢弃。
④从储板站中取出昆虫培养基储液槽,吸取2.5 ml培养基加入6孔板。
⑤从昆虫培养基储液槽中,吸取100μl培养基到96孔转染脂质体反应板。
⑥从储板站中取出装有转染脂质体的96孔板,吸取5μl转染脂质体到96孔转染脂质体反应板。
⑦将96孔转染脂质体反应板以1 000 r/min转速并在常温下离心1 min。
⑧在室温下把96孔转染脂质体反应板静置5 min。
⑨从昆虫转染脂质体培养基储液槽中,吸取100μl培养基到96孔杆状病毒(bacμlovirus)反应板。
⑩从储板站中取出杆状病毒DNA样本管到移液工作站上,吸取1μl杆状病毒DNA到96孔杆状病毒反应板,并充分混合杆状病毒DNA和培养基。
 将96孔杆状病毒反应板以1 000 r/min转速并在常温下离心1 min。
将96孔杆状病毒反应板以1 000 r/min转速并在常温下离心1 min。
 离心后,将96孔杆状病毒反应板的溶液全部吸取至96孔转染脂质体反应板,并充分混合。
离心后,将96孔杆状病毒反应板的溶液全部吸取至96孔转染脂质体反应板,并充分混合。
 将96孔转染脂质体反应板以1 000 r/min转速并在常温下离心1 min。
将96孔转染脂质体反应板以1 000 r/min转速并在常温下离心1 min。
 在室温下把96孔转染脂质体反应板静置30 min。
在室温下把96孔转染脂质体反应板静置30 min。
 将96孔转染脂质体反应板的溶液,全部加入6孔板中,并充分混合。
将96孔转染脂质体反应板的溶液,全部加入6孔板中,并充分混合。
 将6孔板封上透气膜,并放入27℃的振荡培养箱中,培养3~5 h。
将6孔板封上透气膜,并放入27℃的振荡培养箱中,培养3~5 h。
 手动操作撕去6孔板的透气膜。
手动操作撕去6孔板的透气膜。
 将6孔板中所有培养基全部吸出丢弃。
将6孔板中所有培养基全部吸出丢弃。
 从储板站中取出装有完全生长培养基的储液槽,吸取2 ml培养基到6孔板中。
从储板站中取出装有完全生长培养基的储液槽,吸取2 ml培养基到6孔板中。
 将6孔板封上透气膜,并放入27℃的振荡培养箱中,培养72 h。
将6孔板封上透气膜,并放入27℃的振荡培养箱中,培养72 h。
 重悬6孔板的昆虫细胞液,将所有的培养基转至24孔P1收集板。
重悬6孔板的昆虫细胞液,将所有的培养基转至24孔P1收集板。
 将24孔P1收集板在常温下以2 000g的离心力,离心5 min。
将24孔P1收集板在常温下以2 000g的离心力,离心5 min。
2.P2病毒产生
①从储板站中取出24孔P2板,使用自动分液仪在24孔P2板里加入47.5 ml昆虫细胞液。
②从24孔P1收集板中吸取250μl上清液至24孔P2板。
③将24孔P2板封上透气膜,并放入27℃振荡培养箱中,以300 r/min转速,振荡培养96 h。
④将24孔P2板以2 000g的离心力并在常温下离心5 min。
3.P3病毒产生
①从储板站中取出24孔P3板,使用自动分液仪在24孔P3板里加入4.75 ml昆虫细胞液。
②从24孔P2板中吸取100μl上清液至24孔P3板。
③将24孔P3板封上透气膜,并放入27℃的振荡培养箱中,以300 r/min转速,振荡培养96 h。
④将24孔P3板在常温下以2 000g的离心力,离心5 min。
⑤从储板站中取出24孔P2收集板,将24孔P3板中的所有液体,转至24孔P2收集板。
4.qPCR前准备
①从24孔P2收集板中吸取500μl杆状病毒DNA至96孔苯酚提取板。
②从苯酚储液槽中吸取500μl至96孔苯酚提取板,并充分混匀至形成乳液状。
③将96孔苯酚提取板在4℃下以4 600g的离心力,离心5 min。
④离心后,将96孔苯酚提取板的上层水溶液,转移至96孔提取收集板。
⑤从TE[9]溶液储液槽中吸取250μl至96孔苯酚提取板,充分混匀至形成乳液状。
⑥将96孔苯酚提取板在4℃下以4 600g的离心力,离心5 min。
⑦离心后,将96孔苯酚提取板的上层水溶液,转移至96孔提取收集板。
⑧从苯酚-氯仿-IAA[10]溶液储液槽中,吸取700μl至96孔提取收集板,充分混匀至形成乳液状。
⑨将96孔提取收集板在4℃下以4 600g的离心力,离心5 min。
 离心后,将96孔提取收集板的上层水溶液,转移至96孔苯酚-氯仿-IAA收集板。
离心后,将96孔提取收集板的上层水溶液,转移至96孔苯酚-氯仿-IAA收集板。
 从氯仿-IAA溶液储液槽中,吸取700μl至96孔苯酚-氯仿-IAA收集板,充分混匀至形成乳液状。
从氯仿-IAA溶液储液槽中,吸取700μl至96孔苯酚-氯仿-IAA收集板,充分混匀至形成乳液状。
 将96孔苯酚-氯仿-IAA收集板,在4℃下以4 600g的离心力,离心5 min。
将96孔苯酚-氯仿-IAA收集板,在4℃下以4 600g的离心力,离心5 min。
 离心后,将96孔苯酚-氯仿-IAA收集板的上层水溶液,转移至96孔氯仿-IAA收集板。
离心后,将96孔苯酚-氯仿-IAA收集板的上层水溶液,转移至96孔氯仿-IAA收集板。
 从预先低温处理的95%乙醇储液槽中,吸取1.4 ml至96孔氯仿-IAA收集板。
从预先低温处理的95%乙醇储液槽中,吸取1.4 ml至96孔氯仿-IAA收集板。
 从3 mol/L pH 5.2乙酸钠储液槽中,吸取70μl至96孔氯仿-IAA收集板,并充分混合。
从3 mol/L pH 5.2乙酸钠储液槽中,吸取70μl至96孔氯仿-IAA收集板,并充分混合。
 将96孔氯仿-IAA收集板,在4℃下放置30 min。
将96孔氯仿-IAA收集板,在4℃下放置30 min。
 将96孔氯仿-IAA收集板,在4℃下以4 600g的离心力,离心10 min。
将96孔氯仿-IAA收集板,在4℃下以4 600g的离心力,离心10 min。
 将96孔氯仿-IAA收集板的上清液,全部吸取至废液槽。
将96孔氯仿-IAA收集板的上清液,全部吸取至废液槽。
 从预先低温处理的95%乙醇储液槽中,吸取200μl至96孔氯仿-IAA收集板。
从预先低温处理的95%乙醇储液槽中,吸取200μl至96孔氯仿-IAA收集板。
 将96孔氯仿-IAA收集板,在4℃下以4 600g的离心力,离心10 min。
将96孔氯仿-IAA收集板,在4℃下以4 600g的离心力,离心10 min。
 将96孔氯仿-IAA收集板的上清液,全部吸取至废液槽。
将96孔氯仿-IAA收集板的上清液,全部吸取至废液槽。
 将步骤
将步骤 —
— 重复操作2次。
重复操作2次。
 将96孔氯仿-IAA收集板,在室温下静置30 min。(https://www.xing528.com)
将96孔氯仿-IAA收集板,在室温下静置30 min。(https://www.xing528.com)
 从TE溶液储液槽中,吸取50μl至96孔氯仿-IAA收集板,并充分混匀。
从TE溶液储液槽中,吸取50μl至96孔氯仿-IAA收集板,并充分混匀。
 从96孔PCR工作液(4℃)管中,吸取5μl至qPCR反应板。
从96孔PCR工作液(4℃)管中,吸取5μl至qPCR反应板。
 从96孔氯仿-IAA收集板,吸取3μl DNA溶液至qPCR反应板,并充分混匀。
从96孔氯仿-IAA收集板,吸取3μl DNA溶液至qPCR反应板,并充分混匀。
 使用灵活8通道,按照预设的表格依次加入1μl引物至qPCR反应板。
使用灵活8通道,按照预设的表格依次加入1μl引物至qPCR反应板。
 将qPCR反应板在常温下以1 000 r/min转速离心1 min。
将qPCR反应板在常温下以1 000 r/min转速离心1 min。
 将qPCR反应板离线手动操作封膜,并放入qPCR仪中进行qPCR实验。
将qPCR反应板离线手动操作封膜,并放入qPCR仪中进行qPCR实验。
5.细胞表达
①使用自动分液仪,将3 ml昆虫细胞加入24孔细胞表达板。
②使用灵活8通道,从24孔P2收集板吸取相应的液体至24孔细胞表达板。
③将24孔细胞表达板封上透气膜并离线培养。培养条件为,在27℃且湿度可控的培养箱中,以300 r/min转速,培养72 h。
④将24孔细胞表达板,在常温下以4 000g的离心力,离心5 min。
⑤将24孔细胞表达板的全部上清液,转移至废液槽,并将24孔细胞表达板置于移液工作站的低温模块上。
⑥从裂解液储液槽中,吸取200μl至24孔细胞表达板,并充分混匀。
⑦离线(手动)操作:将24孔细胞表达板封上膜,并放入微孔板超声破碎仪中,进行超声破碎。
⑧将24孔细胞表达板,在常温下以6 000g的离心力,离心30 min。
⑨将24孔细胞表达板的上清液,吸取至96孔上清液PCR板。将24孔细胞表达板,置于移液工作站的低温模块上。
2.4.3.3 测试方法和结果
1.测试方法
自动化昆虫细胞蛋白质表达,采用Bac-to-Bac杆状病毒表达系统[11][7]。它利用高通量的自动化操作,向昆虫细胞系SF9转染带有外源目标蛋白质基因的杆状病毒质粒,以产生病毒。经逐级扩增后,再用病毒感染细胞系SF9或High5来生产目标蛋白质。
(1)向昆虫细胞系SF9,转染带有外源目标蛋白质基因的杆状病毒质粒,培养4~5 d以获得P1病毒
利用碱裂解及异丙醇沉淀法,获得转染级的外源目标蛋白质基因杆状病毒质粒。利用昆虫细胞培养基(非动物源),培养昆虫细胞系SF9,使其达到对数生长,细胞存活率在95%以上。利用高通量自动化系统,使用转染试剂(如CellFectin),将杆状病毒质粒转染到SF9,培养5 h后换新鲜的昆虫细胞培养基(非动物源),继续培养4~5 d以获得P1病毒。
(2)P1病毒逐级感染SF9细胞,以获得P2及P3病毒;利用荧光定量PCR方法,检测P3病毒滴度
利用高通量自动化系统收集P1病毒上清液,按照1﹕20的比例,重新感染SF9细胞,继续培养4~5 d以获得P2病毒;再利用相同的方法获得P3病毒。取20μl病毒,利用磁珠法提取DNA,随后利用荧光定量PCR进行绝对定量分析,绘制标准曲线,以检测P3病毒滴度。
(3)利用P3病毒感染SF9细胞,进行蛋白质的表达
利用高通量自动化系统,将处于对数生长、存活率在95%以上的SF9细胞,种入24孔深孔板。根据病毒滴度,加入合适量的病毒,使感染复数(multiplicity of infection,MOI)=10。继续培养2~3 d后,收集细胞,裂解后利用高通量自动化蛋白质纯化系统,提取目标蛋白质。
2.测试结果
(1)P1病毒获取
根据上述自动化实验流程,使用专业的自动化控制软件系统进行图形化实验编程,并按顺序开展相应的生物样本实验(参见“下载图2-6 高通量昆虫细胞表达程序—转染和P1病毒产生”,下载网址见31页脚注)。
高通量自动化流程运行完整的程序需要8 h,可以同时转染96个不同的杆状病毒质粒。
(2)P3病毒获取
使用专业的自动化控制软件系统进行图形化实验编程,并使用生物样本产生P3病毒(参见“下载图2-7 高通量昆虫细胞表达程序—P2病毒产生”“下载图2-8 高通量昆虫细胞表达程序—P3病毒产生”,下载网址见31页脚注)。
(3)P3病毒滴度测定
将标准品稀释至不同浓度,作为模板进行PCR反应。以标准品拷贝数的对数值为横坐标,以测得的C t值[12]为纵坐标,绘制标准曲线。对未知样品进行定量时,根据未知样品的C t值,即可在标准曲线中得到样品的拷贝数。得到P3病毒的滴度约为3×108,具体结果如图2-20所示。
(4)昆虫细胞表达蛋白
将昆虫细胞裂解后纯化目标蛋白质样品,利用高通量蛋白质电泳鉴定的结果如图2-21。
采用高通量自动化昆虫细胞表达系统进行自动化昆虫细胞蛋白质表达时,可以同时表达96种不同的蛋白质。其中转染过程需8 h,随后需4~5 d产生P1病毒;利用P1病毒重新感染SF9细胞以获得P2和P3病毒,需8~10 d;利用P3病毒感染SF9或High5细胞以表达蛋白质,需2~3 d;全程实验流程至少需18~20 d。
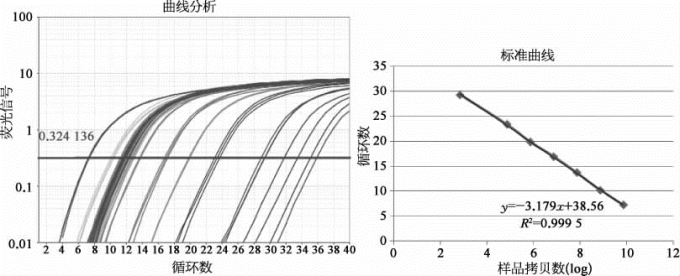
图2-20 实时荧光定量PCR数据的扩增曲线分析和标准曲线(彩图见图版第1页)

图2-21 高通量自动化昆虫细胞蛋白质表达的纯化电泳图
当满足测试所需的保障条件时,高通量自动化昆虫细胞表达系统的各项基本指标均已满足要求,可以制备滴度约为108数量级的P3病毒,并且可以成功地感染宿主细胞,以得到目标蛋白质的表达。该系统达到了预期的相关设备工艺验收指标要求。而且相对于手动实验来说,采用高通量自动化系统大大提高了实验效率和成功率,降低了由于人为错误造成实验的不可重复性,实现了高通量、低错误率的外源蛋白质表达。
2.4.4 哺乳动物细胞表达系统
哺乳动物细胞表达系统可以进行分泌型和非分泌型蛋白质的表达,其产生的目标蛋白质具有天然立体结构,翻译后修饰方式与人体内源表达的蛋白质完全一致;但是该表达系统的目标蛋白质,表达量低、培养成本较高。将外源基因导入哺乳动物细胞,主要有2种方法:一是以感染性病毒颗粒感染宿主细胞,二是通过脂质体法、显微注射法、磷酸钙共沉淀法及DEAE[13]葡聚糖法等非病毒载体的方式,将基因导入细胞中。
腺病毒法哺乳动物细胞表达之相关设备,与昆虫细胞表达系统的设备类似;而针对脂质体法哺乳动物细胞表达,科技人员设计了整套高通量自动化哺乳动物细胞表达系统(图2-22、图2-23),包括质粒转染、挑取克隆、扩大培养、保种等步骤。同时,配套辅助设备有高通量哺乳动物细胞克隆自动挑选仪、生物安全柜、培养摇床、倒置显微镜、细胞计数仪、CO 2培养箱等。腺病毒法哺乳动物细胞表达的设备和昆虫细胞表达的设备类似。脂质体法哺乳动物细胞表达系统的设计流程如图2-24所示。
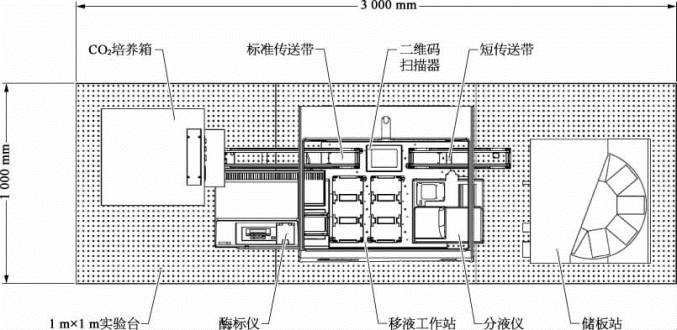
图2-22 高通量自动化哺乳动物细胞表达系统设计平面图
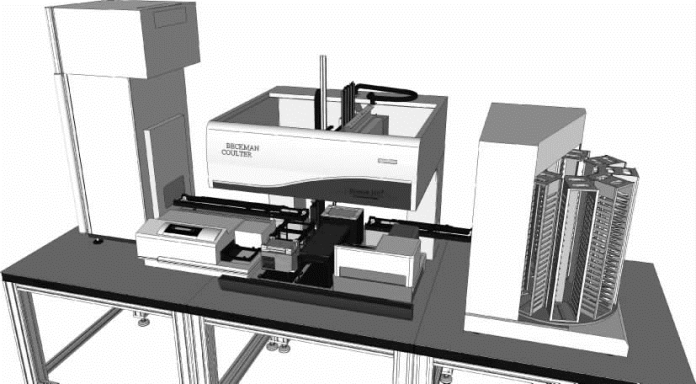
图2-23 高通量自动化哺乳动物细胞表达系统立体效果图

图2-24 哺乳动物细胞表达系统设计流程图
自动化的哺乳动物细胞蛋白质表达,采用悬浮293瞬转系统,通过自动化操作,向悬浮293细胞系转染带有外源目标蛋白质基因的质粒,来生产目标蛋白质。采用高通量自动化哺乳动物细胞表达系统进行自动化哺乳动物细胞蛋白质表达时,1个批次可以同时表达96种不同的蛋白质,也可以对同一种蛋白质使用96种不同的表达条件进行表达筛选,或者对多种蛋白质和多种表达条件组合进行表达筛选,以快速确定目标蛋白质的表达情况。其中转染过程需6~8 h,随后需2~3 d积累蛋白质;后续的蛋白质抽提和检测需1 d,实验全程需4~5 d。
2.4.4.1 安装和调试
设施科技人员与生产厂家工程师紧密合作,通过严格的FAT及SAT验收流程,并经仔细严谨的调试,顺利完成了高通量自动化哺乳动物细胞表达系统的安装调试(图2-25)。
2.4.4.2 实验流程
①离线操作:将50 ml离心管中的哺乳动物细胞离心,去掉上清液,进行细胞计数并计算浓度。加入10 ml培养基到50 ml离心管,轻轻混匀,然后分装100μl哺乳动物细胞至96孔细胞板。将96孔脂质体和培养基板、96孔质粒板在常温下以1 000 r/min转速离心1 min,并将96孔质粒板开盖。
②从储板站中取出96孔细胞板、96孔质粒和脂质体反应板、96孔脂质体和培养基板、96孔质粒板。

图2-25 高通量自动化哺乳动物细胞表达系统安装调试
③在二维码扫描器上读取96孔质粒板的二维码信息,然后放在移液工作站的低温模块上,将96孔质粒和脂质体反应板以及96孔脂质体和培养基板放在移液工作站上。
④从96孔脂质体和培养基板(第4列)中吸取50μl OptiMEM培养基至96孔质粒和脂质体反应板。
⑤从96孔质粒板中吸取6μl(约0.64μg)质粒,至96孔质粒和脂质体反应板,并充分混匀。
⑥从96孔脂质体和培养基板(第3列)中吸取600μl Opti MEM培养基至自己的第2列。从96孔脂质体和培养基板(第1列)中吸取12μl Opti MEM培养基至自己的第2列,充分混匀,并在室温下静置5 min。
⑦从96孔脂质体和培养基板(第2列)中吸取51μl培养基和脂质体至96孔质粒和脂质体反应板,并轻轻混匀,在室温下静置20 min,以促使DNA-脂质体形成配合。
⑧将所有的转染培养基从96孔质粒和脂质体反应板吸取至96孔细胞板,并轻轻混匀。
⑨将96孔细胞板加盖,并置于37℃的CO 2培养箱中,静置培养5~6 h。
⑩离线手动操作:将96孔细胞板在常温下以1 000 r/min转速离心1 min。
 将96孔细胞板去盖,并移除上清液至废液槽。
将96孔细胞板去盖,并移除上清液至废液槽。
 使用自动分液仪,加入100μl培养基至96孔细胞板,轻轻混匀。
使用自动分液仪,加入100μl培养基至96孔细胞板,轻轻混匀。
 将96孔细胞板加盖,并置于37℃的CO 2培养箱中,静置培养20 h。
将96孔细胞板加盖,并置于37℃的CO 2培养箱中,静置培养20 h。
 从储板站中取出96孔抗生素板,放在移液工作站上。
从储板站中取出96孔抗生素板,放在移液工作站上。
 将96孔细胞板去盖,从96孔抗生素板中吸取2~6μl抗生素至96孔细胞板。
将96孔细胞板去盖,从96孔抗生素板中吸取2~6μl抗生素至96孔细胞板。
 将96孔细胞板加盖,并置于37℃的CO 2培养箱中,静置培养20 h。
将96孔细胞板加盖,并置于37℃的CO 2培养箱中,静置培养20 h。
 离线手动操作:将4 ml半固体培养基加入6孔板(共16块),从96孔细胞板中吸取100μl至6孔板(共16块),轻轻混匀。
离线手动操作:将4 ml半固体培养基加入6孔板(共16块),从96孔细胞板中吸取100μl至6孔板(共16块),轻轻混匀。
 离线手动操作:将6孔板(共16块)加盖,并置于37℃的CO 2培养箱中,静置培养9~12 d。
离线手动操作:将6孔板(共16块)加盖,并置于37℃的CO 2培养箱中,静置培养9~12 d。
 离线手动操作:将6孔板(共16块)去盖,使用手动移液器分液200μl培养基至96孔板(共8块),运行高效细胞克隆筛选系统,并挑取荧光表达量最高的8个单克隆至96孔板(共8块)。
离线手动操作:将6孔板(共16块)去盖,使用手动移液器分液200μl培养基至96孔板(共8块),运行高效细胞克隆筛选系统,并挑取荧光表达量最高的8个单克隆至96孔板(共8块)。
 从储板站中取出上一步操作中荧光表达量最高的8块96孔板。
从储板站中取出上一步操作中荧光表达量最高的8块96孔板。
 将96孔板(共8块)加盖,并在37℃的CO 2培养箱中,静置培养24 h。
将96孔板(共8块)加盖,并在37℃的CO 2培养箱中,静置培养24 h。
 将96孔板(共8块)去盖,并在酶标仪上自动读取荧光值。
将96孔板(共8块)去盖,并在酶标仪上自动读取荧光值。
 从储板站中取出24孔表达细胞板(共12块)。
从储板站中取出24孔表达细胞板(共12块)。
 将24孔表达细胞板去盖,并使用自动分液仪,加入500μl培养基。
将24孔表达细胞板去盖,并使用自动分液仪,加入500μl培养基。
 使用灵活8通道,从96孔板(共8块)的8个重复孔中挑取3个荧光值最高的细胞,加入24孔板(共12块)。
使用灵活8通道,从96孔板(共8块)的8个重复孔中挑取3个荧光值最高的细胞,加入24孔板(共12块)。
 将24孔表达细胞板加盖,并放在37℃的CO 2培养箱中,静置培养24 h。
将24孔表达细胞板加盖,并放在37℃的CO 2培养箱中,静置培养24 h。
 从储板站中取出384孔检测板。
从储板站中取出384孔检测板。
 将24孔表达细胞板去盖,并吸取40μl培养基至384孔检测板,在酶标仪上检测荧光值。
将24孔表达细胞板去盖,并吸取40μl培养基至384孔检测板,在酶标仪上检测荧光值。
 从储板站中取出6孔细胞培养板和384孔培养检测板。
从储板站中取出6孔细胞培养板和384孔培养检测板。
 将6孔细胞培养板去盖,并使用自动分液仪加入2 000μl培养基(共≤48块)。
将6孔细胞培养板去盖,并使用自动分液仪加入2 000μl培养基(共≤48块)。
 从24孔表达细胞板中挑取2~3个荧光值最高的细胞至6孔细胞培养板(共≤48块)。
从24孔表达细胞板中挑取2~3个荧光值最高的细胞至6孔细胞培养板(共≤48块)。
 将6孔细胞培养板加盖,并放在37℃的CO 2培养箱中,静置培养24 h。
将6孔细胞培养板加盖,并放在37℃的CO 2培养箱中,静置培养24 h。
 将6孔细胞培养板去盖,并吸取40μl培养基至384孔检测板,在酶标仪上检测荧光值。
将6孔细胞培养板去盖,并吸取40μl培养基至384孔检测板,在酶标仪上检测荧光值。
 从6孔细胞培养板中,吸取1 000μl至96孔挑取表达板1—3。
从6孔细胞培养板中,吸取1 000μl至96孔挑取表达板1—3。
 将6孔细胞培养板继续置于CO 2培养箱中静置培养。
将6孔细胞培养板继续置于CO 2培养箱中静置培养。
 离线手动操作:将96孔挑取表达板1—3封膜,并在4℃下以4 000 r/min转速离心5 min,将上清液丢弃,并用4℃预冷的裂解液重悬细胞。
离线手动操作:将96孔挑取表达板1—3封膜,并在4℃下以4 000 r/min转速离心5 min,将上清液丢弃,并用4℃预冷的裂解液重悬细胞。
 离线(手动)操作:在4℃条件下,将96孔挑取表达板1—3的上清液,转移至96孔PCR板1—3。
离线(手动)操作:在4℃条件下,将96孔挑取表达板1—3的上清液,转移至96孔PCR板1—3。
 将96孔PCR板1—3封膜,并置于微孔板超声破碎仪上进行超声破碎。
将96孔PCR板1—3封膜,并置于微孔板超声破碎仪上进行超声破碎。
 将96孔PCR板1—3在4℃下以1 000 r/min转速离心1 min,移去封膜。在4℃条件下,转移悬液至新96孔板1—3内。
将96孔PCR板1—3在4℃下以1 000 r/min转速离心1 min,移去封膜。在4℃条件下,转移悬液至新96孔板1—3内。
 根据预纯化结果,从6孔细胞培养板中吸取4 000 ml培养液至T75培养瓶中。
根据预纯化结果,从6孔细胞培养板中吸取4 000 ml培养液至T75培养瓶中。
2.4.4.3 测试方法
准备生长状态良好的悬浮293细胞,密度在(1~5)×106个细胞/ml,存活率在95%以上,手动操作离心去除上清液(常温下以800 r/min转速离心4 min),用无双抗[14]、无血清的培养基(如DMEM)重悬细胞,使细胞密度调整为2×106个细胞/ml。然后采用下述方法进行细胞表达和鉴定。
①利用高通量自动化哺乳动物细胞表达系统,将准备好的悬浮293细胞分装到8块24深孔板中,每个孔5 ml。
②使用移液工作站,将质粒DNA按5μg/孔的计算量,加入96深孔板中。吸取1 ml无双抗、无血清的培养基,加入96深孔板中,充分混匀后加入15μl转染试剂(如PEI)至96深孔板,并立即混匀,混匀后在室温下静置20 min。共准备2块96深孔板。
③静置后,将上述溶液全部加入放有细胞的24深孔板中,然后振荡培养4~6 h。
④手动操作离心并弃去上清液(常温下以800 r/min转速离心4 min),然后使用表达培养基重悬CHO细胞[15],并在CO 2培养箱中振荡培养48~72 h。
⑤细胞培养后将细胞裂解离心,在高通量自动化蛋白质纯化系统上进行蛋白质收集纯化。然后使用高通量蛋白质电泳仪检测蛋白质表达情况。
2.4.4.4 测试结果
根据上述自动化实验流程,科技人员使用专业的自动化控制软件系统,进行图形化实验编程(参见“下载图29 高通量哺乳动物细胞表达程序”,下载网址见31页脚注),并使用生物样本进行测试。裂解细胞后纯化目标蛋白质样品,通过高通量蛋白质电泳仪进行SDS PAGE胶(聚丙烯酰胺凝胶电泳)鉴定,蛋白质电泳结果如图226所示。

图2-26 高通量自动化哺乳动物细胞表达蛋白质的纯化电泳图
采用高通量自动化哺乳动物细胞表达系统进行哺乳动物细胞蛋白质表达时,可以高效表达不同的蛋白质,或进行表达载体的筛选及组合筛选,成功获得微克级的蛋白质表达,为放大实验确定条件。
自动化哺乳动物细胞表达系统的各项基本指标均满足要求,可以成功感染宿主细胞而得到目标蛋白质,达到预期的相关工艺验收指标要求。相对于手动实验来说,自动化哺乳动物细胞表达系统大大提高了实验通量,使大规模的蛋白质筛选制备成为可能,同时也提高了实验的效率,降低了因人为错误而造成实验的不可重复性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




