2.3.1 技术方案
随着大规模基因组测序技术的进步,各个物种的基因测序工作相继完成,对基因及其编码的蛋白质产物的结构与功能研究,也已经成为当今生命科学中的热点。基因大规模克隆和蛋白质表达的需求,给后基因组学时代的研究带来了巨大挑战,这就更需要对有利于高通量和自动化的方法予以技术支持。不少较新的技术,如蛋白质在细胞内的过量表达、异源表达以及蛋白质定位分析等,均需要将全长或部分基因亚克隆[1]到载体中,如果采用传统的构建方法,不仅操作烦琐,而且会耗费大量的时间和资金。高通量、自动化的克隆构建系统,具有操作方便、适用于不同大小目标片段的克隆、保真度高和费用低等特点,完全能够满足上海设施在蛋白质样品制备方面的巨大需求。
随着全实验室自动化技术的发展与革新,将功能独立的仪器按照实验步骤串联或并联起来,构成流水线作业的组合,形成大规模的全自动化生产流程,这已成为一种国际趋势[2]。为了实现实验室的规范化和标准化管理,我们引入轨道式机械臂,提高了整个流程的全自动化生产工艺水平和数据跟踪管理能力,充分发挥了条码技术和实验室信息系统的优势,减少了人工操作环节,并提高了结果的准确性和稳定性,提高了工作效率和管理水平。通过这些机器与高通量自动化克隆构建系统的有机整合,实现了全自动化无人值守操作,极大提高了系统的生产效率,并保障了样品信息的跟踪管理。
规模化克隆和蛋白质可溶性筛选模块,能够自动化并且连续地完成PCR体系的建立及反应,质粒酶切、连接、转化和抽提,高通量地进行克隆构建。该模块主要由自动化液体处理设备、自动化细胞培养及恒温孵育设备、PCR处理及反应设备、实验耗材供给设备、低温存储设备、机器人控制管理设备及编程控制软件系统组成。各设备系统由一个或多个自动化仪器部件组成,可独立执行相应的功能,也可整合使用[3]。这套高通量自动化克隆构建系统的平面设计和立体效果如图2-3、图2-4所示,现对各设备系统分别作具体介绍如下。
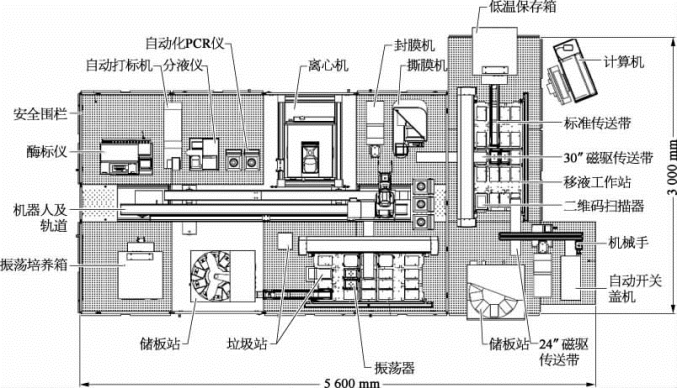
图2-3 高通量自动化克隆构建系统设计平面图
(1)自动化液体处理设备是平台的核心运行部分,它不仅能执行各种复杂的移液操作,还可完成一些特殊的实验任务,如二维管条码扫描、振荡混匀、孵育、柱吸附法的真空抽滤、磁珠分离等。主要配置包括:双机械臂;96通道加样器;8通道加样器;移板机械手;恒温孵育模块;振荡模块;自动灌冲式试剂槽;真空抽滤模块;磁分离模块。
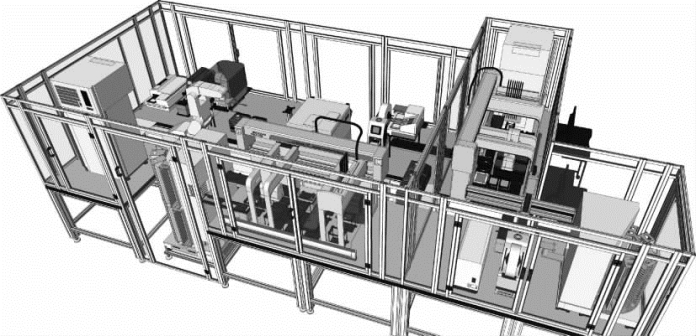
图2-4 高通量自动化克隆构建系统立体效果图
(2)自动化细胞培养及恒温孵育设备能够完成细胞的培养、反应孵育等实验任务。每块细胞培养板都由工业机器人传送到培养箱,细胞培养的程序由时序管理软件统一编辑和控制,并进行优化。
(3)本模块内整合了为结构基因组克隆构建研究而提供的自动化PCR处理设备。液体处理工作站完成PCR反应体系的构建。PCR板加盖密封后,由机器人运送至电动PCR仪中,自动进行PCR反应。
(4)实验室耗材供给设备是整个模块的资源供应核心。通过与工业机器人配合,在程序的控制下自动将指定的板来往运输于存储架和工作站台面的指定板位。
(5)机器人的控制和管理设备是一款工业级的延伸型机械手臂,可通过它在液体处理工作站两侧整合多台第三方设备。
规模化克隆和蛋白质可溶性筛选模块的设计流程为:首先,用PCR仪进行基因片段克隆,PCR得到的片段和所要用的载体都需要在37℃水浴中进行内切酶消化;然后,基因片段和载体连接(16℃水浴)好后转化(42℃水浴)到克隆用的大肠杆菌菌株中;转化后的菌液被涂布在有相应抗生素的平板上,平板一般在恒温培养箱(可调温度型)中培养过夜;第二天平板上会长出克隆,自动化挑取若干克隆,在小摇床中进行培养;构建成功的质粒经扩大培养后进行质粒抽提。主要流程可参考图2-5。
2.3.2 安装和调试
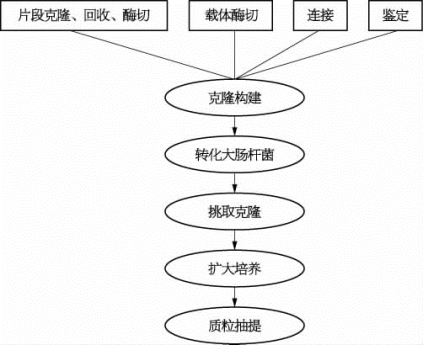
图2-5 规模化克隆和蛋白质可溶性筛选模块设计流程图
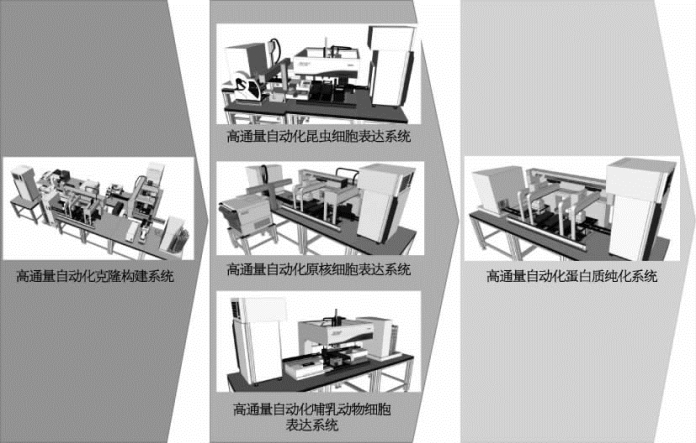
图2-6 自动化克隆表达系统构成图
根据基因克隆技术和蛋白质表达纯化的实验流程,设施科技人员对自动化产品和用户进行了深入细致的调研,并进行了严谨的流程分析和方案论证,自主设计了自动化克隆表达系统(图2-6)。此系统包括5套高通量自动化系统,即高通量自动化克隆构建系统、高通量自动化大肠杆菌表达系统、高通量自动化昆虫细胞表达系统、高通量自动化哺乳动物细胞表达系统和高通量自动化蛋白质纯化系统。2012年年底,上海设施经过多次论证评审,最终确定了5套高通量自动化系统的设计方案,并进行了公开招标。2013年9月,设施科技人员顺利完成了工厂验收试验(factory acceptance test,FAT),并根据仪器设备安装条件(空间、电力、通信、气压、UPS[2]布局、地面承重、散热装置、水质及用量等),完成实验室的规划和改造。2013年10月所有仪器设备到货,11月底完成所有仪器设备的安装并开始运行调试。2014年1月圆满完成现场验收试验(site acceptance test,SAT),同时对实验项目进行运行测试。高通量自动化克隆构建系统是规模化克隆和蛋白质可溶性筛选模块的核心部分。经仔细严谨的实验测试,科技人员顺利完成了高通量自动化克隆构建系统的安装调试(图2-7)。

图2-7 高通量自动化构建系统安装调试(彩图见图版第1页)
2.3.3 克隆构建系统实验流程
2.3.3.1 PCR前准备
①从4℃低温保存箱中取出二维码样本管(胶塞盖),在自动化离心机上以4℃1 000 r/min转速离心1 min。
②将二维码样本管放在二维码扫描器上,扫描读取样本管条码,然后在自动化开关盖机上自动打开胶塞盖,并将开盖后的样本管放置在移液工作站的低温模块上。
③从4℃低温保存箱中取出PCR引物母板,在自动化离心机上以4℃1 000 r/min转速离心1 min,然后放在移液工作站的低温模块上。
④从自动化储板站中取出PCR引物子板,放置在移液工作站的低温模块上。
⑤使用移液工作站的96通道移液头,从PCR引物母板中转移100μl引物至PCR引物子板,将引物子板封膜后放入4℃的低温保存箱中。
⑥从低温保存箱中取出放有PCR混合液的微孔板,在自动化离心机上以4℃1 000 r/min转速离心1 min,然后放在移液工作站的低温模块上。
⑦从自动化储板站中取出PCR反应板,并放置在移液工作站的低温模块上。
⑧从放有PCR混合液的微孔板中转移20μl PCR混合液至PCR反应板,丢弃PCR混合液的微孔板。
⑨使用灵活8通道从二维码样本管中吸取2μl模板DNA,加入PCR反应板。
⑩将二维码样本管盖上胶塞盖,并放回低温保存箱内。
 使用灵活8通道从PCR引物母板中吸取2μl引物,加入PCR反应板。
使用灵活8通道从PCR引物母板中吸取2μl引物,加入PCR反应板。
 将PCR引物母板封上膜,并放回低温保存箱内。
将PCR引物母板封上膜,并放回低温保存箱内。
 将PCR反应板在常温下以1 000 r/min转速离心1 min。
将PCR反应板在常温下以1 000 r/min转速离心1 min。
 将PCR反应板封上膜,并转移到PCR后区,放入电动PCR仪进行PCR反应。
将PCR反应板封上膜,并转移到PCR后区,放入电动PCR仪进行PCR反应。
2.3.3.2 PCR反应
运行电动PCR反应程序:

2.3.3.3 PCR产物纯化(磁珠法)
①将PCR反应板放在撕膜机上撕去膜,然后放在PCR后区的移液工作站上。
②从后区储板站中分别取出磁珠溶液板、洗脱液板、消化反应板、片段分析板,放在PCR后区的移液工作站上。
③使用移液工作站的96通道移液头,将磁珠溶液板反复混合重悬磁珠溶液后,吸取45μl磁珠溶液,加入PCR反应板。
④用96通道移液头充分混合磁珠溶液和PCR反应产物,然后在室温下静置5 min。
⑤将PCR反应板放在磁力架上,静置2 min以充分吸附磁珠。
⑥将PCR反应板的上清液吸取丢弃。
⑦从自动填充储液槽中吸取200μl 70%乙醇至PCR反应板,在室温下静置30 s。
⑧将PCR反应板的上清液吸取丢弃。
⑨将步骤⑦和⑧重复操作1次。
⑩将PCR反应板从磁力架上取下,从洗脱液板中吸取35μl洗脱液,加入PCR反应板,并多次混合。
 将PCR反应板放在磁力架上,静置1 min,以充分吸附磁珠。
将PCR反应板放在磁力架上,静置1 min,以充分吸附磁珠。
 从PCR反应板中吸取30μl纯化后的产物至消化反应板。
从PCR反应板中吸取30μl纯化后的产物至消化反应板。
 从PCR反应板中吸取1μl纯化后的产物至片段分析板。
从PCR反应板中吸取1μl纯化后的产物至片段分析板。
 将PCR反应板和片段分析板放回后区储板站,手动操作将片段分析板取出,置于基因片段分析仪(fragment analyzer)上,进行电泳分析。
将PCR反应板和片段分析板放回后区储板站,手动操作将片段分析板取出,置于基因片段分析仪(fragment analyzer)上,进行电泳分析。
2.3.3.4 消化目标基因
①从4℃低温保存箱中分别取出有限制性内切酶的微孔板和有缓冲液的微孔板,以1 000 r/min转速并在4℃下离心1 min,然后放置于PCR后区移液工作站的低温模块上。
②使用移液工作站的96通道移液头,从微孔板中吸取1μl限制性内切酶,加入消化反应板。
③从微孔板中吸取5μl缓冲液,加入消化反应板。
④从后区储板站中取出放有水的储液槽,吸取14μl水,放入消化反应板。
⑤将消化反应板加上盖子,以1 000 r/min转速并在常温下离心1 min。
⑥将消化反应板放入振荡培养箱中,在37℃下培养2 h。
⑦将放有限制性内切酶和缓冲液的微孔板,分别放到后区储板站上。
2.3.3.5 DNA产物纯化(磁珠法)
①将上述消化反应板取出并去盖。
②使用移液工作站的96通道移液头将磁珠溶液板反复混合重悬磁珠溶液后,吸取45μl磁珠溶液,加入消化反应板。
③用96通道充分混合磁珠溶液和DNA反应产物,然后在室温下静置5 min。
④将消化反应板放在磁力架上,静置2 min,以充分吸附磁珠。
⑤将消化反应板的上清液吸取丢弃。
⑥从自动填充储液槽中吸取200μl 70%乙醇至消化反应板,在室温下静置30 s。
⑦将消化反应板的上清液吸取丢弃。
⑧将步骤⑥和⑦重复操作1次。(https://www.xing528.com)
⑨将消化反应板从磁力架上取下,从洗脱液板中吸取50μl洗脱液,加入消化反应板并多次混合。
⑩将消化反应板放在磁力架上,静置1 min,以充分吸附磁珠。
 从后区储板站中取出DNA产物纯化板,并放置在后区的移液工作站的低温模块上。
从后区储板站中取出DNA产物纯化板,并放置在后区的移液工作站的低温模块上。
 从消化反应板中吸取50μl纯化后的产物至DNA产物纯化板。
从消化反应板中吸取50μl纯化后的产物至DNA产物纯化板。
 将磁珠溶液板、洗脱液板、消化反应板放回后区储板站。
将磁珠溶液板、洗脱液板、消化反应板放回后区储板站。
2.3.3.6 连接反应
①从后区储板站中取出连接反应板,并放在后区移液工作站上。
②从装有水的储液槽中吸取8μl水到连接反应板。
③从4℃低温保存箱中取出连接酶保存板,以1 000 r/min转速并在4℃下离心1 min,放在后区移液工作站的低温模块上。
④从连接酶保存板中吸取2μl连接酶到连接反应板中,将连接酶保存板放回4℃低温保存箱中。
⑤从4℃低温保存箱中取出载体板,以1 000 r/min转速并在4℃下离心1 min,在二维码扫描器上读取样本管二维码信息,移去胶塞盖,放在后区移液工作站的低温模块上。
⑥使用灵活8通道从载体板中吸取2μl载体,加入连接反应板,将载体板盖上胶塞盖,并保存于4℃的低温保存箱。
⑦使用灵活8通道从DNA产物纯化板吸取8μl加入连接反应板并反复混合,将DNA产物纯化板放回后区储板站。
⑧将连接反应板以1 000 r/min转速并在常温下离心1 min。
⑨将连接反应板放在电动PCR仪中,在16℃下反应1 h。
2.3.3.7 转化
①从4℃低温保存箱中取出感受态细胞板,以1 000 r/min转速并在常温下离心1 min,放在后区移液工作站的低温模块上。
②将连接反应板放回后区移液工作站的低温模块上。
③从后区储板站中取出细胞培养板,放在后区移液工作站上。
④从感受态细胞板中吸取100μl感受态细胞到连接反应板,在4℃下孵育30 min。
⑤将连接反应板放回电动PCR仪,在42℃下热激90 s。
⑥快速取出连接反应板并放到移液工作站的低温模块上,孵育5 min,移取所有的液体至细胞培养板。
⑦使用自动分液仪,将1 000μl培养基加入细胞培养板。
⑧将细胞培养板封上透气膜。
⑨将细胞培养板放入振荡培养箱中,在37℃下振荡培养1 h。
⑩振荡培养后,取出细胞培养板以1 000 r/min转速并在常温下离心5 min,在撕膜机上撕去透气膜,吸取上清液并丢弃。
 使用自动分液仪,将50μl培养基加入细胞培养板。
使用自动分液仪,将50μl培养基加入细胞培养板。
 充分混合后,将细胞培养板置于振荡培养箱中培养。
充分混合后,将细胞培养板置于振荡培养箱中培养。
 将装有水的储液槽、连接反应板、感受态细胞板放回后区储板站。
将装有水的储液槽、连接反应板、感受态细胞板放回后区储板站。
2.3.3.8 细胞涂布和挑取
①使用微生物克隆挑选系统,将细胞均匀涂布到QTray细胞培养板上。
②将QTray细胞培养板在37℃培养箱中静置培养16 h。
③使用微生物克隆挑选系统,挑取大肠杆菌单克隆至新的96孔细胞培养板。
2.3.3.9 单克隆培养
①从后区储板站中取出有单克隆的细胞培养板、抗生素板,并放在后区的移液工作站上。
②使用自动分液仪,将1 200μl培养基加入96孔细胞培养板。
③使用灵活8通道,从抗生素板吸取5μl抗生素到96孔细胞培养板。
④将96孔细胞培养板封上透气膜,在振荡培养箱中并在37℃下,以300 r/min转速培养16 h。
⑤将抗生素板放回后区储板站。
2.3.3.10 质粒抽提
①从后区储板站中取出96孔细胞培养板、质粒抽提板、RE1溶液板、L2溶液板、N3溶液板、PUR4溶液板、质粒样本板,放入后区的移液工作站上。
②将质粒样本板放在二维码扫描器上读取样本管条码信息。
③将96孔细胞培养板在自动化离心机上以2 500g[3]的离心力,离心10 min。
④离心后,将96孔细胞培养板在撕膜机上撕去膜,吸取上清液并丢弃。
⑤从RE1溶液板中吸取100μl到96孔细胞培养板,在振荡器上以1 200 r/min转速充分振荡重悬5 min。
⑥从L2溶液板中吸取100μl到96孔细胞培养板,在振荡器上以600 r/min转速充分振荡5 min。
⑦从N3溶液板中吸取100μl到96孔细胞培养板,在振荡器上以600 r/min转速充分振荡10 min。
⑧将96孔细胞培养板封上膜,在自动化离心机上以4 600g的离心力,离心20 min。
⑨取出96孔细胞培养板,在撕膜机上撕去膜。从96孔细胞培养板中吸取上清液至质粒抽提板。
⑩从PUR4溶液板中吸取90μl到质粒抽提板,在振荡器上以600 r/min转速充分振荡3 min。
 将质粒抽提板置于磁力架上15 min。
将质粒抽提板置于磁力架上15 min。
 吸取质粒抽提板的上清液并丢弃。
吸取质粒抽提板的上清液并丢弃。
 从自动填充储液槽中吸取200μl 70%乙醇至质粒抽提板,然后在室温下静置30 s。
从自动填充储液槽中吸取200μl 70%乙醇至质粒抽提板,然后在室温下静置30 s。
 将质粒抽提板的上清液吸取丢弃。
将质粒抽提板的上清液吸取丢弃。
 将步骤
将步骤 和
和 重复操作1次。
重复操作1次。
 将质粒抽提板在室温下静置,充分晾干,蒸发掉乙醇。
将质粒抽提板在室温下静置,充分晾干,蒸发掉乙醇。
 将质粒抽提板从磁力架上取下,加入40μl洗脱溶液并多次混合,在37℃下静置5 min,然后以1 200 r/min转速,振荡5 min。
将质粒抽提板从磁力架上取下,加入40μl洗脱溶液并多次混合,在37℃下静置5 min,然后以1 200 r/min转速,振荡5 min。
 将质粒抽提板放在磁力架上,静置1 min以充分吸附磁珠。
将质粒抽提板放在磁力架上,静置1 min以充分吸附磁珠。
 将质粒抽提板中产物全部吸出至质粒样本板。
将质粒抽提板中产物全部吸出至质粒样本板。
 将细胞培养板、质粒抽提板、RE1溶液板、L2溶液板、N3溶液板、PUR4溶液板、质粒样本板放回后区储板站。
将细胞培养板、质粒抽提板、RE1溶液板、L2溶液板、N3溶液板、PUR4溶液板、质粒样本板放回后区储板站。
2.3.4 测试方法和结果
根据上述自动化实验流程,使用专业的自动化控制软件系统进行图形化实验编程(参见“下载图2-1 高通量自动化PCR程序”“下载图2-2 高通量PCR产物纯化及重组转化程序”“下载图2-3 高通量质粒抽提程序”“下载图2-4 蛋白质可溶性筛选程序”[4]),分别进行生物样本的高通量PCR实验、重组质粒抽提测试。测试情况如下。
①在高通量自动化克隆构建系统上经过生物样本测试,成功运行并完成了96个样本的PCR反应,采用常规电泳的结果如图2-8所示。
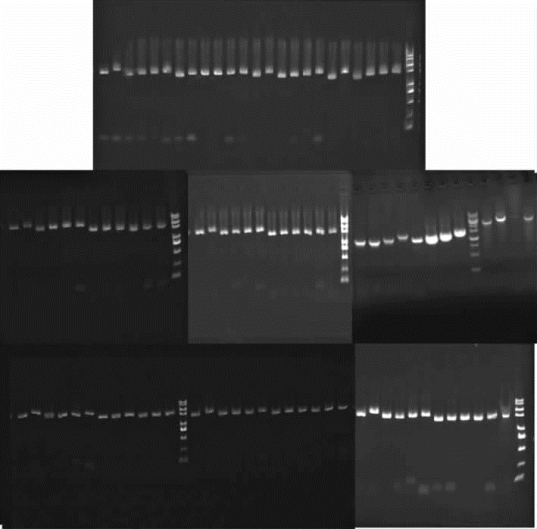
图2-8 高通量自动化PCR电泳结果显示
②用生物样本运行高通量PCR产物纯化及重组转化和高通量质粒抽提程序,结合使用微生物高通量筛选仪器,经过常规电泳验证,成功提取了重组质粒(图2-9)。
③蛋白质可溶性筛选可以和高通量小量蛋白质纯化采取相同的实验,可以通过高通量自动化蛋白质纯化系统完成。
④规模化克隆和蛋白质可溶性筛选模块的验收指标为:设计容量达到平均每天构建300个蛋白质表达载体,并进行蛋白质可溶性表达水平的分析。
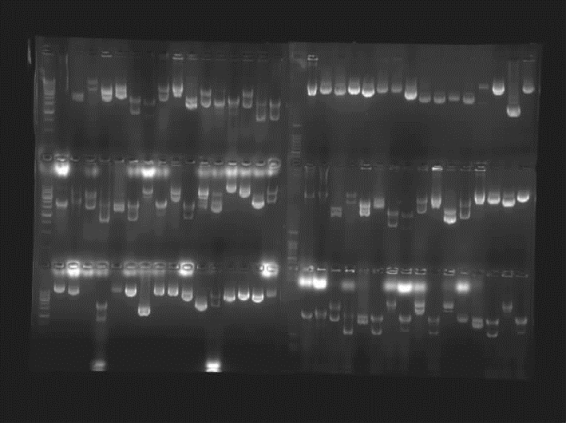
图2-9 高通量质粒抽提电泳结果显示
经过实际生物样本的运行测试,本系统自主设计并与自动化生产厂家合作搭建的高通量自动化克隆构建系统,能够成功地达到验收的各项指标。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




