在生产和生活中,我们经常会遇到化学能与电能相互转化的实例。例如,各种类型的电池大多是化学电源,它们利用化学反应,使化学能直接转化为电能。
在现代生产生活中,电池发挥着越来越重要的作用,大到人造卫星、飞机、轮船,小到电脑、手机、手表。电池释放的电能来自哪里?
■科学探究
完成下列实验,将观察到的实验现象和得到的结论填写在表中。

【实验1】如图1,把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯里,观察实验现象。
【实验2】如图2,把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,观察实验现象。
【实验3】如图3,用导线把实验2中的锌片和铜片连接起来,观察实验现象。
【实验4】如图4,在导线中间连接一个灵敏电流计,观察实验现象。
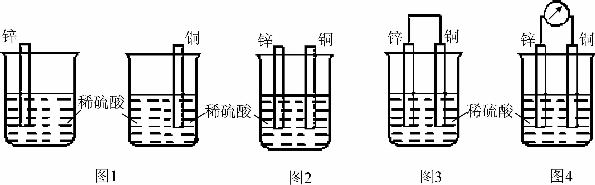
图5-1-1 化学能转化为电能的实验
在上述实验中,将锌片和铜片同时插入稀硫酸中,并用带电流计的导线将它们连接起来,可以看到锌片不断溶解,铜片上有气泡产生,电流计指针发生偏转。说明利用这个装置能将化学能转化为电能。反应过程中电流是这样形成的:
①在锌片(负极)上,锌失去电子形成锌离子(Zn2+)进入溶液,电子经锌电极流向导线;
②流出锌电极的电子经导线通过电流计流入铜电极。(https://www.xing528.com)
③在铜片(正极)上,流入铜电极的电子使氢离子还原成氢气![]() 。
。
④铜电极附近溶液中氢离子减少,锌电极附近溶液中增加的锌离子向铜电极附近移动,使电极和溶液形成电流回路。
上述化学能转化为电能的反应可表示为![]()
我们把化学能转变为电能的装置称为原电池。在原电池中,发生的化学反应是氧化还原反应。发生氧化反应的一极上有电子流出,作负极,失去电子的物质是还原剂。电子通过原电池的负极经导线流向正极,在正极上氧化剂得到电子,发生还原反应。
原电池就是这样通过化学反应实现化学能向电能的转化的。
定义:将氧化—还原反应的化学能直接转变为电能的装置。
再以Cu-Zn原电池(Daniell Cell,丹尼尔电池)为例:
负极反应:![]()
正极反应:![]()
电池反应:![]()
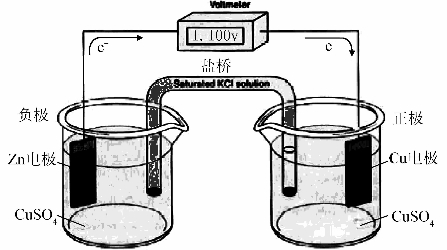
图5-1-2 Cu-Zn原电池示意图
在两种溶液之间插入盐桥以代替原来的两种溶液的直接接触,减免和稳定液接电势,使液接电势减至最小以致接近消除。另外在丹尼尔电池中,使用琼脂盐桥还可以防止负极(Zn)和正极电解液(CuSO4)直接反应,而导致自放电现象。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




