思考与交流 通过下列实验,你能总结出检验Fe3+的方法吗?
【实验6-7】在2支试管中分别加入2mL FeC13溶液和2mL FeSO4溶液,再各滴入几滴硫氰化钾(KSCN)溶液,观察现象。

氯化铁、硫酸铁[Fe2(SO4)3]等含有Fe3+的溶液,遇到KSCN溶液会发生反应,反应方程式为
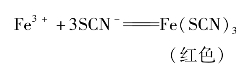
通常,我们可以利用这一反应检验Fe3+的存在。
课堂反馈
1.下列各组物质中,跟KSCN溶液混合,溶液呈红色的是( )。
A.Fe+H2SO4(稀) B.Fe+CuCl2溶液
C.Fe+HNO3(稀) D.FeC13溶液+Fe(过量)
2.怎样用化学方法证明硫酸铁既是铁盐又是硫酸盐?写出验证方法、现象和有关化学反应方程式。
■知识链接
用途广泛的金属材料
随着科学技术的发展,人们对材料的很多性能如耐高温、耐高压、耐酸、强度、熔点等都提出了更高的要求,一般纯金属的性能是难以满足的,所以生活中使用的金属材料绝大部分是合金(图6-3-2)。

图6-3-2 生活中的合金制品
合金是由两种或两种以上的金属(或金属跟非金属)熔合而成的具有金属特性的物质。例如,生铁和钢是铁-碳合金,黄铜是铜-锌合金等。
一般来说,除密度以外,合金的性质并不是它的各组分性质的平均值。合金的熔点低于组成它的主体金属的熔点,例如,铝硅合金(含Si质量分数为13.5%)的熔点为564℃,比纯铝或硅的熔点都低(硅的熔点是1410℃,铝的熔点是660℃)。合金的硬度一般比各组分金属的硬度大,例如,在铜里加1%(质量分数)的铍所生成的合金的硬度,比纯铜大7倍。
此外,合金的导电性和导热性比纯金属也低得多。合金的化学性质也与组成它的纯金属有些不同,例如,铁容易与酸反应,但如果在其中加入25%(质量分数)左右的铬和少量的镍,铁就不易跟酸发生反应了,所以这种钢也称为耐酸钢。
由此可知,合金比纯金属具有许多更优良的性能,在工农业生产和日常生活中,合金得到了广泛的应用。因此,研究、试制具有多种性质的合金对我国工农业的发展和国防建设,具有重要意义。
■生活中的化学
在我国第五套人民币中,有纸币和硬币之分。其中,硬币(图6-3-3)的材质都是合金材料,1元硬币为钢芯镀镍合金,5角硬币为钢芯镀铜合金,l角硬币为铝合金。
另外,生活中,人们佩戴的金首饰(图6-3-4)也是合金制品。通常,向纯金中加入一定量的Ag或Cu,制成硬度较大的金合金,用于制造金首饰。金首饰的成色常用K数表示,主要有24K、22K、18K、14K、10K、8K。K数越高,表示含金量越高,例如,24K表示含金量达99.5%(质量分数)以上,18K表示含金量约75%(质量分数),即1K的含金量是4.1667%(质量分数)。

图6-3-3 硬币

图6-3-4 金首饰
知识梳理
金属都有一定的颜色、光泽、延展性、导电性和导热性,大多数金属的密度、硬度较大,熔点较高。
金属元素的原子最外层电子数较少,在化学反应中,容易失去电子,表现出还原性。
一、金属钠及其化合物
1.钠是________色金属,熔沸点________,密度________,质软。
2.钠化学性质活泼,可与氧气反应,在常温下生成______、加热时生成_____。
钠与氧气反应的化学方程式:________________________________________
3.钠与水反应的化学方程式为________________________________________,实验现象是_____________________________________________________________。
4.氧化钠(Na2O)与过氧化钠(Na2O2):
氧化钠为________色固体粉末,过氧化钠为_______色固体粉末。
氧化钠与水反应的化学方程式:________________________________________
过氧化钠与水反应的化学方程式:_______________________________________
过氧化钠与二氧化碳反应的化学方程式:___________________________________
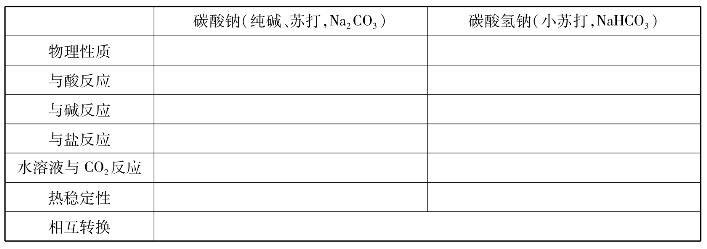
5.碳酸钠与碳酸氢钠的比较:
 (https://www.xing528.com)
(https://www.xing528.com)
二、铝及其化合物
1.铝是________色金属,熔沸点________,密度________,仅为钢的1/3左右,导电性仅次于________,有延展性。
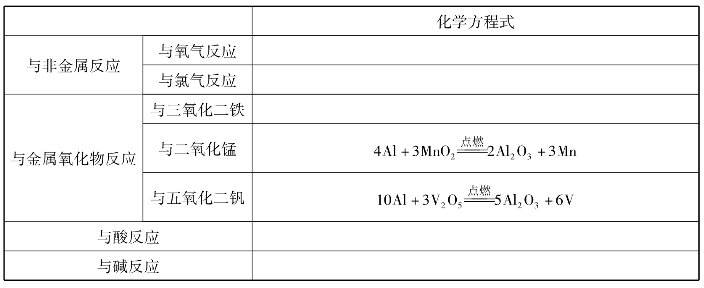
2.铝的化学性质:
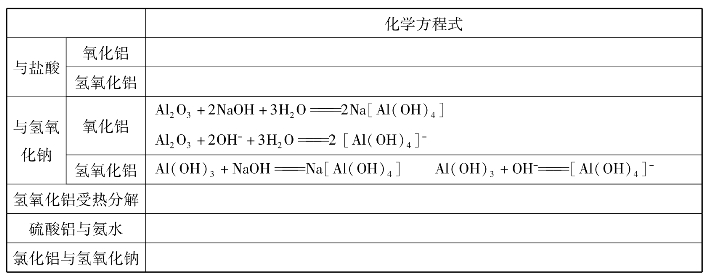
3.铝的重要化合物:
三、常见金属单质及其化合物

四、重要金属离子的检验

知识检测站
1.下列物质中,不属于合金的是( )。
A.黄铜 B.水银 C.钢铁 D.硬铝
2.属于铝热反应的是( )。
A.Al+HCl B.Al+H2SO4 C.Al+MgO D.Al+WO3
3.下列离子方程式正确的是( )。
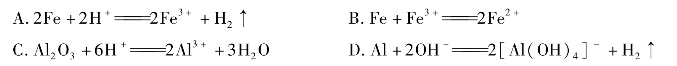
4.你估计铝具有的化学性质是( )。
A.铝合金硬度比纯铝高 B.铝干燥时不易形成氧化膜
C.铝在冷的浓H2SO4中钝化 D.铝不能与Ba(OH)2溶液反应
5.可以用来鉴别Na2CO3溶液和NaHCO3溶液的最好的是( )。
A.加澄清的石灰水 B.加热
C.加稀盐酸 D.加CaCl2溶液
6.常温下,下列不发生反应的一组物质是( )。
①硅与NaOH溶液 ②硅与盐酸 ③硅与氢氟酸 ④二氧化硅与碳酸钠 ⑤二氧化硅与NaOH溶液 ⑥二氧化硅与浓硝酸
A.①②④ B.③④⑥ C.②⑤⑥ D.②④⑥
7.铜与O2、S的反应是![]() ,以下说法符合科学性的是( )。
,以下说法符合科学性的是( )。
A.反应中Cu是氧化剂 B.两个反应电子转移数目一样
C.氧气比硫的氧化性强 D.Cu的化合价降低了
8.工业上,常用Mg还原法制取金属Ti,反应原理如下![]() 。下列说法正确的是( )。
。下列说法正确的是( )。
①该反应属于置换反应 ②该反应属于氧化还原反应 ③该反应表明Mg比Ti活泼 ④Ti被誉为“21世纪的金属”,在航天工业上有广泛用途
A.只有①② B.只有③④ C.只有①②③ D.全部
9.两份铝屑,第一份与盐酸反应,第二份与NaOH溶液反应,产生氢气的物质的量比为1∶2,则第一份与第二份铝屑的质量比为( )。
A.1∶1 B.1∶2 C.1∶3 D.2∶1
10.除去下列物质中的杂质,根据要求填空:
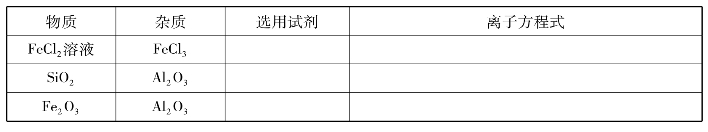
11.有下列A~F六种试剂,它们的性质不同,选用的试剂瓶也不相同,请指出它们分别选用什么样的试剂瓶。
A.二氧化硅( ) B.硝酸银晶体( )
C.氯水 ( ) D.氢氟酸 ( )
E.浓H2SO4( )F.NaOH溶液( )
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




