1.强电解质与弱电解质
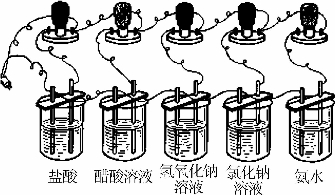
图5-1-1 比较电解质溶液的导电能力
我们在初中曾观察过酸、碱、盐在水溶液中导电的实验现象。不仅如此,如果将氯化钠、硝酸钾、氢氧化钠等固体分别加热至熔化,它们也能导电。这种在水溶液里或熔融状态下能够导电的化合物叫做电解质。
【实验5-1】按图5-1-1的装置安装好仪器,把等体积的1mol/L盐酸、醋酸溶液、氢氧化钠溶液、氯化钠溶液和氨水分别倒入5个烧杯中。接通电源,注意观察实验中各灯泡的明亮程度。
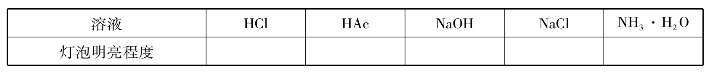
在初中化学中,已经学过凡是在水溶液里或熔融状态下能够导电的化合物叫做电解质。电解质在水溶液中之所以能够导电,是因为它们在溶液中发生了解离,产生了能够自由移动的离子。例如,氯化氢、氢氧化钠、氯化钠在水溶液中,受水分子的作用发生解离,解离方程式为:
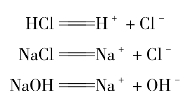
从实验可以看出,连接盐酸的灯泡要比连接醋酸溶液的亮一些,说明在相同条件下,盐酸中能自由移动的离子浓度与醋酸溶液中能自由移动的离子浓度是不同的,即它们的解离程度是有差异的。通常,把能够全部解离的电解质称为强电解质,反之称为弱电解质。
强酸、强碱和大多数盐类都是强电解质,它们在水溶液里全部以离子形式存在,通常用“=”表示完全解离。例如,上述HCl、NaOH、NaCl的解离。
弱酸、弱碱和水都是弱电解质,它们在溶液中只有少部分解离成离子,大部分仍以分子形式存在,通常用![]() ”表示部分解离。例如,CH3COOH、NH3·H2O的解离方程式为
”表示部分解离。例如,CH3COOH、NH3·H2O的解离方程式为
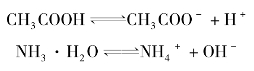
2.弱电解质的解离平衡(https://www.xing528.com)
弱电解质溶于水时,部分解离出的阳离子和阴离子在溶液中互相碰撞,又重新结合成弱电解质分子。因而,弱电解质的解离过程是可逆的。以CH3COOH的解离过程为例:
![]()
当进行到一定程度时,CH3COOH分子解离成H+、CH3COO-的速率与H+、CH3COO-互相碰撞重新结合成CH3COOH分子的速率相等,即达到解离平衡状态。
与化学平衡类似,解离平衡的平衡常数,叫做解离常数。例如,醋酸的解离常数是1.79×10-5,硼酸的解离常数是5.8×10-1。通常,弱酸的解离常数用Ka表示,弱碱的解离常数用Kb表示。
各种弱电解质都有确定的解离常数,若Ka或Kb值较大,说明该弱电解质较易解离。所以,从解离常数的大小可以看出弱电解质的相对强弱。
多元弱酸的解离是逐级进行的,每一级解离都有相应的解离平衡和解离常数,只是第二步解离比第一级解离困难得多。例如,碳酸的解离常数分别是4.3×10-7(第一级)、5.6×10-11(第二级)。多元弱酸的酸性强弱,主要是由第一级解离来决定。
课堂反馈
1.下列物质中属于强电解质的是( )。
A.二氧化硫 B.硫酸钡 C.氢氟酸 D.氢硫酸
2.在下列物质中哪些能够导电?写出解离方程式。哪些不能导电?为什么?
(1)NaOH的水溶液 (2)KCl晶体 (3)HAc的水溶液 (4)液氯
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




