化学反应是按照化学方程式中的计量关系进行的,我们正是据此进行有关化学方程式的计算。你是否思考过这样的问题:一个化学反应在实际进行时(如化学实验、化工生产等),给定量的反应物是否会按化学方程式中的计量关系完全转变成产物?如果能,是在什么条件下?如果不能,原因是什么?
■化学史话
炼铁高炉尾气之谜
钢铁生产是17世纪从英国开始的第一次产业革命的两大产业之一。高炉炼铁的主要反应是:
![]()
其中CO产生的反应是:C(焦炭)+O2(空气===) CO2(放出热量)
![]()

图3-2-1 炼铁高炉
炼制1t生铁所需焦炭的实际用量,远高于按照化学方程式计算所需的量,且从高炉炉顶出来的气体中含有未利用的CO气体。开始,炼铁工程师们认为是CO与铁矿石接触不充分之故,于是设法增加高炉的高度。然而,令人吃惊的是,高炉增高后,高炉尾气中的CO的比例竟然没有改变。
这成了炼铁技术中的科学悬念。有关人士一直在探究其中原因,直到19世纪下半叶,法国科学家勒夏特列经过深入的研究,才将这一谜底揭开。原来,产生上述现象的原因是![]() 是一个可逆反应,并且自下而上发生在高炉中有焦炭的地方。后来的研究说明,在高炉中Fe2O3与CO反应也不能全部转化为Fe和CO2。
是一个可逆反应,并且自下而上发生在高炉中有焦炭的地方。后来的研究说明,在高炉中Fe2O3与CO反应也不能全部转化为Fe和CO2。
化工厂里有很多化学反应过程与高炉中的反应相似,不能按化学方程式的计量关系完全反应,我们实验中遇到的化学反应也有类似的情形。
思考与交流 当温度一定时,将过量的某晶体物质放入某溶剂中形成饱和溶液。长时间的观察表明,溶液中剩余晶体物质的外形竟然在不断地变化,小晶体会长大,有的晶体上的缺角也不见了,但是剩余晶体的质量却没有改变。你知道这其中的道理吗?
初中化学中已经学过,氢和氧燃烧生成水的反应:
![]()
在一定条件下,反应几乎能完全进行到底,反应物能完全转变为生成物,而在同样条件下,往相反方向的反应几乎不能进行。像这种几乎只能向一个方向进行“到底”的反应叫做不可逆反应。但是,还有一些化学反应与上述反应不同,反应物不能全部转变为生成物。
例如,工业合成氨的反应:
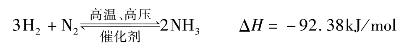
该反应在一定条件下,H2与N2反应生成NH3的同时,部分NH3在相同条件下又分解为H2和N2,致使H2与N2的反应不能进行到底。这种在相同条件下,能够同时向两个相反方向进行的反应叫做可逆反应。通常,把向右进行的反应称为正反应,把向左进行的反应称为逆反应,可逆反应通常在反应中用符号![]() ”表示。
”表示。
思考与交流 水的生成(H2+O2)与电解,CO2和H2O在植物体中通过光合作用合成糖与糖在人体内氧化生成CO2和H2O,它们是否属于“可逆反应”?谈谈你的见解。

图3-2-2 可逆反应中正、逆反应速率示意图
在工业合成氨反应中,开始时H2与N2的浓度最大,因而它们化合生成NH3的正反应速率最大;而NH3的浓度为零,它分解生成H2与N2的逆反应速率也为零。随着反应的进行,反应物H2与N2的浓度逐渐减小,正反应速率就逐渐减小;生成物NH3的浓度逐渐增大,逆反应率就逐渐增大。经过一段时间,将会出现正反应速率和逆反应速率相等的情况(如图3-2-2所示)。这时,单位时间内正反应消耗的H2与N2的分子数恰好等于逆反应生成的H2与N2的分子数。反应体系中,H2、N2和NH3的浓度不再发生变化。于是,反应物和生成物就处于化学平衡状态。
所谓化学平衡状态,就是指在一定条件下的可逆反应,其正反应和逆反应的速率相等,反应混合物中组成成分的浓度保持不变的状态。化学平衡是一种动态平衡,当反应达到平衡时,正反应和逆反应仍在继续发生变化。
化学平衡状态是可逆反应达到的一种特殊状态,是在给定条件下化学反应所能达到或完成的最大限度,即该反应进行的限度。化学反应的限度决定了反应物在该条件下的最大转化率。
任何可逆反应在给定条件下的进程都有一定的限度,只是不同反应的限度不同。改变反应条件可以在一定程度上改变一个化学反应的限度,亦即该反应的化学平衡状态。因此,通过调控反应条件可使反应更好地符合人们预期的结果,这在工农业生产和环保技术等方面已经取得广泛的应用。
■资料卡片
可逆反应达到平衡状态时,生成物浓度的幂乘积与反应物浓度幂乘积之比是一个常数,该常数称为化学平衡常数。对于任何一个可逆反应![]() ,当反应达到平衡时,其化学平衡常数(K)可表示为(https://www.xing528.com)
,当反应达到平衡时,其化学平衡常数(K)可表示为(https://www.xing528.com)

式中,[A]、[B]、[C]、[D]为反应物和生成物平衡时物质的量浓度,m,n,p,q为方程式中各相应化学式前面的系数。K值的大小,表明反应按正向进行程度的大小。
化学平衡只是可逆反应在一定条件下的一种暂时的、相对的稳定状态。如果影响平衡的条件发生变化,使得正、逆反应速率不再相等,反应的平衡状态就会遭到破坏,各物质的浓度就会发生变化,直到在新的条件下,反应又达到新的平衡。像这种因平衡状态被破坏而建立新的平衡的过程,叫做化学平衡状态的移动。当一个可逆反应达到化学平衡状态后,如果改变浓度、压强、温度等反应条件,对平衡有何影响呢?
1.浓度对化学平衡的影响
实验表明,在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正反应方向移动;增大生成物的浓度或减少反应物的浓度,都可以使平衡向逆反应方向移动。
■实践活动
可逆反应达到平衡时,反应物或生成物浓度的变化,都会对化学平衡产生影响。请设计实验,并验证上述结论。
在工业生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。例如,在硫酸工业上,常用过量的空气使SO2充分氧化,以生成更多的SO3。
2.压强对化学平衡的影响
思考与交流 根据表3-1中列出的实验数据,想一想,压强对化学平衡有怎样的影响?
表3-1 450℃,不同压强下N2与H2反应生成NH3(体积分数φ)的实验数据

可以看出,在其他条件不变的情况下,增大压强,化学平衡向气体体积缩小的方向移动;减小压强,化学平衡向气体体积增大的方向移动。
应当注意,压强只对有气体参加的、且反应前后气体体积不相等的平衡体系才有影响。而固态和液态物质的体积受压强的影响很小,可以忽略不计。因此,当平衡混合物都是固体和液体时,改变压强,化学平衡不发生移动。
3.温度对化学平衡的影响
对于可逆反应来说,如果正反应是放热反应,则其逆反应必然为吸热反应。例如:
![]()
【实验3-3】如图3-2-3所示,将充有NO2与N2O4平衡混合气体平衡仪的两球分别置于盛有热水(右)和冰水(左)的烧杯中,观察平衡仪两球内气体颜色的变化。


图3-2-3 温度对化学平衡的影响
实验表明,在其他条件不变的情况下,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。
综上所述,如果改变影响平衡的一个条件(如温度、压强以及参加反应的化学物质的浓度),平衡就向着能够减弱这种改变的方向移动。这就是著名的勒夏特列原理。
■化学史话
勒夏特列是一位精力旺盛、科学成就举世闻名的法国物理化学家。他知识渊博,著述颇丰,探究欲极强,涉足的研究领域十分广泛,包括陶器、玻璃、水泥、磨蚀剂、炸药等,热电偶温度计以及用于金属焊接和切割的氧炔焰都是他的发明。
勒夏特列长期致力于如何从化学反应中得到最高产率的研究,对找到科学研究与工业生产之间的联系始终抱有极其深厚的兴趣。正是这样,才有了著名的化学平衡移动原理——勒夏特列原理。应用勒夏特列原理,可以使许多工业生产过程中的转化率达到或接近理论值,避免出现工业设计方案的低效甚至无效,在指导化工生产方面具有重大意义。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




