在化学实验和日常生活中,我们经常观察到这样的现象:有的化学反应进行得快,有的化学反应进行得慢。
如溶洞的形成(图3-1-1)和物质爆炸(图3-1-2),你知道他们的速率快慢吗?你能从日常生活和化学实验中再举出一些反应速率快慢有别的例子吗?

图3-1-1 溶洞

图3-1-2 物质爆炸
不同的化学反应进行的快慢千差万别,“快”与“慢”是相对而言的,是一种定性的比较,通常要确定一个参照物。在科学研究和实际应用中,需要对化学反应进行的快慢进行定量的描述或比较,这就需要使用同一定义或标准下的数据。与物理学中物体的运动快慢用“速度”表示相类似,化学反应过程进行的快慢用“化学反应速率”来表示。
在一定条件下,表明化学反应进行快慢程度的物理量,叫做化学反应速率。化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。单位为mol/(L·s)、mol/(L·min)或mol/(L·h)等。
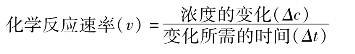
例如:在一定条件下,工业合成氨的反应:

则以反应物N2的浓度变化来表示的化学反应速率为0.1 mol·L-1·S-1。
思考与交流 在上述反应中,v(H2)=___________,v(NH3)=_____________。想一想,它们的数值为什么不同?它们之间有关系吗?
■资料卡片
生活中的快与慢
日常生活中,人们有时需要加快化学反应的速率,例如,加大油门,促使汽车提速;开大煤气灶开关,使火焰燃烧得更旺;将煤块变煤屑,加速煤炭燃烧;用衣物包裹提温,促使米酒发酵等。有时,又必须控制化学反应速率,例如,把食物放在冰箱里,延长保鲜期;在食物包装内放入除氧剂和干燥剂,减缓变质等。因此,化学反应速率在生活中随处可见,我们应根据需要改变化学反应的速率,为人类造福。
思考与交流
1.为什么要将食物存放在温度低的地方(如电冰箱)?
2.实验时,通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么?
3.人们常把固体试剂溶于水配成溶液后再进行化学实验,原因是什么?
4.实验室常用约30%左右的硫酸溶液(约3.7mol/L)与锌粒反应制取氢气,当反应进行一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来。原因是什么?
从上面的实验和事例可以看出,温度、固体的表面积、反应物的状态、溶液的浓度、催化剂等都可以影响化学反应的速率,人们可以通过这些因素来调控化学反应速率。
化学反应的速率首先取决于反应物的本性。但是,外界条件对化学反应速率也有一定的影响,其中,主要影响因素是浓度、压强、温度和催化剂等。
1.浓度对化学反应速率的影响
在初中化学中,已经学过木炭在纯氧中燃烧速率比在空气中快。大量实验结果表明,当其他条件相同时,增大反应物的浓度,反应速率加快;减少反应物的浓度,反应速率减慢。
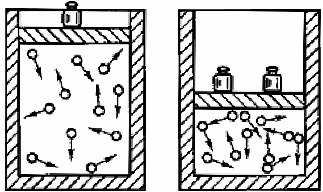
图3-1-3 压强与气体浓度关系示意图
2.压强对化学反应速率的影响
对于有气体参加的化学反应,压强是影响反应速率的重要因素。在一定温度下,一定质量的气体所占的体积与压强成反比(图3-1-3)。也就是说,在相同温度下,压强越大,一定质量的气体体积就越小,单位体积内的气体分子数就越多,即气体的浓度就会越大;反之,压强越小,一定质量的气体体积就越大,单位体积内的气体分子数就越少,即气体的浓度就会越小。所以,增大压强,就是增大气体的浓度,反应速率增大;减小压强,就是减小气体的浓度,反应速率减慢。(https://www.xing528.com)
3.温度对化学反应速率的影响
【实验3-1】在2支大小相同的试管中,装入2~3mL约5%的H2O2溶液,分别滴入1~2滴1mol/L FeCl3溶液。待试管中均有适量气泡出现时,将其中一支试管放入盛有5℃左右冷水的烧杯中;另一支试管放入盛有40℃左右热水的烧杯中,观察现象并进行对比。待放入热水中的试管里出现大量气泡时,用待火星的火柴梗检验放出的气体。

从实验3-1我们观察到,升高温度,H2O2分解速率增大;降低温度,H2O2分解速率减小。大量实验和理论研究表明,在其他条件相同时,升高温度,反应速率加快;降低温度,反应速率减慢。
因此,通常可以采用调控温度的办法来控制化学反应速率。
4.催化剂对化学反应速率的影响
■化学史话
人类利用催化剂的历史可以追溯到遥远的古代,那时候的人们把硝石和硫磺混合制备硫酸,把酒曲加到粮食中制醋和酿酒,硝石和酒曲应该就是最早的催化剂了。
到了19世纪,德国化学家奥斯瓦尔德在研究蔗糖的水解反应时发现:蔗糖在水溶液中能够转化为葡萄糖和果糖,只是这种转化过程非常缓慢。有没有办法加快这个过程呢?奥斯瓦尔德试着向蔗糖水溶液中加入硫酸,奇迹出现了,蔗糖很快转化成了葡萄糖和果糖。更奇特的是,他还注意到硫酸在反应后依然保持不变。这种能够改变化学反应速率,而自身在反应前后依然保持不变的物质像什么呢?奥斯瓦尔德想到了机器运转时的润滑油。后来,奥斯瓦尔德就给这种神奇的化学反应“润滑油”起了一个名字——催化剂。
今天,人们对催化剂的认识和应用早已步入更高的层次,各种高效、特效催化剂不断被发现和应用,对提高生产效率、促进科学研究和工农业生产都起到积极的推动作用。
在化学反应里,凡能改变其他物质的化学反应速率,而本身的组成、质量和化学性质在反应前后保持不变的物质,称为催化剂。通常说的催化剂大多是指可以加快化学反应速率的物质。如实验室用氯酸钾分解制取氧气时,当加热并有催化剂二氧化锰存在时,氯酸钾分解速率显著加快。
【实验3-2】在3支大小相同的试管中各装入2~3mL约5%的H2O2溶液,再向其中2支试管中分别加入少量MnO2粉末、1~2滴1mol/L FeCl3溶液。对比观察现象。

从实验3-2我们观察到,MnO2、FeCl3可以加快H2O2分解的速率,起了催化剂的作用。催化剂在化工生产中应用十分普遍,新的催化剂的问世,常常意味着化工生产工艺的一次革新和进步。
■科学视野
神奇的催化剂
催化剂是现代化学中关键而神奇的物质之一。约有80%~85%的化工生产过程使用催化剂(如氨、硫酸、硝酸的合成,乙烯、丙烯、苯乙烯等的聚合,石油、天然气、煤的综合利用,等等),目的是加快反应速率,提高生产效率。在资源利用、能源开发、医药制造、环境保护等领域,催化剂也大有作为,科学家正在这些领域探索适宜的催化剂以期在某些方面有新的突破。催化剂十分神奇,它能极大地加快反应速率(可使化学反应速率增大几个到十几个数量级),而自身的组成、化学性质和质量在反应前后不发生变化;它和反应体系的关系就像锁与钥匙的关系一样,具有高度的选择性(或专一性)。

图3-1-4 各种各样的催化剂
生物(包括人)体内几乎所有的化学反应(如淀粉、脂肪、蛋白质的水解、DNA的复制等)都是由生物体内自身存在的特殊催化剂——酶(一种蛋白质)所催化的。酶比一般的催化剂具有更高的选择性,催化效率也远远高于非酶催化剂,而且是在正常体温的条件下发生作用,因此是理想的催化剂。例如,实验室水解淀粉,要在酸(催化剂)存在下,加热一定时间才能完成;而咀嚼馒头时,在淀粉酶的作用下,很快就有了甜味。又如,食物中蛋白质的水解,在体外需在浓的强酸(或强碱)条件下煮沸相当长的时间才能完成,而在体内蛋白酶的作用下短时间内即可完成。我国在西周时期已发明了“酒曲”酿酒工艺,“酒曲”就是一种酶。受酶的启示,科学家正在研制具有生物酶某些特性的化学酶,以期实现“仿酶催化”,这是设计和合成新催化剂的新途径,前景十分诱人。
催化剂的神奇面纱至今尚未完全揭开,因此,催化剂的研究和应用将是21世纪化学的一个极具魅力和应用前景的重大主题。
影响化学反应速率的条件并不只是温度和催化剂。除了上述几种方法之外,反应物的颗粒大小,粒子扩散速率快慢,光、超声波、电磁波,以及反应溶剂等,也是影响化学反应速率的因素。如果我们细心观察和思考,就会发现生活里和化学实验中采取的很多措施都是用来调控反应速率的。
课堂反馈
1.在2A+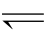
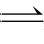 B 3C+5D反应中,表示该反应速率最快的是( )。
B 3C+5D反应中,表示该反应速率最快的是( )。
A.v(A)=0.5mol/(L·s) B.v(B)=0.3mol/(L·s)
C.v(C)=0.8mol/(L·s) D.v(D)=1mol/(L·s)
2.在某容器中发生反应2H2S+SO2=3S↓+2H2O,经过10秒钟后,硫化氢的物质的量减少了0.02mol,在另一容器中反应,硫化氢的物质的量减少了0.2mol,问哪个容器中反应速率快?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




