元素在周期表中的位置,反映了元素的原子结构和元素性质。有了元素周期律以后,我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。
我们可以在周期表中给金属元素和非金属元素分区。如图1-2-5所示,虚线左面是金属元素,虚线右面是非金属元素,最右一个纵行是稀有气体元素。由于元素的金属性与非金属性之间并没有严格的界限,位于分界线附近的元素即能表现出一定的金属性,又能表现出一定的非金属性。在周期表中,主族元素从上到下、从左到右,元素的金属性和非金属性存在着一定的递变规律。
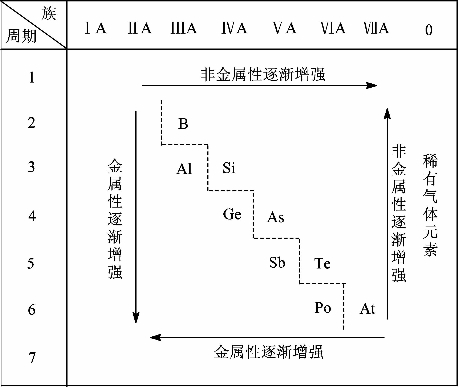
图1-2-5 元素金属性和非金属性的递变
思考与交流 什么元素的金属性最强?什么元素的非金属性最强?它们分别位于元素周期表中的什么位置?
元素的化合价与元素在周期表中的位置有一定的关系。例如:
(1)主族元素的最高正化合价等于它所处的族序数,因为族序数与最外层电子(价电子)数相同。
(2)非金属元素的最高正化合价,等于原子所能失去或偏移的最外层电子数,而它的负化合价则等于使原子达到8电子稳定结构所需得到的电子数。所以,非金属元素的最高正化合价和它的负化合价的绝对值之和等于8。
元素周期表是元素周期律的具体表现形式,是学习化学的一种重要工具。过去,门捷列夫曾用周期律预言未知元素并得到了证实。此后,科学家在周期律和周期表的指导下,对元素性质进行了系统研究,并为新元素的发现及预测它们的原子结构和性质提供了线索。
元素周期表和元素周期律对于其他与化学相关的科学技术也有指导作用。例如,在周期表中金属与非金属的分界处,可以找到半导体材料,如硅、锗等,半导体器件的研制正是开始于锗,后来发展到研制与它同族的硅。又如,农药由含砷的有机物发展成为对人畜毒性较低的含磷有机物等,通常制造的农药,所含有的氟、氯、硫、磷等在周期表中的位置靠近,在一定的区域内。人们还在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。
由于在周期表中位置靠近的元素性质相近,在周期表一定区域内寻找元素,发现物质的新用途被视为一种相当有效的方法。
■科学视野
人造元素
元素周期表都是从氢开始的(曾有从原子序数为0的中子开始的建议),所以把H的原子序数定义为1,已成为不需更改的事实。那么,元素周期表中的元素种类是否有限呢?理论物理学家对此已有多种估计,而对于崇尚实验的实验物理学家和化学家来说,从未放弃过人造元素的努力。人造元素的关键是用某种元素的原子核作为“炮弹”来轰击另一种元素的原子核,当它的能量足以“击穿”原子核是“坚壳”并熔合成新核时,质子数改变,新元素也就产生了。质子数的改变严格地遵从加法规则,如用硼(原子序数为5)轰击锎(原子序数为98),得到103号元素铑(1961年);用铬(原子序数24)轰击铅(原子序数为82)得到106号元素![]() (1974年)。元素周期表成了核物理学家手中的一张十分特殊的加法表。不过,实现核反应远非做加法那样轻而易举,要有昂贵的特殊装置(如回旋加速器)和超高的实验技术。设想与实际之间的差别如此之大,正是事物的两个方面,也正是科学引人入胜之处。(https://www.xing528.com)
(1974年)。元素周期表成了核物理学家手中的一张十分特殊的加法表。不过,实现核反应远非做加法那样轻而易举,要有昂贵的特殊装置(如回旋加速器)和超高的实验技术。设想与实际之间的差别如此之大,正是事物的两个方面,也正是科学引人入胜之处。(https://www.xing528.com)
课堂反馈
1.关于元素周期表,下列叙述中不正确的是( )。
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在非金属元素区域可以寻找制备新型农药材料的元素
D.在地球上元素的分布和它们在元素周期表中的位置有密切关系
2.右图中A,B,C,D是同周期或同主族的相邻元素:
①已知:A元素的最低价为-3价,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多1个,则A元素原子的质量数为______,原子序数为______,A元素位于第________周期________族。
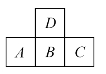
②写出元素符号A________,B________,C________,D________。
③A,B,C三种元素最高价氧化物的水化物的化学式依次为________,________,________,其中酸性最强的是_______。
④B,D两种元素和氢组成的气态氢化物的化学式依次为________、________,其中______稳定性最大,_______还原性最强。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




