■科学探究
(1)在下表中写出元素周期表前三周期元素(1~18号)的元素符号及原子的核外电子排布(用原子结构示意图表示)。

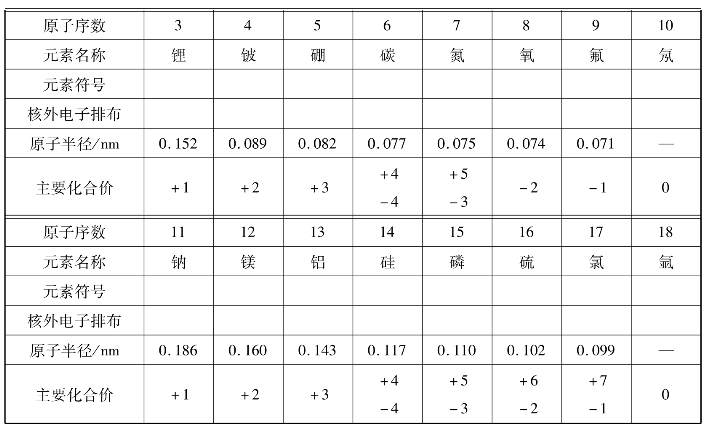
(2)观察上面的表格,思考并讨论:随着原子序数的递增,元素原子的核外电子层排布、元素的原子半径和元素的化合价各呈现什么规律性的变化?

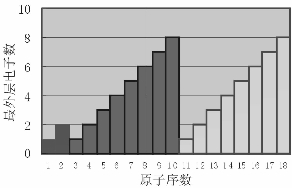
图1-2-2 同周期元素原子序数变化
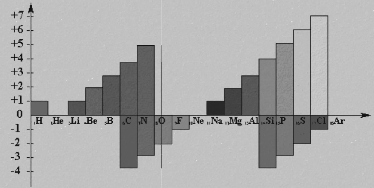
图1-2-3 同周期元素主要化合价变化

图1-2-4 同周期元素原子半径变化
通过上面的讨论我们知道,随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性的变化。那么,元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?我们通过第三周期元素的一些化学性质来探讨这一问题。
■科学探究
(1)实验
①取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞溶液。观察现象。过一会儿加热试管至水沸腾。观察现象。

②取一小段镁带和一小片铝,用砂纸磨去它们表面的氧化膜,分别放入两支试管,再各加入2mL 1mol/L盐酸。观察发生的现象。(https://www.xing528.com)

(2)讨论
①回忆钠与水反应的现象,比较钠和镁与水反应的难易程度。
②比较镁和铝与盐酸反应的难易程度。
③比较钠、镁、铝的最高价氧化物对应水化物(氢氧化物)碱性强弱。
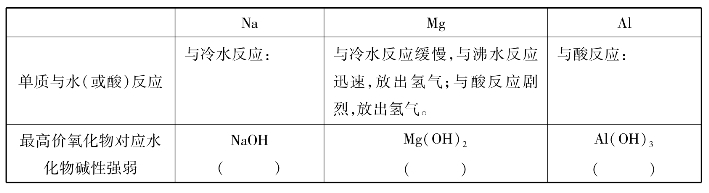
④通过以上实验和讨论,你能推断出钠、镁、铝的金属性强弱吗?
![]()
金属性逐渐_______________________________________________。
(3)阅读
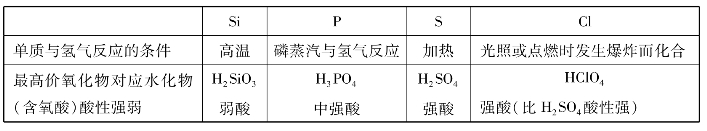
(4)通过以上对第三周期元素性质的比较,我们可以得出的结论:
![]()
金属性逐渐______________,非金属性逐渐______________。
对其他周期元素性质进行研究,也可以得到类似的结论。
通过大量事实,人们归纳出一条规律:元素性质随着原子序数的递增而呈现周期性的变化。这一规律叫做元素周期律。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




