1.碱金属元素
■科学探究
(1)查阅元素周期表中的有关信息,填写下表。
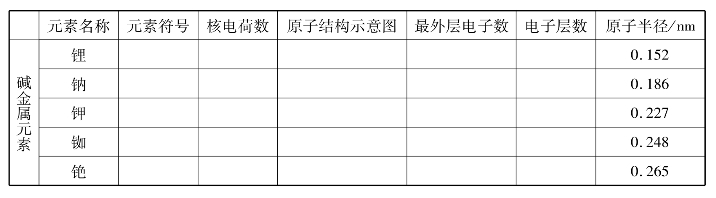
通过观察碱金属的原子结构示意图,你能发现碱金属元素的原子结构有什么共同之处吗?
(2)实验探究
①将一干燥的坩埚加热,同时取一小块钠,擦干表面的煤油后,迅速投入到热坩埚中,观察现象。用钾重复上述实验,观察现象。对比两者与氧气的反应。
②在培养皿中放入一些水,然后取绿豆大的钠,用滤纸吸干表面的煤油,投入培养皿中,观察现象。用钾重复上述实验,观察现象。对比两者与水的反应。
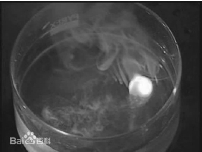
图1-1-2 钾与水反应

图1-1-3 钠与水反应

思考与交流 通过对比和观察钠和钾的实验,思考并讨论钠和钾的性质有什么相似性和不同。你认为元素的性质与它们的原子结构有关系吗?
通过大量实验和研究,人们得出如下结论:
碱金属元素原子的最外层都有1个电子,它们的化学性质相似,都能与氧气等非金属单质以及水反应。例如:
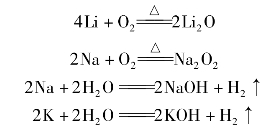
而且,上述反应的产物中,碱金属元素的化合价都是+1价。
随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱。所以,碱金属元素的性质也有差异,从锂到铯金属性逐渐增强,如它们与氧气或水反应时,钾比钠的反应剧烈,铷、铯的反应更剧烈。
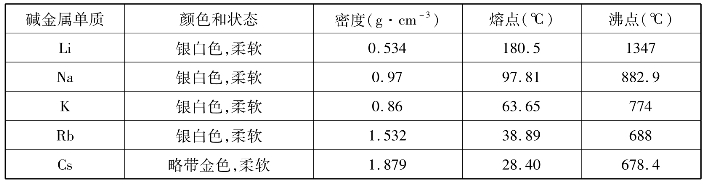
碱金属在物理性质上也表现出一些相似性和规律性。例如,除铯外,其余的都呈银白色;它们都比较柔软,有延展性。碱金属的密度都比较小,熔点也都比较低,导热性和导电性也都很好,如液态钠可用作核反应堆的传热介质。
表1-1-1 碱金属的主要物理性质
2.卤族元素(https://www.xing528.com)
■资料卡片
卤素单质的物理性质

思考与交流
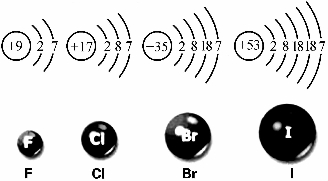
图1-1-4 卤族元素原子结构和原子大小
根据卤素原子结构,请你推测一下氟、氯、溴、碘在化学性质上所表现的相似性和递变性。
(1)卤素单质与氢气反应

随着核电荷数的增多,卤素单质与氢气的反应呈下述规律性变化:
![]()
剧烈程度:_____________________________
生成的氢化物的稳定性:_________________
(2)卤素单质间的置换反应
类似于通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过卤素间的置换反应实验,我们也可以比较出卤素氧化性的强弱。
【实验1-1】 完成下列实验,观察现象。写出有关反应的化学方程式。
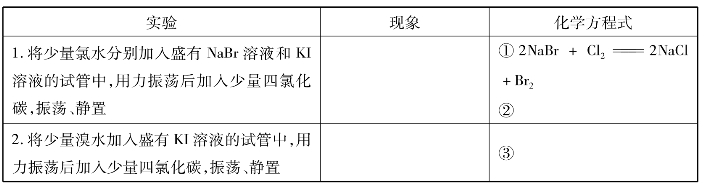
随着核电荷数的增加,卤素单质的氧化性强弱顺序为:

通过比较碱金属单质与氧气、水的反应,以及卤素单质与氢气的反应、卤素单质间的置换反应,我们可以看出,元素性质与原子结构有密切的关系,特别是最外层电子数有关。原子结构相似的一族元素,它们在化学性质上表现出相似性和递变性。
在元素周期表中,同主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱。所以,金属性逐渐增强,非金属性逐渐减弱。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




