在中性环境中,水分子发生电离反应,生成氢离子(H+)和氢氧根离子(OH-),二者浓度相等。
![]()
该反应是一个可逆反应,根据质量作用定律,对于纯水的电离可以找到一平衡常数K 加以表示。

式中 [H+]——氢离子浓度,mol/L;
[OH-]——氢氧根离子浓度,mol/L;
[H2O]——未离解水的浓度,mol/L;因水的电离度很小,[H2O]=55.5 mol/L。
水的电离受温度影响,加酸加碱都能抑制水的电离。水的电离是水分子与水分子之间的相互作用引起的,因此极难发生。在一定温度下,K 是常数,如25 ℃时K=1.8×10-16,所以![]() 也是常数,称为水的离子积,以Kw 表示。在25 ℃时
也是常数,称为水的离子积,以Kw 表示。在25 ℃时
![]()
水的离子积Kw 只随温度变化而变化,是温度常数。在15~25 ℃,因变化很小通常认为是常数,即Kw=10-14 mol/L,但当水的温度升高到100 ℃时,Kw≈1×10-12 mol/L。
在水中逐渐滴加酸性溶液,氢离子浓度不断增加,同时氢氧根离子浓度不断降低;在水中逐渐滴加碱性溶液时,情况正好相反:氢离子浓度不断降低,而氢氧根离子浓度不断增加。
pH 是氢离子浓度的测量值,pH 有如下定义:pH 是水溶液中氢离子摩尔浓度(M)的负对数。
![]()
log 是数学概念中的“对数”术语,pH 数值的计算采用以10为底的常用对数,这也表明:pH 每改变1个单位,氢离子浓度则改变了10倍,pH值与氢离子浓度的关系如图3.1所示。
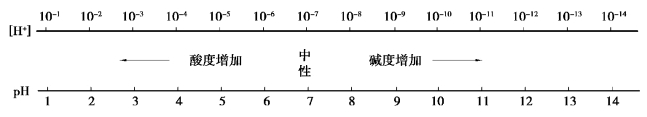
图3.1 pH值与氢离子浓度的关系图(https://www.xing528.com)
典型的pH 测量范围在0~14。
①pH=7 表明溶液中氢离子浓度和氢氧根离子浓度相等,溶液的酸碱性呈中性。
②pH<7 表明溶液中氢离子浓度高于氢氧根离子浓度,溶液酸碱性呈现酸性。
③pH>7 表明溶液中氢氧根离子浓度高于氢离子浓度,溶液酸碱性呈碱性。
④pH<0 和pH>14 的情况时,溶液为强酸或强碱溶液,此时不用pH 来表征。
由于pH 是对数函数,所以溶液每改变1个pH 单位,溶液中氢离子浓度就会有10倍的改变。
pH 的测量主要依据能斯特方程,将化学能转换为电能的原电池或电解池相关的计算公式。能斯特(Nernst)方程可以用计算式(3.3)表达:
![]()
式中 E——电动势,以mV 表示,指在真实条件下两个电极之间的电位差;
E0——标准电极电位,以mV 表示,指在标准温度、压力和浓度下两个电极之间的电位差;
R——通用气体常数,单位是J/mol·K(焦耳/摩尔·开尔文温度);
T——绝对温度,单位是开尔文,开尔文温度与摄氏度之间的换算关系为:开尔文温度=273+摄氏度;
n——离子价态数;
F——法拉第常数,单位是C/mol(库伦/摩尔);
ai——离子活度。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




