蓄电池在充电时,电能转化为化学能,放电时化学能又转化为电能。铅酸蓄电池在放电时,金属铅是负极,发生氧化反应,被氧化为硫酸铅;二氧化铅是正极,发生还原反应,被还原为硫酸铅。蓄电池在用直流电充电时,两极分别生成铅和二氧化铅。移去电源后,它又恢复到放电前的状态,组成化学蓄电池。铅酸蓄电池是能反复充电、放电的蓄电池,所以又称为二次蓄电池。它的电压是2V,通常把3个铅酸蓄电池串联起来使用,电压是6V。汽车上用的是6个铅酸蓄电池串联成12V的蓄电池组。电动自行车用的蓄电池一般采用6节单格蓄电池串联成的12V蓄电池组;或由3个蓄电池组组成36V供电电源,也有采用4个蓄电池组组成48V供电电源。铅酸蓄电池在使用一段时间后要补充硫酸,使电解质保持含有22%~28%的稀硫酸。
充放电反应式如下:
正极反应式为
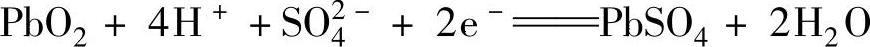
负极反应式为
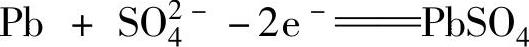
总反应式为
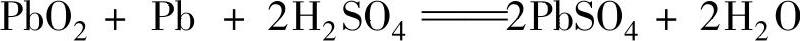
在反应式中,向右反应是放电,向左反应是充电。
蓄电池的应用十分广泛,可用于UPS、交通工具、滑板车、汽车、风能和太阳能系统、安全报警等方面。
铅酸蓄电池是把能量以化学能形式存储,需要时化学能以电能释放出来的一种装置。把电能以化学能形式存储的过程叫充电,需要时化学能以电能释放出来的过程叫放电。它重复上述的充电和放电过程,所以又叫二次蓄电池。
铅酸蓄电池的整个充电和放电过程都是在电化反应中实现的,可以把铅酸蓄电池作为一个电化反应体系,其电化反应系是 。蓄电池在充、放电过程中进行如下的反应:
。蓄电池在充、放电过程中进行如下的反应:
1.放电
蓄电池对外做功时开始放电。外部电流从正极流出,经负载(R)流向负极,内部流向则是从负极流向正极。在蓄电池内部,SO42-离子迁移到正极,负极上的Pb2+原子放出两个电子,Pb2+与SO42-中和生成PbSO4。其反应式为
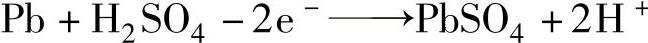
由于负极上失去的两个电子经外电路流向正极,正极上的二氧化铅从外电路得到两个电子后,Pb4+离子变成Pb2+离子,它和SO42-反应生成PbSO4,反应式为
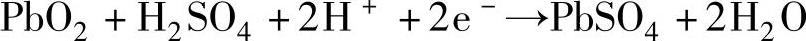
铅酸蓄电池的放电示意图如图1-40所示。(https://www.xing528.com)
铅酸蓄电池放电中的化学反应是:连接外部电路放电时,稀硫酸即会与阴、阳极板上的活性物质产生反应,生成新化合物硫酸铅。经由放电后硫酸成分从电解液中释出,放电越久,硫酸浓度越稀薄。所消耗的成分与放电量成比例,只要测得电解液中的硫酸浓度,即可测其密度,就可得知放电量或残余电量。
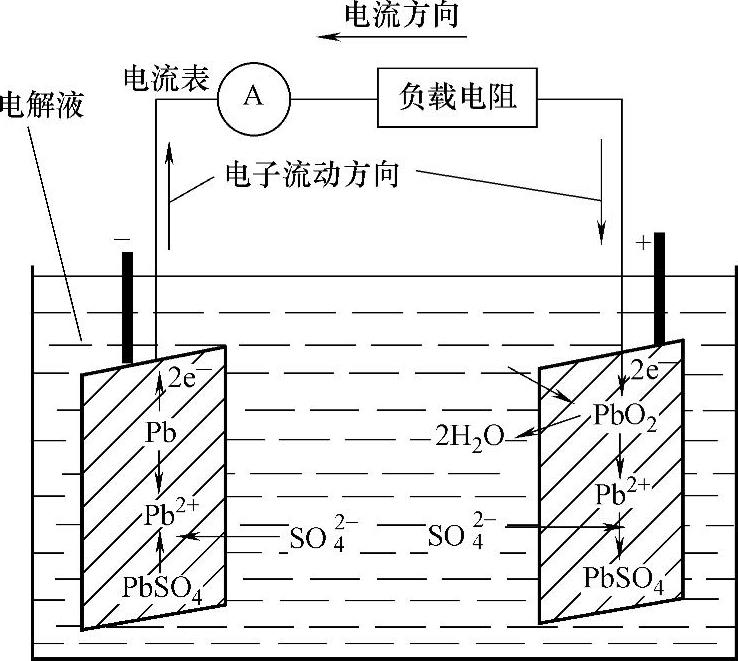
图1-40 铅酸蓄电池的放电示意图
2.充电
充电是蓄电池的再生功能。充电时,整个电源将负极电子流输送到蓄电池的正极,负极PbSO4不断地离解为Pb2+和SO42-,Pb2+离子取得外电路输送来的两个电子,立即还原成多孔金属Pb。SO42-离子立即和H+离子还原为硫酸。反应式为:
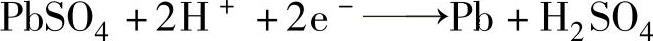
在正极上,PbSO4不断地离解为Pb2+和SO24-,Pb2+离子失去两个电子被氧化成Pb4+离子,它又与水中的氧离子生成PbO2。反应式为

由于铅酸蓄电池电解液的主要成分是硫酸和水,在充电时,会使水的成分减少,而使硫酸的成分增加,即电解液密度上升,随着充电时间的延长(4~8h),浓度逐渐恢复到原来的水平。同时,在充电过程中,两极的活性物质逐渐还原,当两极的活性物质还原到原来的状况时,即表示充电已结束。
铅酸蓄电池的充电示意图如图1-41所示。
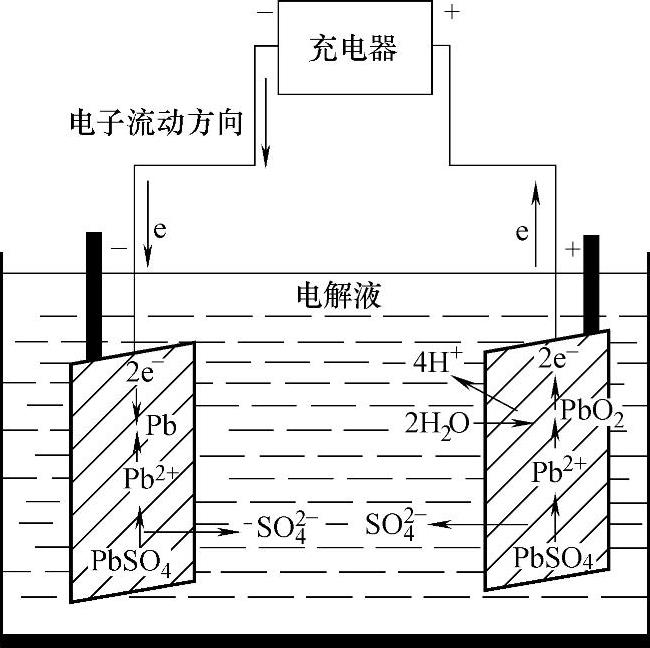
图1-41 铅酸蓄电池的充电示意图
铅酸蓄电池充电中的化学变化是:由于放电时在阳极板、阴极板上所产生的硫酸铅会在充电时被分解还原成硫酸、铅及过氧化铅,因此蓄电池内电解液的浓度逐渐增加,即电解液的密度上升,并逐渐回复到放电前的浓度,这种变化显示出蓄电池中的活性物质已还原到可以再度供电的状态。当两极的硫酸铅被还原成原来的活性物质时,即等于充电结束,而阴极板就产生氢,阳极板则产生氧,充电到最后阶段时,电流几乎都用在水的电解,因而电解液会减少,此时应以纯水补充之。
3.充放电总反应
铅酸蓄电池充、放电的总化学反应式为

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




