从图4-3可以看出,当改变环境温度T0分别为T1、T2、T3时,放热曲线Q放和散热曲线Q散之间的关系有3种情况:有A、B两个交点、只有C一个交点、没有交点。现对这3种情况进行简要分析。
(一)当环境温度较低时,如T0=T1
起初系统中的混气温度等于环境温度T1,所以散热速度为零,但这时化学反应是在缓慢进行的。随着化学反应的进行,释放出少量热量,使混气温度上升,与环境之间产生温差,开始向环境散热。由于此时放热速度大于散热速度,混气温度将不断上升,直到等于TA。此后混气温度将保持稳定,因为当混气温度高于TA时,放热速度小于散热速度,混气温度将下降,回到TA。由此可以看出,A点是一个可以达到的稳定点,它实际上代表一种化学反应速度很小的缓慢氧化状态。显然,在这样的初始条件下,混气的温度不会自动持续升高,反应也不能自动加速而着火,这说明混气还不具备着火的条件。
从A点到B点的过程中,散热速度一直大于放热速度。因此,如果仅依靠自身的反应,混气温度不可能继续升高,所以B点是达不到的。另外B点是一个不稳定点,如果有一个微小增温扰动,使混气温度略大于TB,这时由于放热速度总大于散热速度,混气温度将会越来越高;如果有一个微小降温扰动,使混气温度略低于TB,这时由于散热速度总大于放热速度,混气温度将会越来越低,直至返回TA。
(二)当环境温度较高时,如T0=T3
这时由于放热速度总是大于散热速度,混气温度将会不断升高,化学反应不断加速,最后必然导致着火。
(三)当环境温度恰好时,如T0=T2
这时,放热曲线Q放和散热曲线Q散刚好相切于C点。分析C点可以发现它具有以下重要特点:
(1)C点能达到。因为在C点以前放热速度总是大于散热速度,混气温度会从T2自动升高到TC。
(2)C点是一个不稳定点。如果有一个微小增温扰动,使混气温度略大于TC,则因放热速度总大于散热速度而使混气温度自动升高,化学反应速度自动加速,直至着火。(https://www.xing528.com)
由上述分析可以得出热自燃理论的一个重要结论:T2是发生着火的临界温度(即着火的初温条件),超过这个温度,混气就会自动升温、反应自动加速,最终着火。在分析中,是保持压力和换热系数恒定,由此得出着火的临界温度。进一步分析可知,若保持压力和环境温度恒定,则可得出着火的临界换热系数;若保持环境温度和换热系数恒定,则可得出着火的临界压力,如图4-4、图4-5所示。

图4-4 着火的临界换热系数
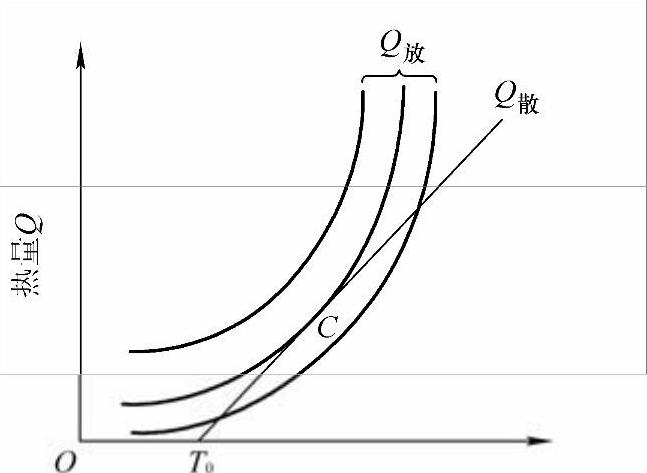
图4-5 着火的临界压力
对于临界点C,还可以看出:在C点以前,由于放热速度与散热速度之差越来越小,因此,从T2到TC是一个缓慢升温的过程;而在C点以后,由于放热速度与散热速度之差越来越大,因此,会出现急剧升温。C点标志着由低温缓慢氧化状态到高温剧烈燃烧状态的过渡,也就是说混气在C点以后一定会着火,TC则是可能出现火焰的最低临界温度,可近似取TC为混气的自燃温度(自燃点)。自燃点TC与很多因素有关,它受混气的性质、放热速度和散热速度等因素影响,如图4-6所示。如果在实验时将外界条件固定,那么自燃点TC就只与混气的性质有关,此时测得的自燃点TC就可以用来评定可燃预混气体的自燃难易程度。
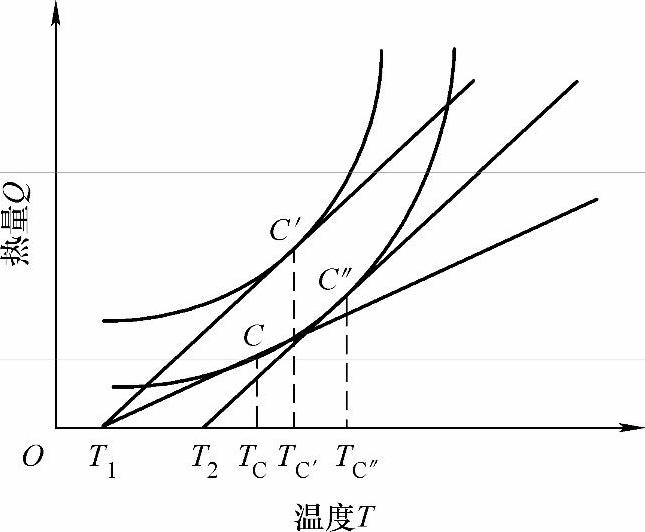
图4-6 放热速度和散热速度对自燃点的影响
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




