燃烧反应是一种氧化还原反应,其反应速度方程可以根据化学反应动力学理论得到。
(一)质量作用定律
对于简单反应
aA+bB=cC+dD
其反应速度在恒温条件下与反应物浓度(以方程式中该反应物的系数为指数)的乘积成正比,称为质量作用定律,数学表达式为
Ws=kCaACbB (2-1)
式中 Ws——化学反应速度[mol/(L·s)];
CA——A反应物的物质的量浓度(mol/L);
CB——B反应物的物质的量浓度(mol/L);
k——反应速度常数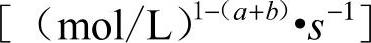 。
。
a和b之和n称为反应级数。若n=2,则称该反应为二级反应,其余类推。
(二)阿累尼乌斯公式
化学反应速度常数k随温度增加而增加,其关系就是阿累尼乌斯公式
式中 K0——频率因子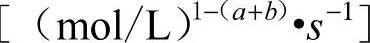 ;(https://www.xing528.com)
;(https://www.xing528.com)
E——反应活化能(J/mol);
R——摩尔气体常数[8.314J/(mol·K)];
T——反应绝对温度(K)。
(三)燃烧反应速度方程
将阿累尼乌斯公式代入质量作用定律得
从式(2-3)可以得出:
(1)在火灾现场氧气和可燃气体的浓度越低,燃烧反应速度越慢。在关闭房门的房间内,由于氧气浓度很低,所以燃烧反应进行得就很缓慢。当氧气浓度下降到一定浓度时,绝大多数燃烧都会熄灭。
(2)火灾现场温度越低,燃烧反应速度越慢,这是降温灭火法的依据。温度越低,燃烧中的自由基增长速度越慢,同时液体的蒸发、固体可燃物的裂解挥发速率下降,这些都不利于燃烧的进行。
(3)可燃物反应活化能E越高,燃烧反应速度越慢。反应活化能E是用来破坏反应物分子内部化学键所需要的能量,可燃物内部化学键越牢固,需要的活化能就越大,反应速度也就越慢。
【思考与练习题】
1.燃烧的基本特征和本质是什么?
2.简述燃烧与氧化的关系。
3.影响燃烧反应速度的因素有哪些?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




