影响酶促反应速度的因素有很多,诸如温度、pH值、底物浓度、酶浓度、抑制剂和激活剂等。
2.2.5.1 底物浓度的影响
根据Henri的“酶——底物中间复合体”学说,酶促反应中,酶先与底物形成中间复合物,再转变成产物,并重新释放出游离的酶。
![]()
在酶浓度恒定的条件下,底物浓度比较小的时候,酶没有被底物饱和,此时的反应速度取决于底物的浓度,底物的浓度越大,单位时间内生成的SE越多,而反应速度取决于SE的浓度,故反应速度也随之增高。当底物浓度加大后,酶逐渐被底物饱和,至底物增加到极大值时,所有的酶分子均被底物饱和,此时的反应速度不会再增高。我们用[S]对V作图,见图2.4。
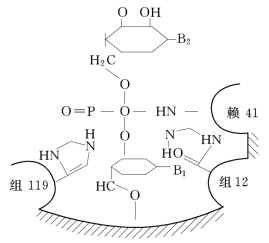
图2.3 牛胰核糖核酸酶的活性中心
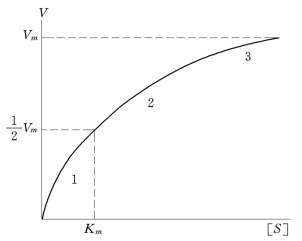
图2.4 底物浓度与酶反应速度的关系
图2.4中曲线可分为三段:第一段:反应速度与底物浓度呈正比关系,表现为一级反应;第二段:介于零级及一级之间的混合反应;第三段:接近零级反应,当底物浓度远远超过酶浓度([S]≫[E])时,反应速度也达到极限值。
根据中间复合物理论,Michaelis和Menten对图2.4的曲线加以数学处理,提出了酶促反应动力学的基本原理,即米氏方程:
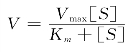
米氏方程反映了底物浓度与酶促反应速度间的定量关系,式中Vmax为最大反应速度,[S]为底物浓度,Km为米氏常数,V为底物浓度不足以产生最大速率时的速度。
当酶促反应处于V=1/2Vmax时,则米氏方程为:
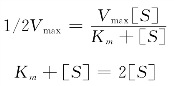
故
Km=[S]
上式说明:米氏常数Km为酶促反应达到最大反应速度一半时的底物浓度。它的单位是mol/L,是酶的特征性常数。Km受温度、pH值和离子强度的影响。
已知某个酶的Km,可以计算出在某一底物浓度时,某反应速度相当于最大速度的百分率。例如:当[S]=3Km时代入![]() 式得:
式得:
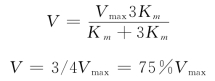
需要说明的是:一种酶如果有几种底物,就有几个Km,Km值最小的底物称为该酶的最适底物。一般用Km值近似的表示酶对底物亲和力的大小,Km愈小,表示酶对该底物的亲和力愈大,酶促反应愈易于进行。
Km的值受温度、pH值和离子强度的影响。
2.2.5.2 pH值的影响
酶在适宜的pH值范围内表现出活性,过高过低的pH值会改变酶的活性中心的构型,使其变性或失去活性。pH值还可以改变底物分子和酶分子的带电状态,影响酶和底物的结合。
2.2.5.3 温度的影响
酶在适宜的温度范围内活性最强,酶促反应速率在适宜的温度范围内,温度每升高10℃,酶促反应的速率可相应提高1~2倍。(https://www.xing528.com)
过高的温度可以破坏或者使酶发生不可逆变性,从而使酶的催化作用完全丧失。过低的温度只降低酶的活性,但不会使酶失去活性;当提高到合适的温度,酶的活性就会恢复。
2.2.5.4 酶浓度的影响
由米氏公式可以看出,酶促反应速度与酶分子的浓度成正比。当底物浓度足够时,酶分子越多,底物转化的越快。但是实际反应并不是这样,原因可能是高浓度的底物夹带有较多的抑制剂所致。
2.2.5.5 激活剂的影响
凡是能提高酶的活性,加速酶促反应进行的物质都是激活剂。激活剂可以是无机的阴离子和阳离子(Na+、K+、Ca2+、Mg2+、Cu2+、Fe3+、Cl-、Br-、I-、![]() 等);也可以是一些小分子的有机物,如抗坏血酸等。
等);也可以是一些小分子的有机物,如抗坏血酸等。
许多酶只有当某一种适当的激活剂存在时,才能表现或强化其催化活性;即激活剂对酶的激活作用。酶的激活作用是相对的,一种酶的激活剂对另一种酶来说,也可能是一种抑制剂。
2.2.5.6 抑制剂的影响
凡是能减弱、破坏酶活性的物质称为酶的抑制剂。酶的抑制剂有重金属离子(如Ag+、Cu2+、Hg2+等)、一氧化碳、硫化氢、氰氢酸、氟化物、EDTA和表面活性剂等。
对酶促反应的抑制可以分为可逆抑制和不可逆抑制两种。
1.可逆抑制
抑制剂先与酶的活性中心结合,从而降低酶促反应的速度。这种抑制可以通过增加底物浓度被解除,恢复酶的活性。
可逆抑制分为竞争性抑制作用、非竞争性抑制作用和反竞争性抑制作用。
(1)竞争性抑制。抑制剂I和底物S对游离的酶E有竞争作用,互相排斥,结合I就不能结合S,结合S就不能结合I。这种情况往往是抑制剂和底物争夺同一位置。如果两者结合的位置不同,但是由于空间障碍使得I和S不能同时结合到酶分子上,故不可能存在IES三联复合体。
(2)非竞争性抑制。底物S和抑制剂I与酶的结合互不相关,即不排斥,也不促进,S可以与游离E结合,也可以和复合体EI结合;同样I也可以与游离E结合,也可以与ES复合体结合,但是IES不能释放出产物。
(3)反竞争性抑制。抑制剂I不与游离酶E结合,却和ES中间复合体结合成EIS不能释放出产物。
竞争性抑制与非竞争性抑制的区别如图2.5所示。
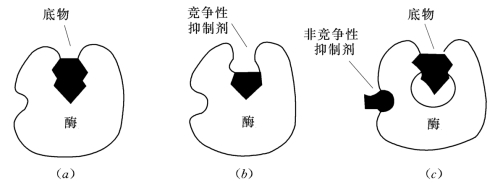
图2.5 竞争性抑制剂与非竞争性抑制剂的区别
(a)酶—底物复合物;(b)竞争性抑制剂阻止底物与酶结合;(c)非竞争性抑制剂阻止底物与酶结合
2.不可逆抑制
抑制剂和酶活性中心以外的位点结合后,底物仍然可以与酶的活性中心结合,但是酶不显示活性。这种抑制是不可逆的,增加底物浓度并不能解除对酶活性的抑制。
不可逆抑制分为专一性不可逆抑制和非专一性不可逆抑制。
(1)专一性不可逆抑制。抑制剂专一作用于酶的活性中心或其必需基团,进行共价结合,从而抑制酶的活性。
(2)非专一性不可逆抑制。抑制剂与酶分子中的一类或几类基团作用,无论是不是必需基团,皆进行共价结合。由于酶的必需基团也被抑制,故可以使酶丧失活性。
有一些物质是一种酶的抑制剂,同时又是另一种酶的激活剂。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




