【摘要】:蓄电池由正极板 和负极板 浸入电解液 中而形成, 其内部的化学反应是可逆的。根据“双硫化理论”, 蓄电池放电时, 两极板上的活性物质与电解液发生作用后都转变成了硫酸铅, 电解液密度下降; 而充电时,两极板上的PbSO4 又分别恢复为原来的PbO2 和Pb, 电解液密度回升, 略去中间化学反应过程, 可用下列化学式表示。充电终期, 电解液密度将升到最大值, 且会引起水的电解。蓄电池充电时要保证气流畅通和充电室通风。
蓄电池由正极板(PbO2) 和负极板(海绵状Pb) 浸入电解液(H2SO4 的水溶液) 中而形成, 其内部的化学反应是可逆的。 根据“双硫化理论”, 蓄电池放电时, 两极板上的活性物质与电解液发生作用后都转变成了硫酸铅(PbSO4), 电解液密度下降; 而充电时,两极板上的PbSO4 又分别恢复为原来的PbO2 和Pb, 电解液密度回升, 略去中间化学反应过程, 可用下列化学式表示。
负极板处有少量的PbSO4 溶入电解液中, 离解为Pb2+和SO , 即
, 即
Pb2+在电源的作用下获得2e-变为Pb, 沉附在负极板上, 而H+则与电解液中的SO 结合, 生成H2SO4, 即
结合, 生成H2SO4, 即
负极板上的总反应为
正极板处, 也有少量PbSO4 溶入电解液中, 离解为Pb2+和SO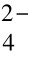 , Pb2+在电源的作用下失去2e-变为Pb4+, Pb4+又和电解液中的H2O 离解出来的OH-结合, 生成Pb (OH)4,Pb (OH)4 又分解为PbO2 和H2O, 而SO
, Pb2+在电源的作用下失去2e-变为Pb4+, Pb4+又和电解液中的H2O 离解出来的OH-结合, 生成Pb (OH)4,Pb (OH)4 又分解为PbO2 和H2O, 而SO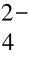 又与电解液中的H+结合生成H2SO4。(https://www.xing528.com)
又与电解液中的H+结合生成H2SO4。(https://www.xing528.com)
正极板上的总反应为
可见, 在充电过程中, 正、负极板上的PbSO4 将逐渐恢复为PbO2 和Pb, 电解液中的H2SO4 成分逐渐增多, H2O 逐渐减少, 电解液密度上升, 当正负极板上的H2SO4 全部转变为PbO2 和Pb 时, 充电过程结束。
充电终期, 电解液密度将升到最大值, 且会引起水的电解。 蓄电池充电时要保证气流畅通和充电室通风。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




