蓄电池是一种储存电能的装置,是一个化学电源,它输出的电流是直流电。一旦连接外部负载(称为放电)或接通充电电路(称为充电),它便开始了能量转换过程。在放电过程中,蓄电池中的化学能转变成电能;在充电过程中,电能被转变成化学能。
1)蓄电池的主要用途
①在启动发动机期间,它为启动系统、点火系统、电子燃油喷射系统和仪表等汽车的其他电器设备供电。
②当发动机停止运转或低怠速运转时,由它给工程机械用电设备供电。
③当出现用电需求超过发电机供电能力时,蓄电池也参加供电。
④蓄电池起到了整车电气系统的电压稳定器的作用,能够缓和电气系统中的冲击电压,保护汽车上的电子设备。
⑤在发电机正常工作时,蓄电池将发电机发出多余的电能存储起来——充电。
2)普通型蓄电池的结构
蓄电池由正极板、负极板、隔板、电解液、电池盖板、联条、加液孔塞和电池外壳组成,如图2.2、图2.3所示。蓄电池一般分隔为3个或6个单格,每个单格电池的标称电压为2 V,将3个或6个单格电池串联后制成一只6 V或12 V蓄电池总成。目前,装在汽油发动机的汽车上使用的是由6个单格电池组成的12 V蓄电池,装在柴油发动机的汽车上使用的是由两个12伏蓄电池串联而成的24 V电源电池。
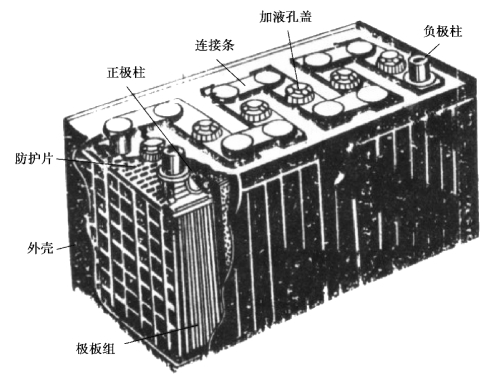
图2.2 蓄电池的结构(一)
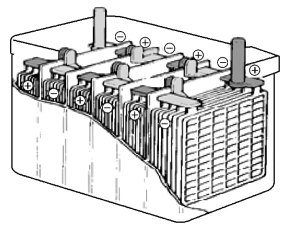
图2.3 蓄电池的结构(二)
蓄电池主要参与化学反应的活性物质:正极板上的是二氧化铅,呈深棕色;负极板上的是海绵状铅,呈青灰色。因为正极板化学反应剧烈,所以在单格电池中,负极板总比正极板多一片。每一片正极板都处于两片负极板之间,保持其放电均匀,防止变形。
电解液是由密度为1.84 g/cm3 的化学纯净硫酸和蒸馏水按一定比例配制而成的,在20 ℃标准温度下,蓄电池电解液的密度一般为1.23~1.30 g/cm3,使用中密度的大小根据地区、气候条件(低气温选高密度;高气温选低密度。在不致结冰的情况下尽量选较低密度的电解液)和制造厂要求而定。不允许用工业硫酸和自来水、井水、河水等配制,其杂质多,易引起自放电,从而影响蓄电池寿命。
隔板将相互依靠的正负极板隔开,防止正负极板相互接触而短路。隔板材料应具有良好的耐酸性和抗氧化性。常用的隔板有木质隔板、微孔橡胶隔板、微孔塑料玻璃纤维和纸板等。通常隔板一面带有沟槽,安装时有沟槽面应对着正极板,且与底部垂直,以便电解液的流通、脱落活性物质的下沉及气泡的逸出。
联条的作用是将单格蓄电池串联起来,提高整个蓄电池的端电压。联条一般由铅锑合金铸造而成,硬橡胶外壳蓄电池的联条位于电池上方,塑料外壳蓄电池则采用穿墙式联条。
壳体用于盛装电解液和极板组。外壳应耐酸、耐热、耐振动冲击。外壳有橡胶外壳和聚丙烯塑料两种,普遍采用的是塑料外壳。外壳为整体式结构,壳内间壁分成3个或6个互不相通的单格。蓄电池单格电池之间均用铅质联条串联。(https://www.xing528.com)
蓄电池的每一个单格都有一个加液孔,为加注电解液和检测电解液密度所用,孔盖上有通气孔,该小孔应经常保持畅通,以便随时排除蓄电池化学反应放出的氢气和氧气,防止外壳涨裂和发生事故。
为了便于区分,正接线柱附近标有“+”或“P”记号,负接线柱附近标有“-”或“N”记号,有些蓄电池正接线柱上涂有红色油漆。
3)蓄电池的工作原理
如图2.4所示,蓄电池的工作过程就是化学能与电能的相互转化过程。当蓄电池将化学能转化为电能而向外供电时,称为放电过程;当蓄电池与外界直流电源相连而将电能转化为化学能储存起来时,称为充电过程。蓄电池的充放电过程中的化学反应是可逆的,总的反应式为
![]()
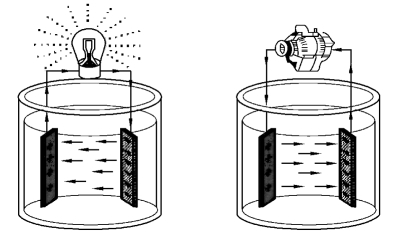
图2.4 蓄电池的充放电过程
(1)蓄电池充电
充电过程是蓄电池与外接直流电源连接后,将放电时生成的硫酸铅和水还原成活性物质和硫酸的过程,如图2.5所示。
当蓄电池充足电时,正极板上的硫酸铅还原成活性物质——二氧化铅,负极板上的硫酸铅还原成活性物质——纯铅。电解液中水消耗,还原成硫酸。蓄电池的电量恢复,如图2.5所示。
(2)蓄电池放电
放电过程是蓄电池与用电设备电路接通时,正极板上的二氧化铅、负极板上的纯铅与电解液反应生成硫酸铅和水的过程,如图2.6所示。
理论上,放电过程可以进行到极板上的全部活性物质都转变为硫酸铅为止。实际上,由于放电过程中生成的硫酸铅的体积较原活性物质的体积大,先生成的硫酸铅逐渐堵塞极板的孔隙,使电解液不能渗透极板内层,在大部分活性物质没有来得及参加化学反应时放电化学反应就停止了。
汽车用蓄电池放完电时的电压是1.75 V(单格电池电压)。如电压下降到1.75 V以后的放电为过度放电,过度放电会在极板上生成粗结晶的硫酸铅(称为极板硫化故障),它在充电时不易还原,使极板损坏。

图2.5 蓄电池的充电
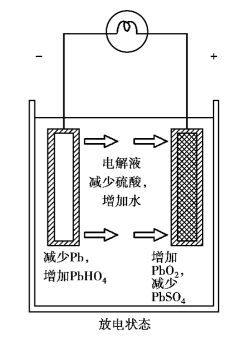
图2.6 蓄电池的放电
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




