【摘要】:如图624所示为在循环试验中活化能随周期的变化趋势,活化能Ea为11~15kJ/mol,其数值与循环工况有关,在整个循环测试过程中基本上为常数。但是有的文献指出加速因子α=2只在试验温度范围为35~85℃的条件下可行。此外,以前有关锂电池的文献也指出锂电池衰退过程中的活化能为43~48 kJ/mol,锂电池在试验温度为0~40℃的加速因子为α=1.7~2.1,所以,锂电池的加速因子为2.2是合理的。
根据图6−23基于阿伦尼乌斯方程的电容衰退比例与循环周期的关系,结果表明衰退比例与循环周期之间具有很好的线性关系,可以推断,在超级电容器替代电池的使用环境中,由于循环中产生的热量几乎可以忽略,因此环境温度主导了衰退速率的变化。由于阿伦尼乌斯方程很好地解释了超级电容器的衰退趋势,因此超级电容器的衰退过程可以通过改变温度来实现。在图6−23中曲线的斜率随着周期的变化趋势较小。因此,超级电容的衰退机制可以看成在整个试验周期试验温度为0~40℃的环境中是均匀变化的。
如式(6−60)或者式(6−61)所示,函数的斜率等于−Ea;超级电容器在每个周期的Ea值由阿伦尼乌斯图像决定。如图6−24所示为在循环试验中活化能随周期的变化趋势,活化能Ea为11~15kJ/mol,其数值与循环工况有关,在整个循环测试过程中基本上为常数。加速因子α=2,意味着随着温度每增加10℃,寿命将减少一半,这是在超级电化学电容器和锂电池测试里面被基本接受的依据。但是有的文献指出加速因子α=2只在试验温度范围为35~85℃的条件下可行。此外,以前有关锂电池的文献也指出锂电池衰退过程中的活化能为43~48 kJ/mol,锂电池在试验温度为0~40℃的加速因子为α=1.7~2.1,所以,锂电池的加速因子为2.2是合理的。
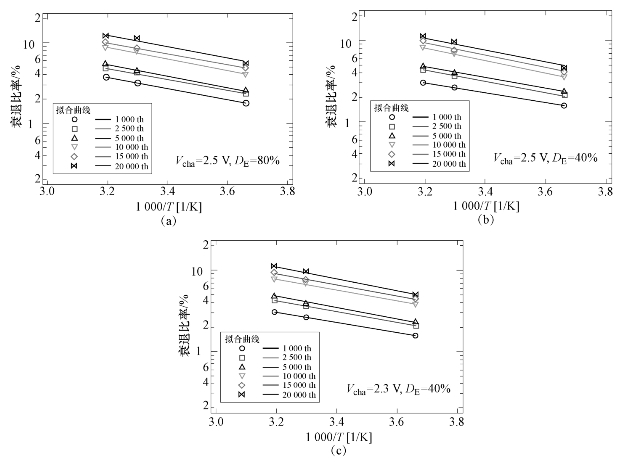
图6−23 基于阿伦尼乌斯方程的循环周期数与衰退比例之间的关系(https://www.xing528.com)
(a)Vcha=2.5V,DE=80%;(b)Vcha=2.5V,DE=40%;(c)Vcha=2.3V,DE=40%
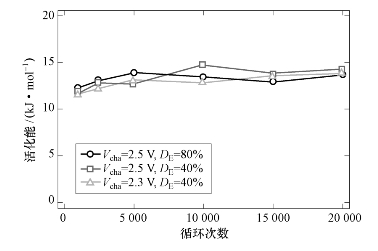
图6−24 循环试验中活化能随周期的变化趋势
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




