1.蓄电池的工作原理
当蓄电池和负载接通放电时,正、负极板间产生电流,正极板上的PbO2和负极板上的Pb均与H2SO4发生化学反应,生成PbSO4,电解液中的H2SO4减少,电解液相对密度下降。当蓄电池充电时,按相反的方向变化,正、负极板上的PbSO4分别恢复成原来的PbO2和Pb,电解液中的硫酸增加,电解液相对密度变大。上述可逆化学反应可用下式表示
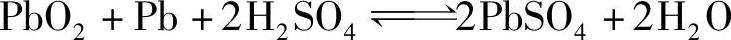
1)电势的建立。极板与电解液发生化学反应,当化学反应达到平衡时,负极板具有负电位,约为-0.1V;正极板具有正电位,约为+2.0V。因此,当外电路未接通,反应达到相对平衡状态时,蓄电池的静止电动势约为
E0=2.0-(-0.1)=2.1(V)
2)铅蓄电池的放电。当蓄电池接上负载后,正极板上的PbO2和负极板上的Pb都逐渐转变为PbSO4,电解液中的H2SO4逐渐减少而水和PbSO4增多,故电解液相对密度下降。在电动势的作用下,电流从正极经过负载流往负极(即电子从负极到正极),使正极电位降低,负极电位升高,破坏了原有的平衡。蓄电池放电时的化学反应过程如图2-6所示。
3)铅蓄电池的充电。当蓄电池接直流电源后,正、负极板上的PbSO4逐渐恢复为PbO2和Pb,电解液中硫酸成分逐渐增多,水逐渐减少。电源电压高于蓄电池电动势,在直流电源电压作用下,电流从蓄电池正极流入,负极流出(即驱使电子从正极经外电路流入负极)。这时正、负极板发生的反应正好与放电过程相反,其化学反应过程如图2-7所示。
2.蓄电池的工作特性
蓄电池的工作特性主要包括蓄电池的电动势,内阻及充、放电特性。
1)静止电动势。静止电动势是指蓄电池在静止状态(不充电也不放电)下正、负极板之间的电位差(即开路电压),其值取决于电解液的密度和温度,当相对密度在1.050~1.300的范围内时,可由下述公式计算其近似值:E0=0.85+ρ25℃(25℃时的电解液密度)。汽车用蓄电池的电解液相对密度在充电时增高,放电时下降,一般在1.12~1.30之间波动,因此,蓄电池的静止电动势也相应地变化在1.97~2.15V之间(静止电动势不等于电源电动势)。
2)内阻。蓄电池的内阻是包括了极板电阻、电解液电阻、隔板电阻(隔板电阻因所用的材料而异)、连条和极柱电阻的总和,用R0表示。蓄电池的内阻大小反映了蓄电池带负载的能力。
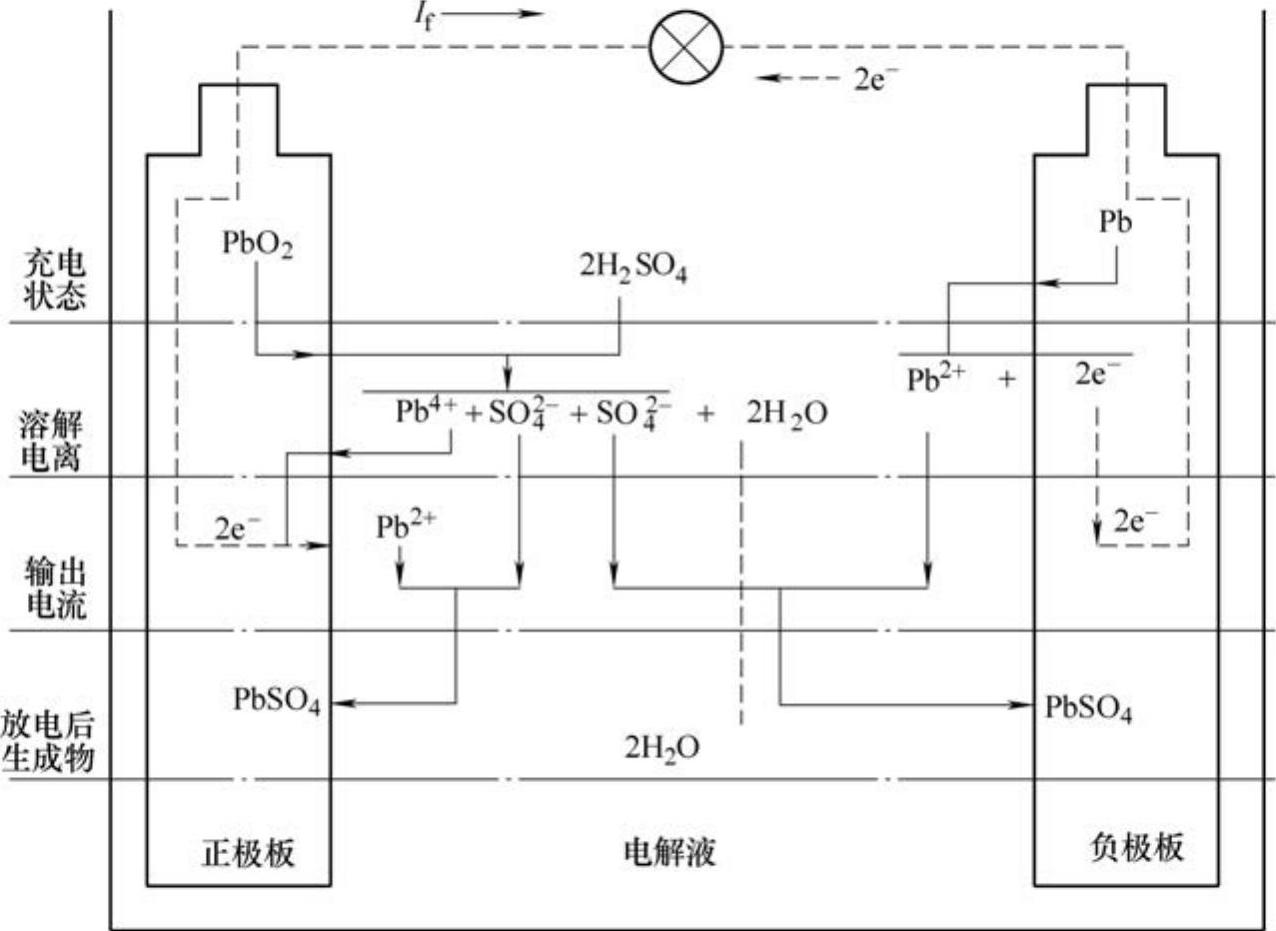
图2-6 蓄电池放电时的化学反应过程
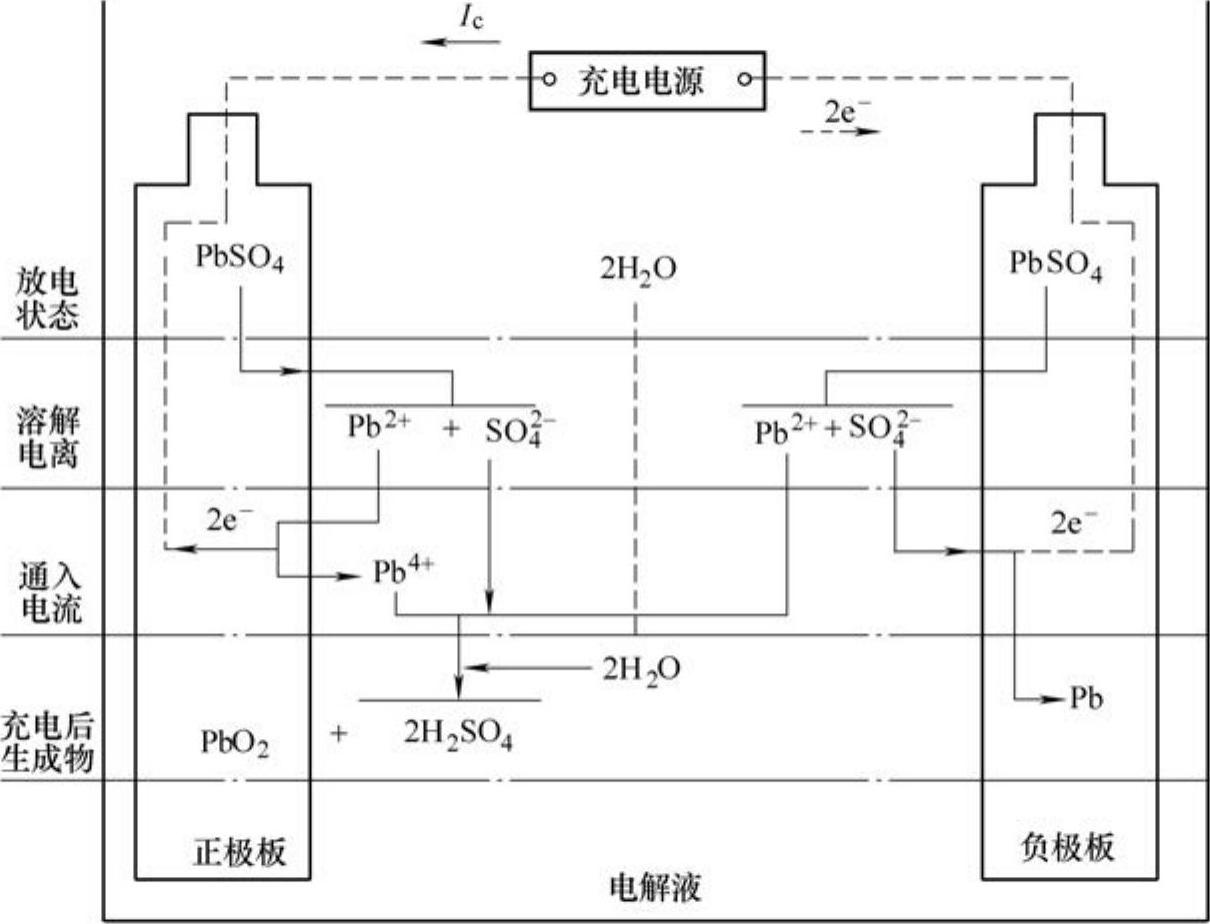
图2-7 蓄电池充电时的化学反应过程
在相同的条件下,内阻越小,输出电流越大,带负载能力越强。图2-8所示为电解液内阻随相对密度变化的关系曲线。相对密度为1.2时(15℃),硫酸的离解度最好,黏度较小,电阻也最小。
3.充电特性
蓄电池的充电特性是指在恒流充电过程中,蓄电池的端电压Uc和电解液密度随充电时间而变化的规律。图2-9所示为蓄电池充电的特性曲线。
充电时电源电压必须克服蓄电池的电动势和蓄电池内阻产生的电压降IcR0,因此,充电过程中蓄电池的端电压总是大于蓄电池的电动势,即Uc=E+IcR0。蓄电池的充电大致经过四个阶段。
第一阶段:开始充电阶段,端电压迅速上升。
第二阶段:稳定上升阶段,端电压随电解液密度上升而相应提高。(https://www.xing528.com)
第三阶段:迅速上升阶段,水电解产生的H以离子状态和极板之间产生附加电阻(0.4),将形成沸腾现象。
第四阶段:充电停止后,端电压逐渐下降至静止电动势。
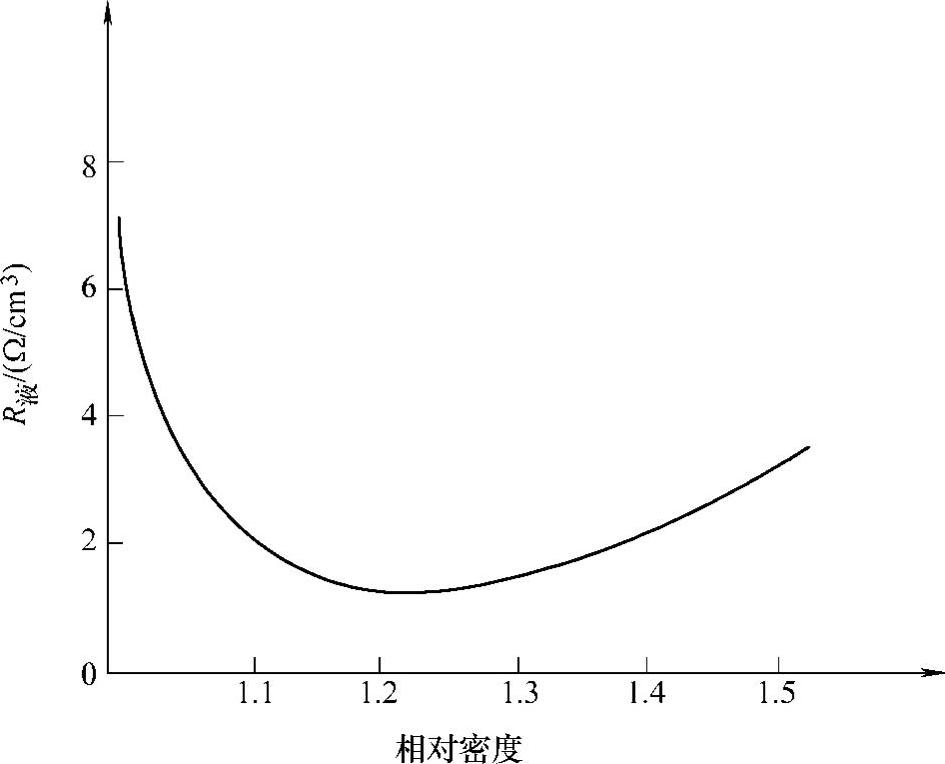
图2-8 电解液内阻随相对密度变化的关系曲线
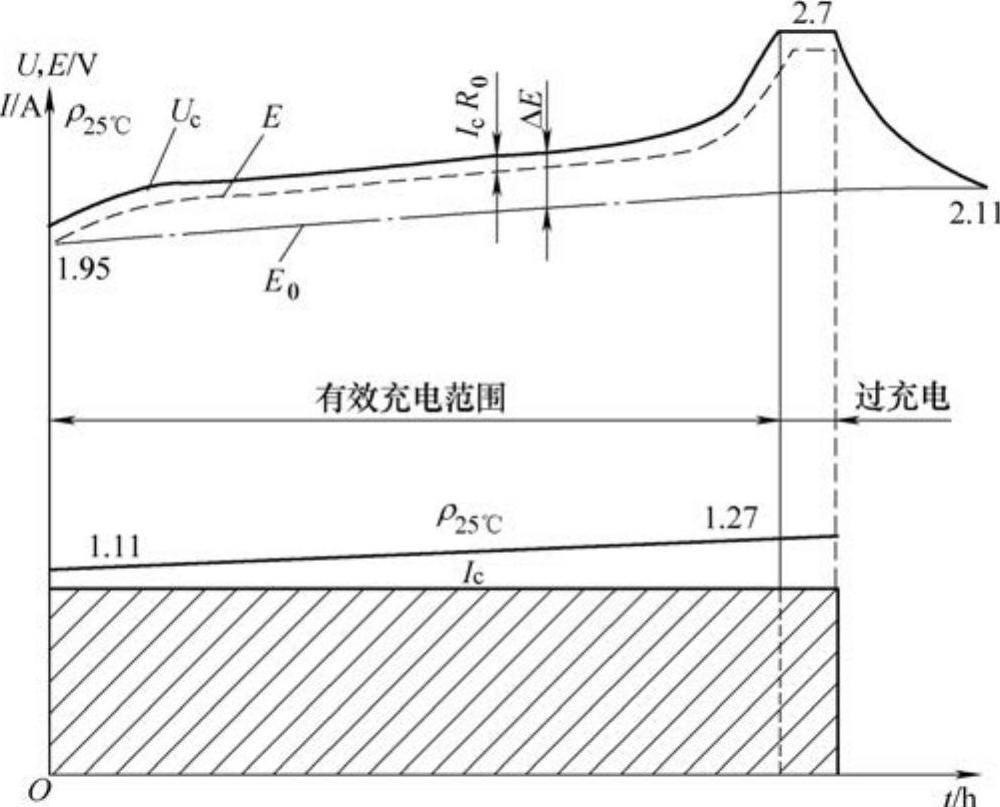
图2-9 蓄电池充电的特性曲线图
蓄电池充电终了的特征是:
1)蓄电池内产生大量气泡,呈“沸腾”状。
2)端电压和电解液相对密度均上升至最大值,且2~3h内不再增加。
4.放电特性
蓄电池的放电特性是指在恒流放电过程中,蓄电池的端电压Uf和电解液相对密度随时间而变化的规律。图2-10所示为蓄电池的放电特性曲线。
放电过程中,由于蓄电池内阻R0上有压降,所以,蓄电池的端电压总是小于其电动势E,即Uf=E-IfR0。式中,Uf是放电时蓄电池的端电压;E是放电时蓄电池的电动势;If是放电电流;R0是蓄电池的内阻。
第一阶段:开始放电阶段,电压下降较快。
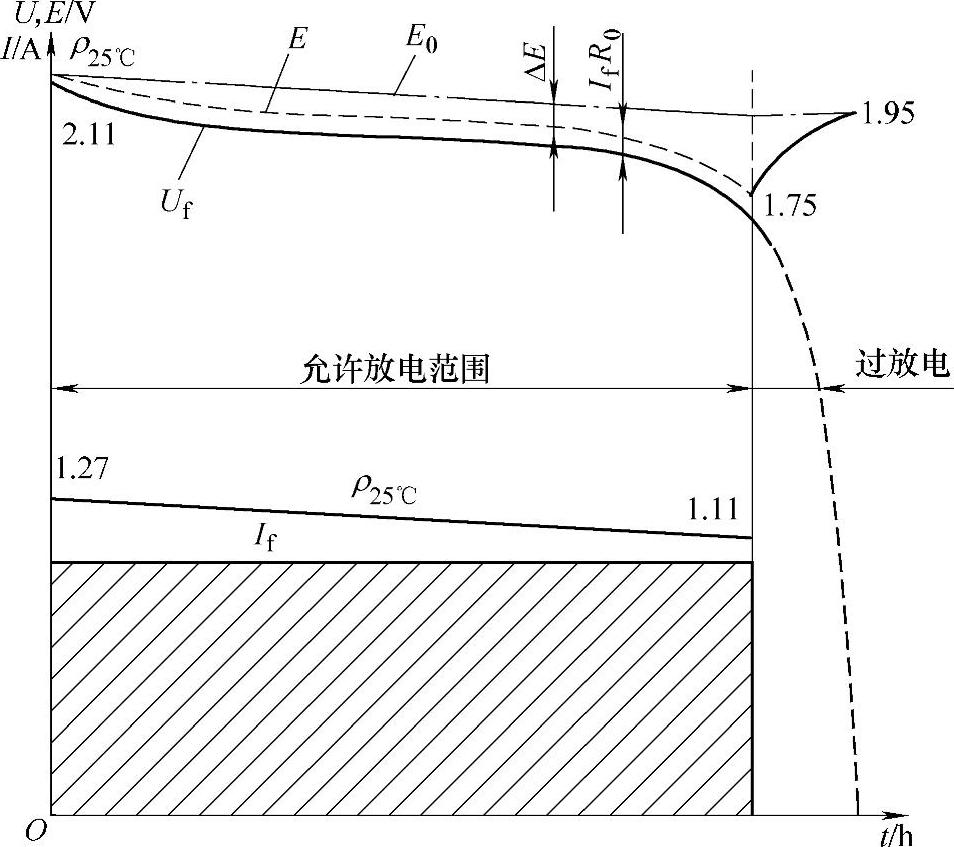
图2-10 蓄电池的放电特性曲线
第二阶段:相对稳定阶段,电压缓慢下降。
第三阶段:迅速下降阶段,放电终了,密度迅速下降,端电压也急剧下降。
蓄电池放电终了的特征是:
1)电解液相对密度下降到最小许可值。
2)单体电池的端电压降至放电终止电压。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




