1.腐蚀机理
海洋环境中钢结构的腐蚀机理既可以从电化学腐蚀角度来解释,也可以从热力学角度来解释。
(1)电化学腐蚀原理。从海洋环境腐蚀的角度来看,海洋环境中的物理因素(如温度、阳光照射强度、海浪冲击、海水流速、泥沙磨蚀等)、化学因素(如氯盐、海洋污染物质等)、生物因素(如腐蚀性细菌产生的代谢产物、形成的生物膜和生物污损等)均可对金属腐蚀的发生过程产生影响。海洋腐蚀本质上是一种电化学腐蚀过程。电化学腐蚀是指金属与电解质发生电化学反应而引起的金属损耗。电化学腐蚀过程中,同时存在着两个相对独立的反应过程——阳极反应和阴极反应,并有电流产生。
钢结构在海洋环境的5个环境分区中都有电化学腐蚀发生,这个电化学腐蚀过程与电解质电池反应相同,构成这种反应的3个要素是阳极、阴极及导电解质。钢铁是铁元素和渗碳体的混合物,铁元素的电位较低,渗碳体的电位较高,电位不等的两种元素在电解质溶液的作用下,构成了以铁元素为阳极,渗碳体为阴极的微电池网络,产生电流。在阳极区,由于极性水分子的作用,铁素体被析出,呈自由状态的铁离子因而进入溶液,这就是金属的活性溶解过程。在阴极区,由于电位差的作用,阳极区的电子经钢铁本体流到阴极,被溶液中的某些物质所吸收。在通常情况下,溶液的p H值大于4时,表现为氧的还原;当溶液的p H值小于4时,则表现为氢的析出。阳极产物铁离子与阴极产物氢氧根离子相结合,生成初步的腐蚀产物氢氧化亚铁而沉淀,氢氧化亚铁进一步为溶液中的氧所氧化,转变为氢氧化铁(即铁锈)。氢氧化铁的溶解度较小,呈疏松的薄膜状包裹于钢铁的表面,有一定的保护作用,但抗渗能力很弱,性质不稳定,当溶液中有充足的氧气供应时,则腐蚀过程一直进行,直至钢铁成为铁锈为止[23]。
(2)热力学原理。海洋腐蚀是金属和周围海洋环境发生化学或电化学反应而产生的一种破坏性侵蚀。金属发生腐蚀同时也由它本身的性质所决定。任何一种元素,包括金属元素和非金属元素在自然界都有一种最稳定状态,即能量最低状态。如果用某种方法,例如通过化学法或电化学法改变元素的状态,使其成为较高能量状态,则该元素具备了一种恢复到稳定态的能量,一旦条件合适便自发地回到原来状态,这就像水总是要流到最低处,即恢复到能量最低状态一样。如果把水用某种方法提到较高的位置,则水便具备了一种回到原来状态(低处)的能量(势能),一旦条件合适,水便自发的从高处流向低处,恢复到原来的状态。
采用上述原理进行钢结构腐蚀分析时,钢是由铁制成的,而铁是在高炉中用焦炭中的碳对赤铁矿(Fe2O3)还原而得到的。铁锈是铁氧化物的水合物,其成分类似于赤铁矿,从而可以解释在大多数情况下钢为何容易生锈,可以认为这个生锈的过程就是形成钢铁原始矿石的自然反应。由于自然界的矿石更为稳定,因此钢铁有转变为其原始状态的趋势。这种腐蚀过程热力学计算的反应趋向与化学系统的平衡态以及所发生的能量变化有关,这个过程的反应方向也可以用热力学上的吉布斯自由能判据来描述。
从热力学观点看,海洋腐蚀是由于金属与其周围介质构成一个热力学不稳定的体系,此体系有自发的从这种不稳定状态趋向稳定状态进行的倾向,并且对不同金属而言,这种倾向性的大小也各不相同,甚至相差很大。根据热力学第二定律,可以通过腐蚀反应的吉布斯自由能的变化ΔGTgP定量描述这种倾向性的大小,并且当ΔGTgP<0,表示该反应可能自发发生,且ΔGTgP越负,反应的可能性越大,金属越活跃。当ΔGTgP>0,则表示该反应不可能自发发生,且ΔGTgP越正,反应的可能性越小,金属越稳定[16]。
2.防护机理
海洋钢结构设施所处环境是极度严峻的腐蚀环境,由于钢材本身具有易腐蚀这一特性,在较长的设计使用期内,必须采取切实可行的防腐蚀对策来保护结构物。目前,海洋钢结构的防腐蚀方法主要有阴极保护、防腐涂料保护和包覆保护等三大类。对于海上测风塔而言采用包覆保护措施的极少,下面针对前面两类防护措施进行机理介绍。
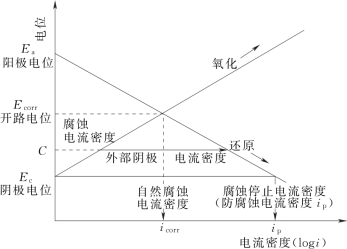
图8-11 阴极保护原理概念图[17](https://www.xing528.com)
(1)阴极保护法。阴极保护技术是电化学保护技术的一种,主要用于水下区和泥下区。其原理是向被腐蚀金属结构物表面施加一个外加电流,被保护结构物成为阴极,从而使得金属腐蚀发生的电子迁移得到抑制,避免或减弱腐蚀的发生。该原理可用图8-11说明,在海水中钢铁表面通直流电时,由于极化作用,阴极区的电位便下降。继续增加电流使电位变化到Ea时,钢铁表面全部成为阴极区,金属体便处于完全防蚀状态,这时的电位叫做保护电位。或者说,就是相对于从钢材向电解质(海水)方向流出的腐蚀电流,必须有电流从外部连续不断地流向钢材,以防止钢材出现离子化(腐蚀)的方法[17]。
阴极保护技术分为牺牲阳极保护和外加电流阴极保护。目前该技术已经成熟,被广泛应用于海洋钢结构设施上。
牺牲阳极保护方法是用一种电位比所要保护的金属还要低(负)的金属或合金与被保护的金属连接在一起,依靠电位比较负的金属不断地溶解所产生的电流来保护其他金属。通常纯金属材料作牺牲阳极都存在着某些不足,通过添加其他元素来改性,可以提高其性能,另外有些杂质元素含量会大大降低阳极性能,因而在阳极冶炼时须对这些杂质元素的含量严格控制[17]。工程中常用的牺牲阳极有镁及镁合金、锌及锌合金、铝合金三大类。
外加电流阴极保护系统是在回路中串入一个外设直流电源,借助辅助阳极,将直流电流通向被保护的金属,进而使被保护金属变成阴极,实施保护。由于海水的高电导性为电化学保护方法的电流提供了低电阻通道,使电流均匀分布,从而起到保护金属材料不受腐蚀。
(2)防腐涂料保护法。涂料是指以流动状态在物体表面形成薄层,待干燥固化后附着于固体表面,形成连续覆盖的膜层物质。其主要成分是黏结剂、颜料和填料,副成分为溶剂、稀释剂和添加助剂。黏结剂是涂料黏结在物体表面而成为膜层的基本材料,主要有油料和树脂两大类。目前使用的黏结剂以合成树脂涂料占多数。颜料和填料是指在漆料中分散或悬浮的固体物质,以改善漆膜的机械强度、耐蚀性、耐磨性、耐热性、降低膨胀系数、收缩率以及使漆膜具有遮盖力和颜色,阻止紫外线、延缓老化、增加强度和降低成本等,有些颜料还具有防蚀、防锈功能,常用于防锈涂料。各种添加剂能赋予涂料特殊的性质,有催干剂、乳化剂、增塑剂等。
海洋环境中主要应用涂料的保护作用,通常防腐蚀涂料由底漆和面漆组成,保护作用主要依靠底漆,而面漆的作用以功能性(防污、抗老化、防霉)和装饰性(美观、光洁)为主。有时还用中间漆,以补充底漆的防锈功能,并对底漆和面漆起“过渡连接”作用。
涂料的保护作用主要包括物理屏蔽作用、阴极保护作用、钝化与缓蚀作用以及抗老化作用等[24]。
1)物理屏蔽作用指通过使环境中的水分、氧气、氯离子、二氧化硫等各种腐蚀剂与金属表面隔离,从而达到防腐蚀的目的。涂料的抗渗透性越好,防腐蚀性也越好,如氯化橡胶、乙烯型涂料等。涂层越厚,涂布道数越多,屏蔽作用越好。此外,涂料的附着能力强,会使金属表面微电池的阳极区和阴极区的电阻增加而提高耐蚀性,如环氧涂料等。
2)阴极保护作用也即牺牲阳极作用,典型的例子是富锌涂料中加入大量锌粉,富铝涂料中加入大量铝粉。一旦有腐蚀介质侵入,锌粉或铝粉便成为牺牲阳极,用锌或铝的电化学作用保护基体金属。这类涂料在海洋环境中已经广泛应用,且被认为是极佳的防锈底漆。
3)钝化、缓蚀作用指某些颜料如铬酸盐、磷酸盐、钼酸盐和红丹等,本身对金属有钝化、化学转化和缓蚀作用。
4)抗老化作用指在涂料中加入防老剂,可以防止紫外线对涂料的破坏作用,改善其抗老化性或耐候性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




