按照《通用硅酸盐水泥》(GB 175—2007)的规定,凡由硅酸盐水泥熟料、0~5%的石灰石或粒化高炉矿渣、适量石膏磨细制成的水硬性胶凝材料均称为硅酸盐水泥。硅酸盐水泥分为两种类型:不掺混合材料,只有熟料和适量石膏的称为Ⅰ型硅酸盐水泥,代号P·I;掺加不超过水泥质量5%的石灰石或粒化高炉矿渣混合材料的称为Ⅱ型硅酸盐水泥,代号P·Ⅱ。
2.2.2.1 硅酸盐水泥的生产与矿物组成
(1)硅酸盐水泥的生产。
生产硅酸盐水泥的原料主要是石灰质原料(如石灰石、白垩等)和黏土质原料 (如黏土、黄土和页岩等)两类,一般常配以辅助原料 (如铁矿石、砂岩等)。石灰质原料主要提供CaO,黏土质原料主要提供SiO2、Al2O3及少量的Fe2O3,辅助原料常用以校正Fe2O3或SiO2的不足。
硅酸盐水泥的生产过程分为制备生料、煅烧熟料、粉磨水泥三个主要阶段,该生产工艺过程可概括为“两磨一烧”,如图2.1所示。
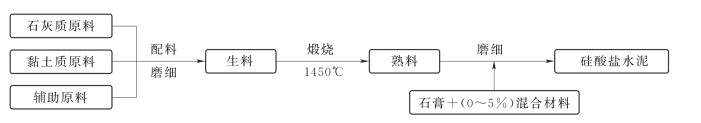
图2.1 硅酸盐水泥的生产过程
制备生料时配料须准确,粉磨细度应符合要求,并且使各种原料充分均化,以便煅烧时各成分间的化学反应能充分进行。
生料在煅烧过程中形成水泥熟料的物理化学过程十分复杂,如图2.2所示,大体可分为下述几个步骤:①生料的干燥与脱水;②碳酸钙分解;③固相反应;④烧成阶段;⑤熟料的冷却。其主要反应过程简述为:生料进入窑中后即开始被加热,水分逐渐蒸发而干燥。当温度上升到500~800℃时,首先有机物质被烧尽,其次是黏土中的高岭石脱水并分解为无定形的SiO2和Al2O3。当温度达到800~1000℃时,碳酸钙进行分解,分解出的CaO即开始与黏土分解产物SiO2、Al2O3及Fe2O3发生固相反应。随着温度的继续升高,固相反应加速进行,逐步形成2CaO·SiO2,3CaO·Al2O3及4CaO·Al2O3·Fe2O3。当温度达1300℃时,固相反应基本完成,这时物料中仍剩余一部分未反应的CaO。然后,温度继续从1300℃升到1450℃,进入烧成阶段,这时3CaO·Al2O3及4CaO·Al2O3·Fe2O3烧至熔融状态,出现液相,把剩余的CaO及部分2CaO·SiO2溶解于其中,在此液相中,2CaO·SiO2吸收CaO形成3CaO·SiO2,这一过程是煅烧水泥的关键,必须达到足够的温度及停留适当长的时间,使生成3CaO·SiO2的反应更为充分,否则,熟料中仍有残余的游离CaO,影响水泥的质量。煅烧完成后,经迅速冷却,即得到熟料。
将熟料加入2%~5%的石膏[2]共同磨细,即得到硅酸盐水泥。
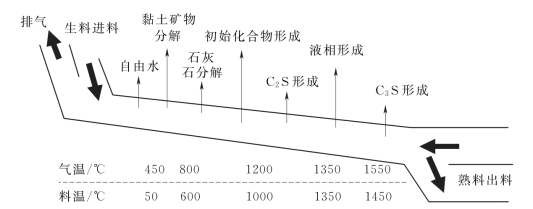
图2.2 水泥熟料煅烧过程示意图
(2)硅酸盐水泥熟料及水泥的矿物成分。
硅酸盐水泥熟料主要由CaO、SiO2、Fe2O3、Al2O3四种氧化物组成,在熟料中占95%,另5%为其他氧化物,如MgO、K2O、Na2O、SO3等。水泥熟料经高温煅烧后,CaO、SiO2、Fe2O3、Al2O3四种氧化物不是以单独的氧化物存在,而是以两种或两种以上的氧化物反应生成的多种矿物的集合体存在。硅酸盐水泥熟料中主要的四种矿物为:硅酸三钙,3CaO·SiO2,简写C3S,占50%~60%,其固熔体俗称阿利特 (Alite)或A矿;硅酸二钙,2CaO·SiO2,简写C2S,占20%~25%,其固熔体俗称贝利特 (Belite)或B矿;铝酸三钙,3CaO·Al2O3,简写C3A,占5%~10%;铁铝酸四钙,4CaO·Al2O3·Fe2O3,简写C4AF,占10%~15%,其固熔体俗称才利特(Celite)或C矿。
这四种矿物成分的主要特征如下:
C3S的水化速率较快,水化热较大,且主要在水化反应早期释放。强度最高,且能随龄期不断得到增长,是决定水泥强度等级高低的最主要矿物。
C2S的水化速率最慢,水化热最小,且主要在后期释放。早期强度不高,但后期强度增长率较高,是保证水泥后期强度增长的主要矿物。
C3A的水化速率极快,水化热最大,且主要在早期释放。早期强度增长率很快,但强度不高,而且以后几乎不再增长,甚至降低,C3A是影响水泥凝结时间的主要矿物之一。
C4AF的水化速率较快,仅次于C3A,水化热中等,强度较低[3]。脆性较其他矿物小,当含量增多时,有助于水泥抗拉强度的提高。
各矿物的抗压强度随时间的发展情况如图2.3所示。
由上述可知,几种矿物成分的性能表现各不相同,它们在熟料中的相对含量改变时,水泥的性质也随之改变。例如,要使水泥具有快硬高强的性能,应适当提高熟料中C3S及C3A的相对含量;若要求水泥的发热量较低,可适当提高C2S及C4AF的含量而控制C3S及C3A的含量。因此,掌握硅酸盐水泥熟料中各矿物成分的含量及特性,就可以大致了解该水泥的性能特点。
对硅酸盐水泥而言,除上述四种主要熟料矿物成分外,其中尚有少量其他成分,对其性能影响比较大的有以下几种。
1)氧化镁 (MgO)。它是一种有害成分,含量多时会使水泥安定性[4]不良。国家标准规定:硅酸盐水泥中MgO的含量一般不得超过5%;若经水泥压蒸安定性试验合格其含量也允许放宽到6%。MgO含量如超过6%时,仍然可通过水泥压蒸安定性试验并合格后在特定工程中使用。
2)三氧化硫 (SO3)。它主要是粉磨熟料时掺入石膏带来的。当石膏掺量合适时,既可以调节水泥的凝结时间,又可以提高水泥的性能;但当石膏掺入量超过一定值时,会使水泥的性能变差。国家标准规定:硅酸盐水泥中SO3的含量不得超过3.5%。
3)游离氧化钙(f—CaO)。它是在煅烧过程中未能反应结合而残存下来的过烧并呈游离态的CaO。如果f—CaO的含量较高,则由于其滞后的水化,产生结晶膨胀而导致水泥石开裂,甚至破坏,即造成水泥安定性不良。通常熟料中f—CaO含量应严格控制在1%~2%以下。
4)氯离子含量。氯离子是影响钢筋锈蚀的关键组分,国家标准规定:在硅酸盐水泥中氯离子含量(质量分数)不得超过0.06%。当有更低要求时,该指标也可以由生产商与用户商定。
此外,碱含量(K2O、Na2O)可以增加水泥浆体pH 值到13.5,对保护钢筋有利。然而,若使用活性骨料时,太高的碱含量会产生碱骨料反应[5]和引起硬化浆体开裂敏感,用户如果需要低碱水泥时,水泥中的碱含量应控制在0.6% (以Na2O+0.658K2O的百分数计算)以下。
2.2.2.2 硅酸盐水泥的水化与凝结硬化
在硅酸盐水泥中,主要矿物由氧化物构成,一般以简写方式表示,各氧化物简写方式约定如下
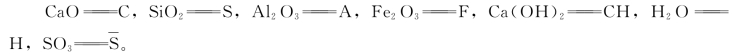
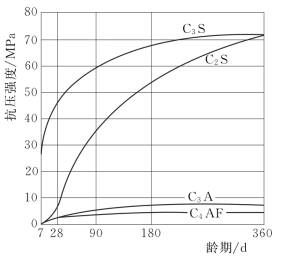
图2.3 水泥熟料矿物的强度增长曲线
(1)硅酸盐水泥熟料矿物的水化。
硅酸盐水泥在水化时产生的化学反应是非常复杂的,为了能较好地了解其水化过程,假定水泥水化时各矿物的水化反应是相对独立的。其水化反应如下。C3S的水化:
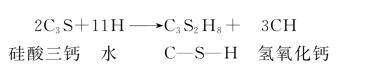
C2S的水化:C3A的水化:
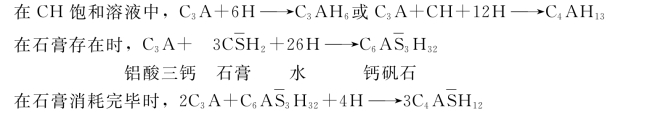
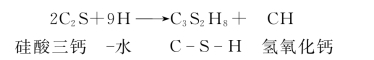
C4AF的水化:

综上所述,如果忽略一些次要和微量成分,则硅酸盐水泥与水作用后生成的主要水化产物有水化硅酸钙、氢氧化钙、水化硫铝酸钙,以及少量的水化铝酸钙、水化铁酸钙等。
(2)凝结硬化。
关于水泥凝结硬化理论的研究至今仍在继续。下面介绍的是硅酸盐水泥凝结硬化的一般过程。
图2.4显示了水泥水化过程中结构的形成过程。在水泥与水拌和初始,水泥颗粒分散于水中,如图2.4 (a)所示,浆体具有一定的可塑性。当经历了不同的龄期之后,水泥水化产生的固相产物(包括C-S-H、氢氧化钙等)逐渐增加,形成逐渐致密的固相结构,如图2.4 (b)~ (d)所示,强度也因此增加。
事实上,水泥凝结硬化的过程非常复杂。当水泥遇水后,水泥颗粒表面即发生水化反应,拌和水立即变为含有多种离子的溶液,此种作用继续下去,使水泥颗粒周围的溶液很快成为水化产物的饱和溶液,这时所消耗的水泥仅是表面很少的一部分。之后,水泥继续水化所生成的产物不能再溶解,而以分散状的凝胶粒子和细小晶体析出,附在水泥颗粒表面,形成水化产物膜包裹层,使水泥在一段时间内反应缓慢,水泥浆的可塑性将维持一段时间。由于水化产物不断增加,凝胶膜不断增厚而破裂,使水泥颗粒重新露出新表面与水反应,此时水泥水化的反应速率有所增加。随着龄期的延长,由水化形成的凝胶与晶体在水泥粒子之间形成了凝聚网状结构,水泥浆开始失去塑性而出现凝结。再继续水化,水泥浆体逐渐硬化,随着水化硅酸钙凝胶等产物的不断增多,并填充硬化水泥石的毛细孔,使毛细孔愈来愈少,水泥石便会具有愈来愈高的强度和胶结能力。
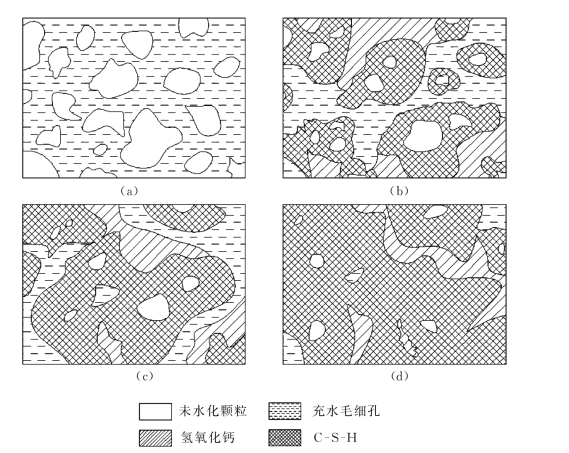
图2.4 水泥凝结硬化过程图
早期的水化硬化速率决定了水泥浆体——水泥石的强度,而强度的发展主要源于硅酸钙的持续水化。实际上,较粗的水泥颗粒内部将长期不能水化。因此,硬化后的水泥石是由水泥水化产物(以C-S-H凝胶占主导)、未水化的水泥颗粒、毛细孔 (毛细孔水)等组成的不均质结构体,如图2.4 (d)所示。C-S-H凝胶并不是绝对密实的,其中约有占凝胶总体积28%的孔隙,称为凝胶孔。凝胶孔较毛细孔小,凝胶孔中的水分称为凝胶水(胶孔水),也属于可蒸发水。
水泥石的各组成部分在数量上的相对含量,主要决定于水泥的水化程度及水灰比 (水与水泥的质量比)。图2.5为两种水灰比的水泥净浆在不同水化程度时水泥石的组成示意图。水泥石中各组成部分所占比率将直接影响水泥石的强度和其他性质。
水泥石强度的增长是随着龄期而发展的,一般在28d之前发展较快,之后发展较慢,3个月以后更为缓慢。但其强度的增长只有在温暖、潮湿的环境中才能持续发展。若处于干燥的环境中,当水分蒸发完毕后,水泥水化作用将无法继续进行,硬化会停止,强度也不再增长。因此,混凝土在浇筑后的2~3周内必须加强洒水养护。
温度对水泥凝结硬化的影响也很大。温度愈高,其凝结硬化的速度愈快,温度较低时,凝结硬化的速度比较缓慢。当温度低至0℃以下时,硬化将完全停止,并可能遭受破坏。因此,冬季施工时需要采取保温等措施。
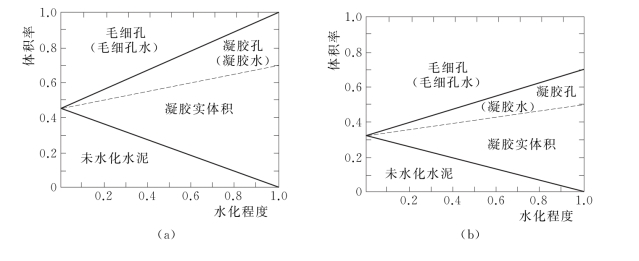
图2.5 不同水化程度水泥石的组成
2.2.2.3 硅酸盐水泥的主要技术性质
(1)密度与堆积表观密度。
硅酸盐水泥的密度一般为3.1~3.2g/cm3,贮藏过久的水泥密度稍有降低。而松散堆积表观密度一般在900~1300kg/m3之间,紧密堆积表观密度可达1400~1700kg/m3。
(2)细度。
细度是指水泥颗粒的粗细程度,是检定水泥品质的主要指标之一。
水泥颗粒的粗细直接影响水泥的凝结硬化速率及强度发展。这是因为水泥加水后,开始仅在水泥颗粒表层进行水化,而后逐步向颗粒内部发展,且是个长期的过程。显然水泥颗粒越细,水化作用的发生就越迅速而充分,凝结硬化的速度越快,早期强度也越高。但磨制特细的水泥将消耗更多的粉磨能量,成本较高,太细的水泥易与空气中的水分及二氧化碳起反应,不宜久置,且在水化硬化后会增加收缩开裂的风险。因此,出厂水泥一般都有适当的细度要求。(https://www.xing528.com)
硅酸盐水泥的细度可用比表面积法来检测,即用1kg水泥所具有的总表面积 (m2/kg)来表示水泥的细度。国家标准规定,硅酸盐水泥的比表面积可用透气法 (勃氏法)测定,其值应不小于300m2/kg。
(3)标准稠度用水量。
由于加水量的多少,对水泥一些技术性质(如凝结时间等)的测定值影响很大,故测定这些性质时,必须在一个规定的浆体稠度下进行。这个规定的稠度即称为标准稠度[6]。水泥净浆达到标准稠度时,所需的拌和水量(以占水泥质量的百分比表示)称为标准稠度用水量(也称需水量)。
硅酸盐水泥的标准稠度用水量一般在24%~30%之间。水泥熟料矿物成分不同时,其标准稠度用水量亦有差别。此外,水泥磨得越细,标准稠度用水量越大。
标准稠度用水量的大小能在一定程度上影响水泥的性能。采用标准稠度用水量较大的水泥拌制同样稠度的混凝土,加水量也较大,故硬化时收缩较大,硬化后的强度及密实度也较差。因此,当其他条件相同时,水泥的标准稠度用水量越小越好。
(4)凝结时间。
水泥的凝结时间有初凝与终凝之分。标准稠度的水泥净浆,自加水时起至水泥浆体塑性开始降低所需的时间称为初凝时间;自加水时起至水泥浆体完全失去塑性所经历的时间称为终凝时间。
水泥的凝结时间在施工中具有重要意义。一般来说,初凝不宜过快,以便有足够的时间在初凝之前完成混凝土各工序的施工操作;终凝不宜过迟,使混凝土在浇捣完毕后,尽早凝结并开始硬化,以利于下一步施工工序的进行。
水泥凝结时间的测定方法详见水泥试验。我国水泥标准规定,硅酸盐水泥的初凝时间不小于45min,终凝时间不大于390min。
(5)体积安定性。
水泥的体积安定性是指水泥在凝结硬化过程中体积变化的均匀性。
水泥熟料中如果含有较多的f-CaO,就会在凝结硬化时发生不均匀的体积变化。这是因为过烧的游离石灰熟化很慢,当水泥已经凝结硬化后它才进行熟化作用,产生体积膨胀,破坏已硬化的水泥石结构,出现龟裂、弯曲、松脆或崩溃等不安定现象。检验水泥安定性的方法有沸煮法及雷氏夹法两种,通过对试件进行煮沸加速f-CaO熟化,然后检查是否有不安定现象(参看水泥试验部分)。
此外,如果水泥中氧化镁及三氧化硫过多时,也会产生不均匀的体积变化,导致安定性不良。氧化镁产生危害的原因与游离石灰相似,由于氧化镁的水化作用比游离石灰更为缓慢,所以必须采用压蒸法才能检验出它的危害程度。三氧化硫含量测定采用在酸性溶液中,用氯化钡溶液沉淀硫酸盐方法,经过滤灼烧后,以硫酸钡形式称量,测定结果以三氧化硫计。
(6)强度。
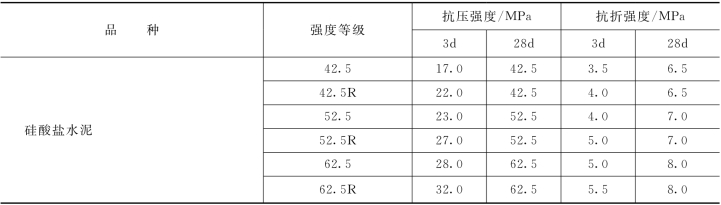
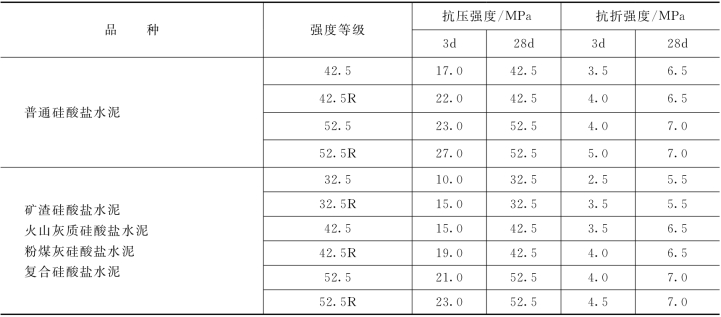
水泥的强度等级按规定龄期水泥胶砂的抗压强度和抗折强度来划分,反映了水泥胶结能力的大小。硅酸盐水泥强度等级分为42.5、42.5R、52.5、52.5R、62.5、62.5R,共六个等级。
几种通用水泥的强度指标列于表2.4。按国家标准 《水泥胶砂强度检验方法 (ISO法)》(GB/T 17671—2009)测定水泥胶砂3d、28d抗折及抗压强度,据此来判定水泥的强度等级。在判定水泥强度等级时,不同强度等级的水泥各龄期的强度值应不低于表中的相应指标数值。
表2.4 几种通用水泥的强度指标 (GB 175—2007)
续表
(7)水化热。
水泥在水化过程中所放出的热量称为水化热。大部分水泥水化热是在水化初期 (7d前)放出的,后期放热量逐渐减少。
水泥水化热的大小及放热速率主要取决于水泥熟料的矿物组成、细度等因素。通常强度等级高的水泥水化热较大。凡起促凝作用的因素 (如加CaCl2)均可提高早期水化热。反之,凡能减慢水化反应的因素(如加入缓凝剂)则能降低或推迟放热速率。
目前测定水泥水化热的方法有直接法和溶解热法两种。溶解热法是国家标准规定的基本方法,它是通过测定未水化水泥与水化一定龄期的水泥在标准酸中的溶解热之差,来计算水泥在此龄期内所放出的热量。直接法也称为蓄热法,在国家标准中它是代用方法。
水泥的这种放热特性对大体积混凝土是非常不利的。它能使大体积混凝土内部与表面产生较大的温差,引起局部拉应力,使混凝土产生裂缝。因此,大体积混凝土工程一般应采用放热量较低的水泥。
2.2.2.4 水泥石的侵蚀
水泥石在与服役环境中的某种介质相互作用时,经常会发生不同程度的物理和化学作用,使已硬化的水泥石结构遭到破坏,强度降低,最终造成混凝土结构乃至建筑物的破坏,这种现象称为环境因素对水泥石的侵蚀。
这里重点介绍环境水的作用。水泥石被环境水侵蚀,就其本身而言,是由于硅酸盐水泥水化后生成的氢氧化钙、水化硅酸钙、水化硫铝酸钙等水化产物能与环境水中的离子相互作用而导致某种程度上的破坏。而一般情况下,水泥的水化产物是稳定的,但在某些侵蚀性介质存在的条件下,其稳定性会受到影响,从而导致水泥石结构破坏。产生侵蚀的主要原因有:①石中的氢氧化钙或其他成分,能一定程度地溶解于水 (特别是软水),导致水泥石中其他水化产物稳定存在的条件受到影响;②氢氧化钙、水化铝酸钙等都是碱性物质,若环境水中有酸类或某些盐类时,它们能与其发生化学反应,新生成的化合物或易溶于水、或无胶结力、或因结晶膨胀而引起内应力,都将导致水泥石结构的破坏。根据环境水质的不同,几种主要的侵蚀破坏作用如下。
(1)溶出性侵蚀(软水侵蚀)。
水泥石中的大部分水化产物(如C-S-H、CH),其结构是在一定浓度的石灰溶液中稳定存在的。如果孔溶液中的石灰浓度小于该水化产物的极限石灰浓度,则该水化产物将被溶解或分解,其中氢氧化钙的溶解度较大,特别是在软水(暂时硬度[7]较小的水)中时,其溶解度更大。
当水泥石处于水中,特别是软水中时,氢氧化钙将首先被溶解,直至使环境水中石灰浓度达到极限石灰浓度时才能停止。但若环境水是流动水,溶解的氢氧化钙被水带走,环境水中石灰浓度总是低于极限石灰浓度,则氢氧化钙将不断被溶解。特别当混凝土不够密实或有缝隙时,在压力水作用下,水渗入混凝土内部,将氢氧化钙溶解并渗滤出来,产生更多的孔隙,溶解作用更为严重。这一过程的连续进行使孔隙内石灰浓度逐渐降低,并将逐步引起C-S-H结构的分解,于是水泥石的结构受到破坏,强度不断降低,最后引起整个建筑物的毁坏。
溶出性侵蚀的强弱程度除了与水泥石结构密切相关外,也与水质的硬度有关。当环境水的水质较硬,即水中重碳酸盐含量较高时,氢氧化钙溶解度较小,侵蚀性较弱;反之,水质越软,侵蚀性越强。
(2)碳酸性侵蚀。
雨水、某些地下水中含有一些游离的CO2,当含量过多时,将对水泥石起破坏作用。这是因为水泥石中的氢氧化钙能与CO2起化学反应,生成碳酸钙 (CaCO3),而碳酸钙会进一步与CO2反应,生成易溶于水的碳酸氢钙。其反应式为
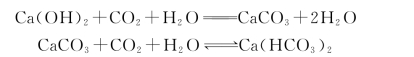
如果水泥石是在有渗滤的压力水作用下,生成的碳酸氢钙将被水带走,上述反应将永远达不到平衡。氢氧化钙更快地不断流失,使水泥石中石灰浓度逐渐降低,水泥石结构被破坏。
环境水中游离的CO2越多,其侵蚀性也越强烈,如水温较高,则侵蚀速度加快。
(3)一般酸性侵蚀。
某些地下水或工业废水中常含有游离的酸类。这些酸类能与水泥石中的氢氧化钙起作用,生成相应的盐。所生成的盐或易溶于水;或在水泥石孔隙中结晶,产生体积膨胀,引起破坏。例如,盐酸(HCl)或硫酸(H2SO4)与氢氧化钙的作用为
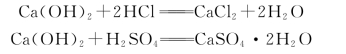
前者反应生成的氯化钙(CaCl2)易溶于水,后者反应生成的石膏 (CaSO4·2H2O)则在水泥石孔隙内结晶,产生体积膨胀,使其结构破坏。同时,石膏又能与水泥石中水化铝酸钙起作用,生成水化硫铝酸钙晶体,破坏性更大(见硫酸盐侵蚀)。
环境水中酸的氢离子浓度越大,即pH值越小,则侵蚀性越严重。
(4)硫酸盐侵蚀。
在海水、地下水及盐沼水等环境中,常含有大量的硫酸盐,如硫酸镁 (MgSO4)、硫酸钠(Na2SO4)及硫酸钙(CaSO4)等,它们对水泥石有严重的破坏作用。
硫酸盐能与水泥石中的氢氧化钙起反应,生成石膏。石膏在水泥石孔隙中结晶时体积膨胀,使水泥石破坏。更严重的是,石膏与硬化水泥石中的水化铝酸钙起作用,生成水化硫铝酸钙,反应式为
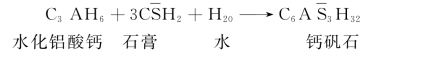
生成的水化硫铝酸钙(即钙矾石)含有大量的结晶水,其体积增大达到原有水化铝酸钙体积的2.5倍左右,且是在已经硬化的水泥石中产生,对水泥石产生很大的破坏作用。由于水化硫铝酸钙呈针状结晶,故常称之为“水泥杆菌”。
硫酸盐类的侵蚀不仅取决于水中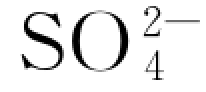 的浓度,而且与水中Cl-的含量有关,Cl-能提高水化硫铝酸钙的溶解度,阻止钙矾石晶体的生成与长大,从而减轻破坏作用。
的浓度,而且与水中Cl-的含量有关,Cl-能提高水化硫铝酸钙的溶解度,阻止钙矾石晶体的生成与长大,从而减轻破坏作用。
(5)镁盐侵蚀。
海水、地下水及其他矿物水中常含有大量的镁盐,主要有硫酸镁(MgSO4)及氯化镁(MgCl2)等。这些镁盐能与水泥石中的Ca(OH)2发生下列反应:
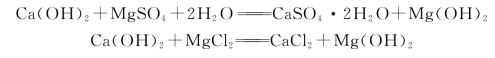
在生成物中,氯化钙(CaCl2)易溶于水,氢氧化镁[Mg(OH)2]松软无胶结力,石膏则进而产生硫酸盐侵蚀,它们都将破坏水泥石结构。
镁盐侵蚀的强烈程度除取决于Mg2+含量外,还与水中的SO2-4 含量有关,当水中同时含有SO2-4 时,将产生镁盐与硫酸盐两种侵蚀,破坏特别严重。
除上述五种侵蚀作用外,糖、强碱 (如NaOH)、含大量环烷酸的石油产品等对水泥石也有一定的侵蚀作用。
为了保证混凝土的耐久性,防止混凝土受到环境水的侵蚀,工程上首先应对环境水进行调查与分析,并根据有关标准(见附录二)判定是否具有侵蚀性。当确定环境水有侵蚀作用时,通常采取以下措施:
1)根据环境水侵蚀的特性,选择适当品种的水泥。例如,掺活性混合材料的硅酸盐水泥抗溶出性侵蚀的能力较强抗硫酸盐硅酸盐水泥对硫酸盐侵蚀的抵抗能力较强等。
2)尽量提高混凝土的密实度,减少水的渗透,则可减轻环境水的侵蚀破坏作用,减慢侵蚀破坏的速度。
3)必要时可在混凝土表面设置防护层,如沥青防水层、不透水的水泥喷浆层及塑料防水层等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




