天体光谱的观测研究可以得到很多重要信息,如天体的化学成分、温度、磁场等。原子是天体的主要成分,这里简述原子结构及其光谱。
1)原子结构和光谱
原子由原子核和电子组成。原子核由若干个带正电的质子和不带电的中子组成,其结构紧密,体积微小,但占原子的绝大部分质量。若干个带负电且质量小的电子在相当大的范围内绕原子核运动。不同元素的原子核有一定数目的质子(因而一定的正电荷数)从而确定其原子序数。中性原子的电子数等于原子核中的质子数。例如,氢的原子核只有一个质子,原子序数为1,只有一个核外电子;氦的原子核有两个质子和两个中子,原子序数为2,有两个核外电子。当原子中的电子获得足够的能量,就可以克服原子核的吸引力而逃离出去,于是该原子“电离”而成为离子。天文学上,中性原子常以元素符号后加罗马字母Ⅰ表示,一次电离(失去一个电子)的离子加Ⅱ,二次电离的加Ⅲ……例如,HⅠ表示中性氢原子,HⅡ表示氢离子,HeⅠ表示中性氦原子,HeⅡ表示一次电离的氦离子。与电离过程相反,自由电子与离子结合的过程称为复合。
原子的能量状态主要由核外电子的空间分布状况决定。原子的能量状态是量子化的,只有某些确定的能级。当原子从较高的能级跃迁到较低能级时,就辐射相应能量的光子。当原子吸收一个光子时,它从较低能级跃迁到较高的能级。能级之间的这种跃迁称为束缚态-束缚态跃迁,它遵守一定的量子力学规则,产生线谱。电子从束缚态获取足够的能量也可以发生在束缚态-自由态跃迁过程。自由电子在原子核场作用下也可以改变能量,从一种能量的自由状态变到另一种能量的自由状态。原子中的电子处于最低能级称为基态(量子数n=1),由基态跃迁到某一较高的能级——激发态(量子数n=2,3,…)所需的能量称为激发电势;而由基态电离所需最小能量称为电离电势。束缚态-自由态跃迁及复合的能量变化范围较宽或连续的,产生连续谱。
2)氢原子光谱
氢是最简单的原子,也是宇宙中最丰富的元素,下面以它为例用简单图像说明原子光谱。在正常状态下,核外电子处于基态。原子获得能量(如受高能光子作用)时,其电子会从基态跃迁到激发态。
电子从高能级Ej跃迁到低能级Ei所发射的光子能量为hν=Ej-Ei。氢原子的核外电子从量子数m>n的一系列轨道跃迁到n轨道时,发射的一系列谱线称为线系。这些谱线的波长可用下面公式计算:
![]()
式中,R=109677 cm-1为里德伯常数。n=2为巴耳末线系,头几条谱线的符号和波长分别为Hα656.3 nm,Hβ486.1 nm,Hγ434.0 nm,…线系限为364.6 nm;n=1为赖曼线系,头一条谱线的符号和波长分别为Lα121.5 nm,线系限为91.2 nm;n=3为帕邢线系,n=4为布喇开线系,n=5为普丰德线系……,这些线系都在红外波段。原子之外的自由电子跃迁到某n值轨道就产生线系限外的连续光谱,如图4-6所示。

图4-6 氢原子能级和光谱线系(https://www.xing528.com)
大多激发态是不稳定的,很快(10-6s,甚至10-9s)就跃迁返回基态而发射辐射。那么,吸收线是怎么产生的?这是因为大量原子中总有相当多从基态跃迁到激发态,总的效果是既有发射,又有吸收,因而产生不完全黑的吸收线。
3)类氢离子和其他原子的光谱
如果离子只剩下一个核外电子则称为类氢离子,它们的光谱有相似于氢原子光谱的谱线系,但里德伯常数改为与其原子核质量和原子序数有关的值。例如,氦离子(HeⅡ)的皮克林线系是电子从n=5,6,…跃迁到n=4的能级时发射的,头四条谱线波长为1012.4 nm,656.0 nm,5421.2 nm,480.2 nm,线系限为364.5 nm。
多电子原子的光谱问题很复杂,光谱实验和量子力学研究取得很多成果。例如,氦和碱金属(铍、镁、钙等)的光谱线都分为两套:一套为单层能级结构(单重态),产生单线的线系,并因电子组态不同而分为主线系、漫线系、锐线系、基线系等;另一套为三重能级结构(三重态),产生更复杂的线系。
1868年在太阳色球光谱上发现当时未知元素的谱线(波长为587.562 nm),25年后才在地球上找到这种元素——氦;在星云的光谱中发现波长为500.7 nm和495.9 nm等未知谱线,后来认识到它们不是新元素,而是二次电离氧(OⅢ)产生的“禁线”。“禁线”是实验室条件下产生概率非常小的谱线,但易产生于星云环境。
4)分子光谱
分子由多个原子组成,其结构复杂。双原子分子的总能量E为三部分(电子能量Ee、两原子相互作用的振动能量Ev、两原子核绕它们重心轴的转动能量Er)之和,E=Ee+Ev+Er。这些能级都是量子化的。从高能级跃迁到低能级发射光子能量。
![]()
一般来说,![]() 为1~20 eV,
为1~20 eV,![]() )为0.05~1 eV,
)为0.05~1 eV,![]() )小于0.05 eV。纯电子能级跃迁的发射在紫外到可见光波段,纯振动跃迁的发射在红外波段,纯转动跃迁的发射在远红外波段,三种叠加一起仍在紫外到可见光波段,振动和转动叠加一起则在红外波段。分子光谱的谱线常密集成一段段的带组,各带组含几个带。每一带的各谱线相当于
)小于0.05 eV。纯电子能级跃迁的发射在紫外到可见光波段,纯振动跃迁的发射在红外波段,纯转动跃迁的发射在远红外波段,三种叠加一起仍在紫外到可见光波段,振动和转动叠加一起则在红外波段。分子光谱的谱线常密集成一段段的带组,各带组含几个带。每一带的各谱线相当于![]() 不变,而
不变,而![]() 不同,即转动能级跃迁的谱线组成一带;(E′e-Ee)决定几带。实际上,有些带彼此交错或重叠,较难识别。作为例子,图4-7给出彗星的光谱,可认证出CN、C2等分子及CO+、
不同,即转动能级跃迁的谱线组成一带;(E′e-Ee)决定几带。实际上,有些带彼此交错或重叠,较难识别。作为例子,图4-7给出彗星的光谱,可认证出CN、C2等分子及CO+、![]() 、H2O+离子。
、H2O+离子。
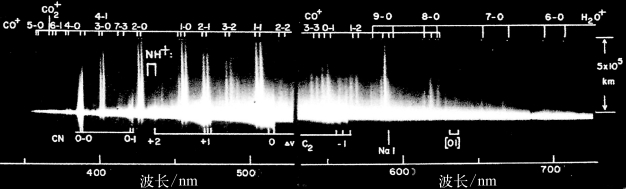
图4-7 威斯特(West)彗星的光谱
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




