敏感性分析是对某些变量的变化对另一变量影响的分析。一般情况下,它研究反应速率常数的变化对气体的温度、某种组分的浓度等影响。在多种组分组成的化学反应动力学系统中,各反应的速率常数可能相差很大,各组分浓度的增加(或减小)的速率很不相同,敏感性分析可以找出化学动力学反应机理中的控制因素,也可以进行反应机理的简化或不确定性分析。
在室温为298 K、压力为1 atm 和相对湿度为0%条件下计算不同KOH 浓度对火焰中OH、H和O自由基浓度的影响,计算结果如图5.7所示。

图5.7 OH、H和O自由基浓度随KOH浓度变化
由图5.7可知,火焰中重要的自由基OH、H和O的浓度随火焰中KOH浓度的增加而降低,说明火焰中气态KOH 的存在对CH4火焰存在一定的抑制作用,并且随KOH 浓度的增加,这种抑制作用不断地增强。不同钾盐添加剂最小灭火浓度的Cup-burner实验结果如图5.8所示。除KH2PO4外,其他3种钾盐添加剂的MEC都随着浓度的增加而减小。结合表4.14、表4.16、表4.18及表4.19的热力学计算结果,实验结果与平衡产物中气态KOH及含K物质的含量有关,与图5.7 的计算结果相一致。KH2PO4的平衡产物中,上述物质的含量极少,导致化学灭火有效性不及另外3种钾盐。此外,由图5.7,达到平衡时,火焰中OH 自由基浓度高于O 和H 自由基。因此,在敏感性分析部分以对OH自由基分析为例。

图5.8 不同钾盐添加剂的MEC上限值
CH4燃烧简化模型中各基元反应对OH自由基的敏感性系数计算结果如图5.9所示。
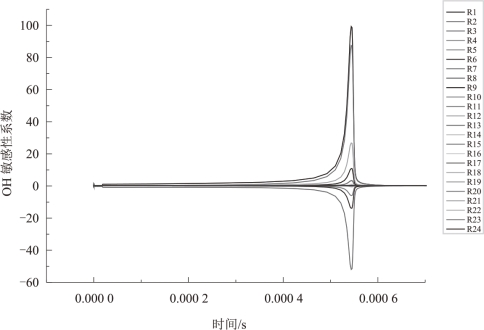
图5.9 各基元反应对OH自由基的敏感性系数
由图5.9 可知,敏感性系数几乎在同一时刻出现峰值,因此,取敏感性系数峰值出现的t = 0.544 ms时刻的值作比较,如图5.10所示。

图5.10 OH敏感性分析
由图可知,OH 自由基主要的消耗反应为R2、R3 和R6。通过反应CH4 + OH = CH3 + H2O(R3)和CH3 + HO2 = CH3O + OH(R2)生成CH3。CH3通过反应CH3 + CH3 = C2H6(R5)生成C2H6,促进反应C2H6 + OH = C2H5 +H2O(R6)向正方向进行,加速OH的消耗。
抑制OH 消耗的主要反应为R1、R7、R9、R13、R15 和R21。R1 是消耗CH3的反应,抑制OH 的消耗。但同时,通过R1 生成的HO2使反应CH2O+O2 =HCO+HO2(R15) 逆向进行,生成CH2O,抑制了反应CH3 +OH=CH2O+H2(R7)对OH的消耗。反应CH2 +O2 =CO2 +H+H(R21)为生成H的主要反应。H 的大量存在促使反应O+OH=H+O2(R9)和OH+H2 =H+H2O(R13)的逆反应速率大于正反应速率,导致此反应主要生成OH 而非消耗OH。(https://www.xing528.com)
综合敏感性分析结果,R3 为消耗OH 的主要反应,R2 与R6 为消耗OH过程中比较重要的支链反应,OH 是抑制火焰最关键自由基,而CH3、H、HO2和CH2O则对OH自由基浓度有较大影响。CH4燃烧简化机理的OH自由基关键反应为R1、R2、R3、R6、R7、R9、R13、R15与R21。
反应R2、R3 和R6 是促进OH 消耗的关键基元反应。如图5.11 所示,R2、R3的敏感性系数随KOH含量的增加而降低,而反应R6的敏感性系数随KOH 含量的增加而增加。可以认为,当气体组分中KOH 的含量增加时,消耗OH 的关键反应R6更加活跃,反应更加剧烈;反应R2和R3的重要程度则降低,CH3更多以R6的方式参与反应。
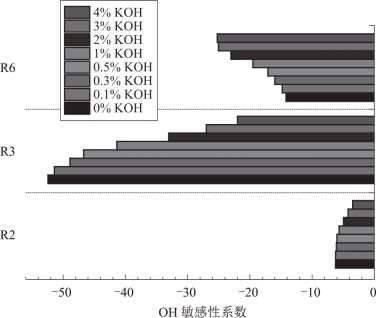
图5.11 不同KOH浓度条件下关键基元反应中OH的敏感性系数
抑制OH 消耗的主要反应为R1、R7、R9、R13、R15 和R21。取6 个反应正向和逆向敏感性系数的最大值,如图5.12所示。由于部分正反应和逆反应的敏感性系数值较小,为便于在图中进行比较,需对敏感性系数值进行放大处理。
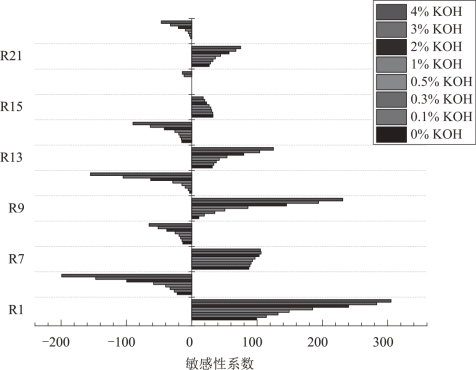
图5.12 不同KOH浓度条件下抑制OH消耗的主要反应敏感性系数
(注:①R13、R15正反应的敏感性系数扩大10倍,R15逆反应的敏感性系数扩大10 000倍;②R1、R7、R9、R13和R21逆反应的敏感性系数扩大1 000倍)
由图5.12 可知,反应R1、R7、R9、R13 和R21 的正逆反应敏感性系数都随着KOH 浓度的增加而增大,并且R1、R9、R13 和R21 正逆反应敏感性系数增加幅度基本一致,说明KOH浓度的增加对这4个反应的反应方向没有影响,抑制OH 反应的重要程度也随着KOH 的增加而增加。反应R7 的正反应敏感性系数增大幅度不及逆反应,说明随着KOH 浓度的增加,反应R7 有由抑制OH基消耗转化为促进OH基消耗的趋势。
反应R15 的正反应敏感性系数随着KOH 浓度的增加而减小,逆反应方向呈上升趋势。说明随着KOH 浓度的增加,反应由抑制OH 基消耗的正反应方向,不断向促进OH基消耗的逆反应方向进行。
由之前研究人员的实验结果可知,火焰中活性自由基含量达到饱和浓度之前,灭火效果随灭火活性自由基浓度的增加而增强。通过对KOH 的敏感性分析,取敏感性系数绝对值>10的作为对KOH 浓度变化影响较大的基元反应,如图5.13所示。

图5.13 对KOH浓度变化较为敏感的基元反应
由图5.13 可知,当KOH 含量增加时,反应R3 的敏感性系数降低,反应R6 和R29 的敏感性系数增加,说明当KOH 含量增加时,体系中抑制KOH 消耗的反应由R3 变为R6 和R29,并且由于R29 的敏感性系数增加幅度大于R6,抑制KOH消耗的主反应在KOH浓度较高时为R29。
促进KOH 消耗的主要反应R1、R9、R13 和R21 的敏感性系数随着KOH浓度的增加而增大,由增加的幅度来看,在KOH 浓度较高时,促进KOH 消耗的主要反应为R1 和R9。对于反应R7,随着KOH 浓度的增加,敏感性系数呈现先增加后减小的趋势:当体系中KOH 的含量小于1%时,反应R7的敏感性系数变化不大;当KOH 的含量大于1%小于4%时,R7 的敏感性系数随着KOH 浓度的增加而迅速增大;当KOH 的含量为4%时,R7 的敏感性系数有一定的减小。说明对于反应R7 来说,当KOH 浓度较低时,浓度的变化对反应几乎没有影响;当KOH 浓度较高时,该反应对KOH 的敏感程度降低,只有在适当的浓度条件下,KOH 浓度的变化对该反应的影响才较为明显。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




