热学研究、燃烧问题研究、气体研究等领域在18世纪也都逐渐从定性的观察记录转向定量研究,最终完成了化学革命。
定量研究的成熟有赖于实验仪器的发展,我们刚才说到,部分因为演示实验的需求,实验仪器的发展在18世纪得到了促进,温度计、气压计、气体的收集装置、更精密的天平秤等精密仪器在18世纪后半叶普及开来。
苏格兰学者约瑟夫·布莱克(公元1728年—1799年)借助水银温度计进行热学研究,他发现让冰化成水需要施加固定的热量,但温度计没有变化,从而区分了温度与热量的概念。他进而发现不同物质容纳热量的能力不同,也就是说一定的热量让不同的物质提升的温度不一样,从而提出了“比热”的概念。
那么在物质之间传递的“热量”究竟是什么呢?拉瓦锡和拉普拉斯提出了“热质说”,认为热是一种没有重量的流动物质,热的传导就是热质在物体之间流动。热质说还把蒸发过程解释为被蒸发物与热质的“化合”。
热质说虽然在现在看来是错误的,但它反映了对理论化的定量研究的诉求,因为一种定量研究的科学理论,不仅仅意味着定量地测量一个又一个数据,更要给出某种守恒律来解释数据之间的关系,如果没有守恒律,就难以把诸多定量数据放在一个“等式”之内。而守恒律总要求设定某种恒定的东西的存在。“热质”就是这样一种在变化中保持不变的恒定之物,“燃素”也是一种。
燃素说由德国化学家施塔尔(公元1660年—1734年)于1703年提出,用以解释燃烧现象。施塔尔在化学史上很重要,他明确把化学与物理相区别,认为物理学研究的是均质的物质粒子之间的集合,而化学研究的是异质物质之间的合成和分解。
燃素说认为燃烧过程是物体失去燃素的过程,它和后来的氧化学说正好相反,认为燃烧是分解而不是化合。空气是一种助燃剂,燃素从物质中分解出来而进入空气。如果隔绝了空气,比如用罩子盖住了蜡烛,燃烧就会停止,这是因为封闭的空气中的燃素很快就达到饱和,燃素跑不出来,自然就不能再燃烧了。
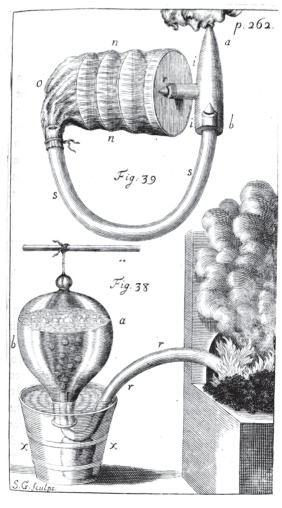
图13.6.1 《植物静力学》中演示的气体收集方法(https://www.xing528.com)
燃素说在18世纪影响很大,不仅限于化学领域,在生命科学、地球科学等领域也被用来解释许多现象。但燃素理论的定量化并不成功,最终被拉瓦锡的氧化还原理论所取代。
说氧化还原理论之前还要讲一下18世纪的气体研究。我们之前提到炼金术士赫尔蒙特就区分了空气和气体,但他当时没有收集气体的设备,因而无法具体研究各种气体的性质。而收集气体的装置在18世纪出现了,黑尔斯(公元1677年—1761年)在1727年出版的《植物静力学》一书中描述了收集气体的方法(图13.6.1),用倒扣在水面上的容器收集气体。黑尔斯本人并不研究这些气体,他以为这些气体与空气是一样的,但他提供的方法影响深远。
布莱克在1756年发表《碳酸镁实验》,考查加热碳酸镁产生的空气,他称之为“固定空气”,他发现释放该空气后盐的重量减少了,且丧失了碱性。而这种空气与一般空气不同,它能使石灰水变浑浊,不支持燃烧和呼吸。布莱克正式把气体研究纳入化学领域,他指出气体也是化学物质,会参与化学反应,可以考察其化学性质。[13]
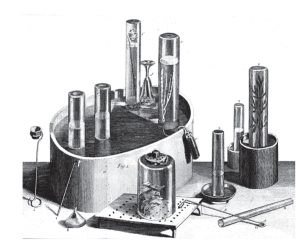
图13.6.2 普里斯特利气体实验的仪器图示(1774年)
英国牧师普里斯特利(公元1733年—1804年)是一个研究气体的达人(图13.6.2),他区分出许多种空气,包括:“固定空气”“易燃空气”“含氮空气”“海酸空气”“碱性空气”“含燃素空气”等,翻译成现代的概念依次是:二氧化碳、氢、氮氧化物、氯化氢、氨、氮。[14]
普里斯特利认为这些空气的区别在于所含燃素的程度。鉴于呼吸过程是把有害的燃素排放到大气里,富含燃素的空气是不适合呼吸的。
普里斯特利通过加热红色汞金属灰(氧化汞)得到了一种能够促进燃烧并且适宜呼吸的空气,他把它命名为“脱燃素空气”。既然燃素说认为燃素饱和的空气会抑制燃烧,那么没有燃素的空气自然就会促进燃烧了。我们现在知道这种脱燃素空气就是氧气。
比普里斯特利稍早一些,瑞典化学家舍勒(公元1742年—1786年)也独立地分离出了氧气,他将之命名为“火空气”,他认为燃烧过程是燃素与这种火空气结合的过程。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




