临床实验室进行突发呼吸道传染病核酸检测的全过程包括标本前处理、核酸提取、核酸扩增及产物分析。目前,经常采用热灭活和化学灭活的方法对标本进行前处理及灭活,以降低操作人员感染的风险。热灭活是利用高温使病毒结构蛋白发生变性,但可能造成检测结果假阴性;化学灭活的原理是利用胍盐使核糖核酸酶(RNase)产生不可逆失活,使标本中病毒RNA损失相对较少,作用效率高。但是,胍盐可能对后续核酸提取及扩增过程造成影响,应确认保存液对提取和检测过程是否存在影响,再用于临床检测。
目前,临床实验室中使用最为广泛的核酸提取方法是磁珠分离法和离心柱提取法,这两种方法均利用了特定条件下核酸与二氧化硅等材料可逆性亲和吸附的特点,能够高效地提取和纯化病毒核酸。此外,部分试剂厂家开发了“一步法”提取核酸。这种方法操作步骤简单、快速,但是对PCR反应抑制物的去除效果有限,同时没有核酸富集和浓缩步骤,使其获得的核酸浓度低于磁珠分离法或离心柱提取法。
核酸扩增方法,在临床上使用最广泛和技术成熟度最高的有实时荧光逆转录聚合酶链反应PCR扩增、实时荧光逆转录聚合酶链反应PCR扩增(RT-PCR)及等温扩增。不同方法的检测时间、易操作性、敏感性、特异性、精密度、所需仪器设备、成本、通量、对环境条件的要求等因素决定了其在临床上的应用不同。从本质上来说,也是由各试剂的原理所决定的。
(一)标本前处理
目前,临床上标本前处理主要是采用热灭活和化学灭活对标本进行灭活。灭活应导致病毒失活,力图降低实验室生物安全风险的同时,又对病毒核酸没有明显降解作用,不影响核酸检测的准确性。
1.热灭活
利用高温使参与入侵宿主细胞和病毒复制的蛋白质二级结构变性,改变其构象与功能,从而导致病毒失活。比如COVD-19患者标本的灭活主要借鉴严重急性呼吸综合征冠状病毒(SARS-CoV)和中东呼吸综合征冠状病毒(MERS-CoV)的经验。美国FDA的研究人员通过研究表明,56℃孵育20min或65℃孵育4min即可使大多数病毒失活。但对于56℃孵育30min热灭活后,是否会引起病毒RNA降解、导致核酸检测假阴性,国内研究结果仍然存在争议。
2.化学灭活
前文中已经介绍,标本保存液有两种,其中含有胍盐(如盐酸胍、异硫氰酸胍等)的病毒裂解液可使病毒结构蛋白和RNase变性,使病毒失活的同时保证其RNA的稳定性。
(二)核酸的提取方法
每种传染病都是由特异性病原体引起的。引起这些传染病的病原体中微生物占绝大多数,包括病毒、衣原体、立克次体、支原体、细菌、螺旋体和真菌,另外一小部分是寄生虫。其中有50%就是由病毒感染引起的。从人体的呼吸道或其他部位采集的各种类型标本,如咽拭子、痰液、肺泡灌洗液等可能含有PCR反应抑制物降低病毒载量。核酸提取步骤的主要作用是去除PCR抑制物、增加靶核酸浓度(浓缩富集)、增加标本中核酸的均一性,核酸提取是检测结果精密度的重要保证,因而样本的提取和前处理环节显得尤为重要。下面我们讲述一下RNA病毒:SARS、流行性感冒、新型冠状病毒肺炎、手足口和DNA病毒、肺结核等传染病的各种样本提取和前处理环节。
临床实验室核酸提取步骤是决定检测反应成败的关键环节之一,RNA病毒和DNA病毒核酸提取包括手工法、半自动法和全自动提取法。如酚-氯仿抽提法、碱裂解法等传统的核酸提取方法,除了步骤繁杂、耗时费力、需要使用有毒化学试剂等缺点以外,还会对操作人员的健康造成潜在危害,再加上提取效果也不够理想,现已经很少采用。目前,提取使用最多的方法是磁珠分离法和离心柱提取法,还有部分试剂厂家开发了一步法,下面将重点介绍这些方法的原理、优势和局限性,并将对基于磁珠分离法和离心柱提取法的自动化提取设备进行简要介绍。
1.半自动法和全自动提取法
磁珠分离法是目前临床上最常用的核酸提取方法,其原理决定了该方法较易于实现自动化,适合在标本检测量大的情况下使用。
(1)核酸提取原理
磁珠是具有超顺磁性,粒径小(0.5~10pm),对靶核酸有亲和性的聚合物制备的特殊材料,磁珠在施加磁场时会被磁化并迅速聚集,而去除磁场后又不会永久保留磁性,在溶液中均匀分散。目前使用最为广泛的硅胶质膜磁珠采用表面化学修饰法在磁性四氧化三铁纳米粒子表面包裹二氧化硅,并在此基础上加入各种活性基团的修饰,如羟基、氨基羧基等,以硅羟基磁珠最为常见。除硅胶质膜磁珠外,也有商品化试剂盒采用纤维素包被磁珠。纤维素磁珠的核酸吸附与释放原理与二氧化硅包被磁珠相似,其多孔结构增加了表面积,具有更大的亲和吸附作用。
(2)特 点
由于上面讲述的几种传染病的危害性比较大,样本的前处理还存在一定的困难,同时需要处理的标本数量也比较多,目前临床实验室多采用自动化核酸提取法。磁珠分离法特别适用于自动化提取系统,因为只需施加或撤离磁场就可以实现磁珠在溶液中聚集或重悬,不需要进行离心,此外,磁珠通过与核酸特异性结合,所提取的核酸纯度高、杂质少,保证了后续的扩增反应的质量。如果采用手工操作的方式,磁珠分离法核酸提取对人员操作能力有一定的要求,不同人员所提核酸质量有很大差异。
(3)影响因素
核酸检测试剂推荐最好使用相同厂家生产的磁珠分离法提取试剂进行核酸提取,这将更有利于后续的核酸扩增和产物分析质量。提取使用的标本量、磁珠试剂量和检测过程应按照试剂说明书进行,因为这些因素均有可能对核酸提取产生影响。
①临床实验室应选用与检测试剂盒配套的提取试剂盒。因为不同提取试剂盒的选择磁珠种类、粒径大小、包被基质、表面活性基团等因素不同,各种磁珠试剂用于核酸提取的标本量、洗脱体积、所适应的试剂体系也有所不同,从而导致提取性能产生差异,洗脱的核酸浓度可能存在几倍的差异。
②核酸提取时,标本的使用量应该按照说明书规定的上限以内,不能为了达到增加核酸提取量的目的而随意增加使用的标本量,可能会导致标本处理液对样本细胞内蛋白质等成分消化不完全而引入杂质,这样可能影响核酸提取质量,影响后续检测。
③磁珠的使用量与样本的比例应在某个最佳范围,才能取得最佳的核酸提取效果。磁珠用量是试剂厂家采用多种标本、进行多次反复实验得出的最佳比例,实验室不应在未经性能验证确认的情况下任意改变磁珠用量。高于这个比例,由于磁珠用量不足,使得体系中的核酸不能被完全充分吸附;而低于这个比例,磁珠过量,导致其不能在体系中均匀分散,不但与核酸接触的表面积没有增加,反而降低洗涤过程中与液体接触的效率,甚至还会吸附其他杂质,导致纯化效率低下,影响后续的扩增反应。
④试剂的使用量是根据磁珠与核酸在液体中的吸附效率、碰撞概率和杂质清除效果决定的。为获得更高的细胞裂解效率和纯化效果而随意增加试剂用量,不但可能导致磁珠吸附核酸的效率大幅下降,还会造成试剂浪费。
⑤洗涤过程会造成一定量的核酸损失,还有可能增加核酸断裂水解。洗涤次数一般控制在2~4次为宜。
2.自动提取设备及核酸提取法
磁珠分离法特别适合自动化,由于提取试剂使用的标本量、磁珠和试剂量的不同,往往导致设备适用的提取试剂是有限的。虽然部分设备也可以配套兼容其他厂家的核酸提取试剂,但是大多数生产自动提取设备(图3-43)的厂家,同时也生产和提取设备配套的磁珠提取试剂。
以西安天隆全自动核酸DNA/RNA共提取试剂盒说明书为例:
(1)样本预处理
①签收样品合格后,编号并进行电脑扫描,以便后续报告发放。
②样品标记后可直接用于检测或根据《全国临床检验操作规程》中临床核酸和基因检测的标本保存,将标本置于4℃冰箱短期(一周内)保存;长期保存则需保存于-20℃以下。
③用于DNA检测的口痰,检测前需在生物安全柜中操作,打开痰杯加入少量4%的NaOH溶液,和口痰的比例为1∶1(根据痰液的浓稠,适当增加比例),混匀后放置30min直至充分液化(无明显固状物并且吸出时无拖丝现象)。
④充分液化好的痰液混匀后,用1.5mL的连盖离心管取出1mL,12000rpm离心5min,弃上清,加入约1mL生理盐水,12000rpm离心5min,弃上清留取200μL备用。
⑤咽拭子标本则先加入1000μL灭菌生理盐水,充分震荡混匀后,用1.5mL的连盖离心管取出,12000rpm离心5min,弃上清留取200μl备用。
⑥体液标本则直接震荡混匀,用1.5mL的连盖离心管取出12000rpm离心5min,弃上清留取200μL备用。
(2)样本核酸提取
试剂来源及组成:试剂盒提供的核酸提取板、蛋白酶K、NP968-C提取仪和配套提取套管。
提取程序:
①从试剂盒取出相应核酸提取板,对应标本编号。
②先用移液器混匀蛋白酶K,然后吸取20μL加入编好号的核酸提取板第一列和第七列中,然后再加入200μL预处理后的样本(需充分混匀),注意每吸取一份标本应更换一次性移液器吸头。
③将加好样本的核酸提取板放在自动核酸提取仪上,套上配套的提取套管,选择事先编辑好的温度程序进行核酸提取,目前整个核酸提取时间只需耗时19min即可,提取结束放4℃待上机使用。

图3-43 不同品牌的自动核酸提取仪
不同品牌的自动提取仪,在使用过程中都有可能造成标本核酸的交叉污染,临床实验室应严格按照仪器生产厂家的要求进行设备维护、保养与清洁,避免造成批次内和批次间污染,在提取过程中采用至少3个阴性对照,并随机放于临床标本中间参与提取全过程,以便及时监测并发现可能产生的污染。
3.手工提取法
在临床上常用的手工操作是离心柱提取法,也是经典的核酸提取方法之一。因为,尽管离心柱提取法也有自动化提取设备,但是操作过程中离心的需要反复离心限制了自动化提取设备的通量。多数的核酸检测试剂并无同一厂家自行生产的配套离心柱提取法的核酸提取试剂。

图3-44 离心柱法核酸提取流程(手工法)(https://www.xing528.com)
(1)核酸提取原理
因为二氧化硅表面在高盐低pH条件下可以吸附核酸,在低盐高pH条件下又能将其释放,离心柱提取法利用这一特征,用离心柱上的硅胶膜作为核酸载体进行核酸提取。该方法包括以下步骤:①首先需要使用裂解缓冲液处理标本,将病毒和细胞裂解,其核酸释放到溶液中;②然后将整个溶液体系转移至硅胶柱中进行离心,通过离心使液体通过柱内部的硅胶膜,核酸与硅胶膜结合而被留下来;③相同的原理,洗涤过程是通过硅胶膜,核酸仍然与其结合并被保留,除去被洗涤缓冲液溶解了的残留杂质;④最后,采用洗脱缓冲液水混合硅胶膜表面使核酸释放。
(2)特 点
离心柱提取法与传统的提取方法相比,无须使用有毒的化学试剂即可提取高纯度的核酸,适用于下游的分子生物学反应。试剂储存方便、手工操作更为稳定可靠。但是,反复的离心操作很大程度上限制了该方法实现自动化。
(3)影响因素
实验室在使用离心柱提取法操作时,应注意以下问题。
①核酸提取过程应该在专门的洁净工作区域进行,移液器、耗材及用于洗脱的去离子水等均要保证无核酸污染,配制裂解缓冲液时应使用预冷无水乙醇并达到分析纯级别。提取过程中,操作人员应随时更换外层手套。
②将裂解后的标本及洗涤缓冲液、洗脱缓冲液加入离心柱中时需要小心操作,将吸头伸入离心柱内部,以避免溶液溢洒导致污染和损失,应悬空滴加以避免吸头接触硅胶膜。
③使用低温离心机,并将温度设定至4℃,避免RNA发生降解。
④为了确保得到高纯度的核酸,最后一次添加洗涤缓冲液去除杂质,并且离心弃去废液后,需要进行全速离心,以便充分去除硅胶滤膜中残留的洗涤缓冲液的影响。
(4)手工核酸提取法
以中山达安核酸提取试剂盒说明书为例:
①RNA核酸提取
样本预处理:
A.签收样品合格后,编号并进行电脑扫描,以便后续报告发放。
B.用于RNA检测的口咽拭子、鼻咽拭子等样本标记后可直接用于检测或在3h内,将收到的样本在涡旋振荡器上混匀,然后用一次性吸头吸取1000μL至一次性的1.5mL的连盖离心管(已高压灭菌)中,标记后置于-80℃冰箱保存。
C.检测前,用1.5mL的连盖离心管(已高压灭菌)留取的样本,将收到的样本在涡旋振荡器上混匀,再使用一次性吸头吸取1000μL至一次性的1.5mL的离心管中,不足1000μL者加入灭菌生理盐水补至1000μL后,振荡混匀后再转移至1.5mL的离心管。
同理:用1.5mL的连盖离心管(已高压灭菌)留取的样本,不足1000μL的也需加入灭菌生理盐水补至1000μL。
D.粪便标本则先用1.5mL的连盖离心管(已高压灭菌)内加入1000μL灭菌生理盐水,再用加样枪在粪便样本中挑取火柴头大小的样本,在灭菌生理盐水中轻轻吹打3至5次混匀。
②样本核酸提取
A.试剂来源及组成:试剂盒提供-RNA提取液A,B。
B.将上述1.5mL连盖离心管(已高压灭菌)置于样本处理区的高速离心机,室温,12000rpm离心5min。弃去上清,再加入1000μL灭菌生理盐水,室温,12000rpm离心5min。弃去上清,留200μL备用。
C.提取程序:用专用镊子取出0.5mL高压灭菌离心管,对应标本编号;用移液器混匀RNA提取液A,然后吸取10μL加入编好号的离心管中,加入100μL预处理后的样本,最后加入200μLRNA提取液B,在震荡器上震荡混匀,室温放置5min,然后4℃,8000rpm离心1min。注意每吸取一份标本应更换一次性移液器吸头。
D.换手套,去上清,留沉淀。加入200μLRNA提取液B,在震荡器上震荡混匀然后4℃,8000rpm离心1min。
E.去上清,留沉淀加入450μL用DEPC水配制的75%的预冷乙醇充分混匀,洗涤沉淀,然后4℃,8000rpm离心1min,去上清。重复上述步骤,吸干上清,打开恒温仪65℃10min,让酒精全挥发,干燥沉淀(干燥恒温仪上进行)。
F.在烘干的沉淀管中加入18μL的反应液I,再加入2μL相应的逆转录酶,充分混匀,瞬时离心(3s),恒温金属仪上设置37℃恒温45min,进行逆转录。
G.逆转录完成后95℃5min高温灭活。12000rpm离心1min,保留已提取核酸上扩增仪备用。如果样本裂解产物(已提取核酸)当天不使用,则要保存在-20℃。
③DNA核酸提取
样本预处理:
A.签收样品合格后,编号并进行电脑扫描,以便后续报告发放。
B.样品标记后可直接用于检测或根据《全国临床检验操作规程》中临床核酸和基因检测的标本保存,将标本置于4℃冰箱短期(一周内)保存;长期保存则需保存于-20℃以下。
C.用于DNA检测的口痰,检测前需在生物安全柜中操作,打开痰杯加入少量4%的NaOH溶液,和口痰的比例为1∶1(根据痰液的浓稠,适当增加比例),混匀后放置30min直至充分液化(无明显固状物并且吸出时无拖丝现象)。
D.充分液化好的痰液混匀后,用1.5mL的连盖离心管取出12000rpm离心5min,弃上清,加入约1mL生理盐水,12000rpm离心5min,弃上清,再次加入约1mL生理盐水12000rpm离心5min,弃上清后备用。
E.咽拭子标本则先加入1000μL灭菌生理盐水,充分震荡混匀后,用1.5mL的连盖离心管取出,12000rpm离心5min,弃上清后备用。
F.体液标本则直接震荡混匀,用1.5mL的连盖离心管取出12000rpm离心5min,弃上清后备用。
样本核酸提取:
A.试剂来源及组成:试剂盒提供的核酸提取助沉剂(DNA提取液)
B.取核酸提取助沉剂充分混匀,然后加入50μL到预处理后的1.5mL连盖离心管内,将其混匀瞬时离心后放在100℃的干燥恒温仪器上变性10min,取出待冷却后,12000rpm离心5min,保留已提取核酸上扩增仪备用。
4.一步法
目前,除了磁珠和离心柱方法以外,一步法也是核酸提取中较常见的方法。其原理是使用表面活性肽等化学试剂直接裂解标本中的病毒蛋白衣壳,释放病毒核酸。该方法的优点是核酸释放过程在一个反应管中即可完成,无须频繁离心、振荡、移液、更换离心管等操作,节省时间和耗材成本,对操作人员的技术要求低。由于核酸释放剂能够使蛋白质变性,使其丧失天然构象与功能,所以一步法提取同样对标本中的病毒具有灭活作用。虽然一步法具有操作简单、快速获得病毒RNA、无须特殊仪器设备的优点,能够在需要时进行“高效率”大规模标本的处理,缩短检测周期,但病毒核酸富集、纯化效果是有限的。当标本含有的病毒载量较低时,标本用量低可能导致没有取到病毒,对标本中核酸的稀释及不完全的杂质去除均有可能影响后续检测结果的准确性。尽管一步法可以沉淀蛋白质和人基因组DNA,但直接吸取部分裂解液作为模板,无法达到磁珠分离法和离心柱提取法对PCR反应抑制物的去除效果。这种直接裂解病毒获得核酸的方法会造成一定比例的假阴性,试剂厂家也在说明书中明确表示尚需进一步验证。
通过查阅参考文献,引用其归纳的获得美国FDA紧急应用授权的SARS-CoV-2核酸检测产品配套的核酸提取方法。如果发生突发呼吸道传染病疫情时,能为临床实验室开展核酸检测工作提供参考(表3-1)。
表3-1 中国国家药品监督管理局授权的核酸检测产品
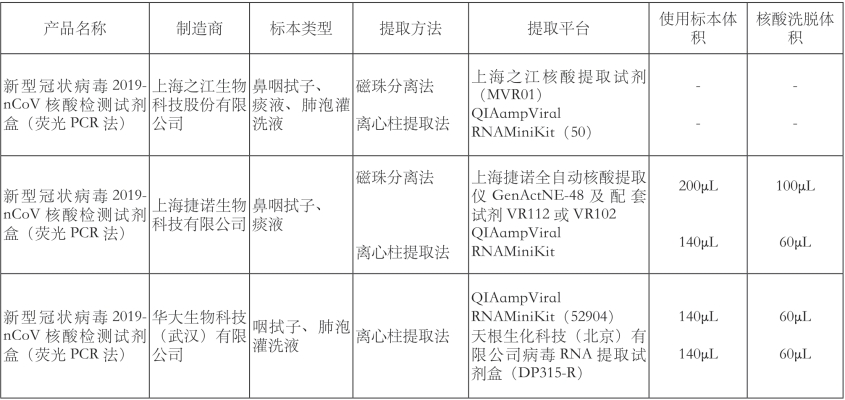
续表3-1
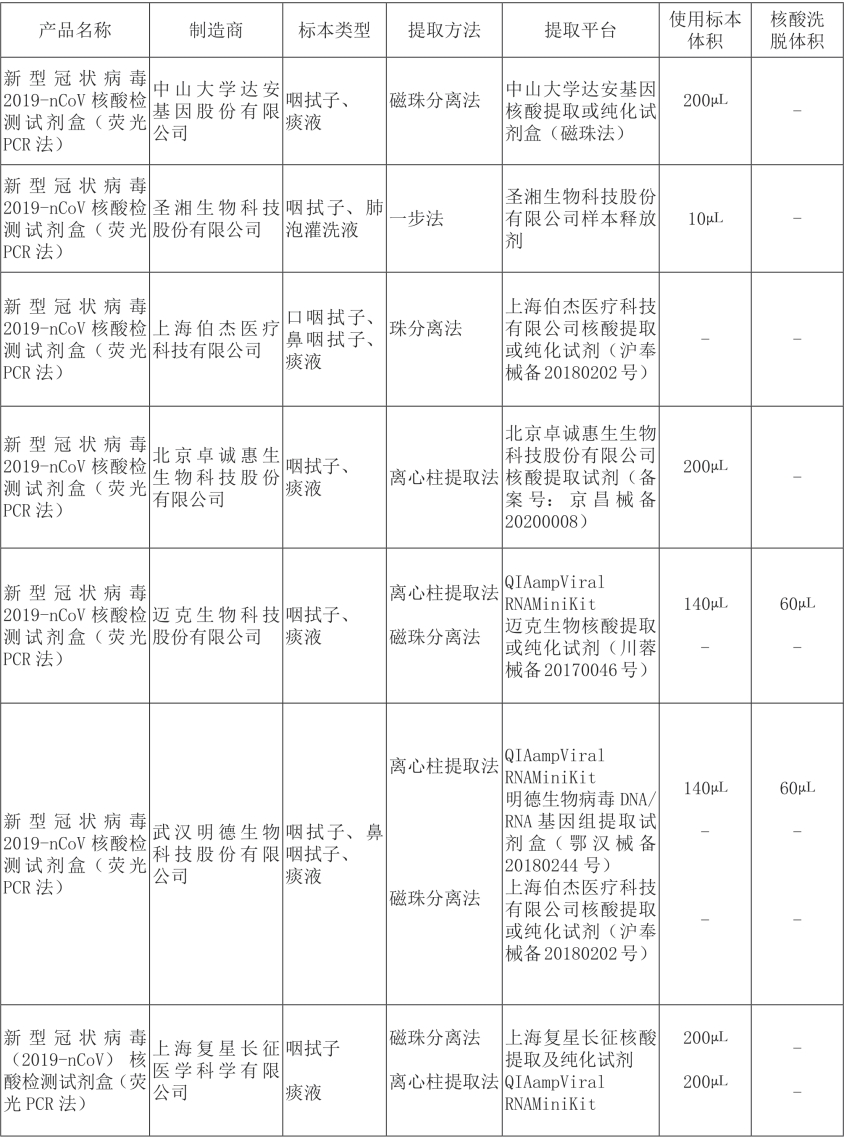
续表3-1

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




