2015年,中国政府相继出台若干政策,针对干细胞临床研究、制剂制备、研究基地管理等不同方面进行了系统规范,临床干细胞的研究进入法制轨道。
早在2004年12月,中国第一个干细胞创新药物——骨髓原始间充质干细胞,就拿到了CFDA(国家食品药品监督管理总局)颁发的一期临床试验批件(如图5-4所示)。2006年4月,该药物二期临床试验获批。2008年9月,该药物提交了三期临床试验申报材料后,卫生部以干细胞治疗涉及重大伦理问题为由,停止了对干细胞临床试验的审批。
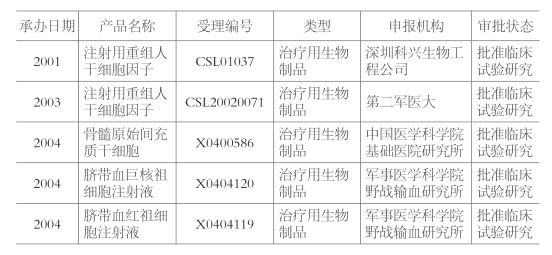
图5-4 CFDA批准临床试验研究列表截图
干细胞在中国发展的早期,由于没有相关方面的法规约束,一些“江湖游医”唯利是图,严重扰乱了市场秩序。一时间干细胞治疗领域乱象丛生,卫生主管部门发号施令,严禁一切干细胞科研成果向临床转化的研究与应用。2009年5月,卫生部把干细胞划为需要严格监管的“第三类治疗技术”,暂停了所有干细胞药物的审批,但是并没有出台相关的监管措施,以至于不但没有消除乱象,还让一些遵纪守法的企业举步维艰。
北科生物于2005年进入干细胞治疗领域,申请的干细胞领域的相关专利就有40余项,其中20项都获得了授权。这样一家实力不凡的企业就在混乱的市场中遭遇了“滑铁卢”。
那时候干细胞市场上人才奇缺,北科生物拥有一支高精尖的研发队伍,他的人才异常抢手,骨干成员屡屡被挖,还曾发生过核心团队集体流失的事件。北科生物CEO胡祥说:“不要说其他公司,我们的股东都从这里挖人。”北科生物的技术副总、行政副总和运营副总相继被挖。
与此同时,大大小小的干细胞企业相继在市场上涌现,他们不仅抢了北科生物的病源,还抢走了北科生物的合作医院,市场一时更为混乱,北科生物面临着生死存亡的巨大挑战。
2011年10月,卫生部发布文件,采取多个措施强化对干细胞市场的监管。事后不久,又要求停止在治疗和临床试验中试用任何未经批准使用的干细胞,并停止受理新的干细胞项目申请。2012年,政策进一步收紧,国家卫计委发布了《关于开展干细胞临床研究和应用自查自纠工作的通知》,叫停正在开展的未经批准的干细胞临床研究和应用项目。
2012年,政府叫停未经批准的临床干细胞研究和治疗之后,北科生物的主营业务开始转向了干细胞储存。但是因为市场进入较晚,北科生物连年亏损,2012年亏损3158万元,2013年亏损2793万元,2014年前8个月亏损1529万元。
北科生物投资的13家公司中,7家公司未能正常经营,一家公司停业。创业板推出之后,北科生物曾计划上市,但是由于干细胞业务引发的诸多争议,被政策挡在了门外。(https://www.xing528.com)
2013年至2014年8月间,北科生物发生多起股份转让事件,CEO胡祥持有的股份增至82%。2014年12月23日,北科生物因力不从心,以1.19亿元出让给中源协和13%的股份。
碍于政策,北科生物的发展处处受限,对政策性法规的恪守让它最终选择了投靠中源协和。此时,中国政府对临床干细胞研究的封冻已达五年之久,严重妨碍了中国再生医学的发展,业内人士一致认为,国家应该为干细胞治疗制定一个绿色的审批通道,而不是无所作为。
2015年3月5日,中源协和高调宣布其子公司和泽生物研制的干细胞新药——脐带间充质干细胞抗肝纤维化注射液(CXSL1200056),已向药监总局申报,目前正在“审批”阶段。
中源协和从事干细胞研究已有15年的经验,并购北科生物之后更是如虎添翼,市场极其看好它的脐带间充质干细胞抗肝纤维化注射液,认为它有望通过审批。而此药一旦获批,即可获得临床许可。但是中国干细胞临床审评自2009年来一直处于停滞不前的状态,中源协和最终未能如愿。
干细胞被认为是中国目前唯一可以打入美国市场的医药产业,如果发展顺利中国极有可能在未来国际市场上占有一席之地。目前,国际上已有8种干细胞药物或技术获批上市,并应用于临床。美国、韩国、加拿大、日本等多个国家都走在了临床干细胞研究的前头,但中国并不在列。
中国有世界第一的人口,也是世界第二大经济体,干细胞治疗的需求和市场巨大,许多产品都能够形成百亿元的年销售规模,可以成就一批优秀的医药公司。
在国内外市场的重重压力下,国家卫计委听取了业内人士的各项意见,形成专文报送上级。终于在2015年,《干细胞临床试验研究管理办法》《干细胞临床试验研究基地管理办法》和《干细胞制剂质量控制和临床前研究指导原则》三大文件破茧而出,国务院取消第三类医疗技术临床应用准入非行政许可审批,将审批权下放,为临床干细胞研究的发展提供了有力的法律保障,也似乎预示着国家对干细胞项目有松绑的态势。
监管政策的出台将加速干细胞产业化的进程。首先可以为干细胞药物审批过程提速,目前已有不少实力非凡的研究机构和企业做好了从硬件到软件的准备工作,政策一放开即可启动产业化;其次可以进一步激活干细胞临床研究与应用。
干细胞产业从市场边缘迈入了正轨,不断赢得资本的青睐,为产业龙头提供了并购整合的潜在标的。一方面,塞尔基因、诺华、强生等海外药品巨头通过并购进入该领域。另一方面,国内的很多房地产、矿业资本也进入该领域。
2015年3月,政府批准北科生物试点建设区域细胞制备中心。区域细胞制备中心的建立,可以让中国企业有机会通过投资参股或收购等方式参与到干细胞产业的源头,让发达国家的多年投入和研发成果为我所用。而率先建立起与干细胞产业相适应的基础设施,是中国临床干细胞研究实现跨越式发展的关键。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




