【高考化学·考试大纲】微粒间的相互作用与物质性质:
|(1)了解范德华力的含义及对物质性质的影响。
(2)了解氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响。
【课程标准·学业要求】(1)能根据分子结构特点和键的极性来判断分子的极性,并据此对分子的一些典型性质及其应用作出解释。(2)能根据共价分子的结构特点说明简单分子的某些性质。(3)能说明分子间作用力(含氢键)对物质熔、沸点等性质的影响,能列举含有氢键的物质及其性质特点。(4)氢键对于生命的重大意义。
1.[18 全国Ⅱ,35]S8(结构图![]() ),其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______________________________________。
),其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______________________________________。
2.[18 全国Ⅲ,35]ZnF2具有较高的熔点(872℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________________________________________________________________________。
3.[16 全国II,37]氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是________________________。
4.[15 全国Ⅰ,37]CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体。
5.[15 全国Ⅱ,37]单质O有两种同素异形体,其中沸点高的是_______(填分子式),原因是_______________________________________________。
6.[14 全国Ⅰ,37]乙酸的沸点明显高于乙醛,其主要原因是__________________________________。
一、分子间作用力
分子间作用力包括范德华力和氢键。
1.范德华力
存在于分子间,把分子聚集在一起的作用力,它比化学键弱得多,没有饱和性和方向性。一般来说,某物质的范德华力越大,则它的熔点、沸点就越高。
2.氢键
氢原子与电负性很大的原子X(F、O、N)以共价键结合时,共用电子对强烈地偏向X一边,若与电负性大的原子Y(与X相同的也可以)接近时即形成氢键,氢键则有饱和性和方向性。
(1)表示:通常表示为X-H…Y。
(2)作用力的大小比较:共价键>氢键>范德华力。
(3)存在:含H-O、H-N,H-F键的物质分子间,如H2O、H2O2、NH3、HF、CH3CH2OH、CH3COOH等物质除存在范德华力外还存在氢键。HF还能形成多聚分子(HF)n。
(4)氢键的分类及其对物质性质的影响:氢键分为分子间和分子内氢键两种形式:分子间氢键的形成,使物质的熔、沸点增大,在水中的溶解度增大;如NH3、H2O、HF中由于存在分子间氢键,使得它们的沸点比同族其它元素氢化物的沸点反常地高。且在水中的溶解度增大;分子内形成氢键使物质的熔、沸点变低。如熔点:
二、★分子间作用力对物质物理性质的影响
1.对物质熔沸点的影响
(1)组成和结构相似的物质(或结构影响较小时),其相对分子质量越大,分子间作用力(范德华力)越大,克服分子间引力使物质熔化和气化就需要更多的能量,熔、沸点越高。
(2)如果分子间存在氢键,则由氢键决定性质,分子的熔沸点往往反常。
2.相似相溶原理对物质溶解性的影响
(1)极性相似则相溶。极性分子、离子化合物易溶于极性分子溶剂水中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如Br2、I2易溶于苯、CCl4中;有机物易溶于有机溶剂)。
(2)如果存在氢键,则溶剂和溶质之间的气键作用力越大,溶解性越好。
【考型1】分子间作用力对物质性质的影响
1.[福建高考]硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是_________________________________________________________。
【考型2】氢键对物质性质的影响
2-1.[17 全国Ⅲ,35]在CO2低压合成甲醇反应(CO2+3H2==CH3OH+H2O)中所涉及的4种物质,沸点从高到低的顺序为______________________________,原因是_____________________________________________________________________________。
2-2.[15 海南,19]下列物质的结构或性质与氢键无关的是[双选]( )
A.乙醚的沸点 B.乙醇在水中的溶解度
C.氢化镁的晶格能 D.DNA的双螺旋结构
【考型3】答题信息的模仿
3.[17 全国Ⅱ,35]经X射线衍射测得化合物R[(N5)6(H3O)3(NH4)4Cl]的晶体结构,其局部结构如下图所示。图中虚线代表氢键,其表示式为![]() ______________、_______________________。(https://www.xing528.com)
______________、_______________________。(https://www.xing528.com)
【考型4】*含氧酸酸性强弱的比较
4.[全国高考]H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
(1)H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:____________________________。
(2)H2SeO4比H2SeO3酸性强的原因:____________________________________________________________________________________________。
一、分子(晶体)间熔沸点的比较
分子间作用力的大小,主要影响物质的物理性质如熔沸点和溶解性,而不是影响物质的化学性质。
分析时先看能否形成氢键(即是否含有F、O、N与H的成键),有氢键时由氢键决定熔沸点,无氢键由范德华力(比较相对分子质量)决定熔沸点。
(1)分子间能形成氢键时,分子间作用力增大,物质的溶解性和熔沸点显著增加或出现反常现象,这常常成为判断氢键存在的一种试题暗示。如沸点:H2O>HF>NH3>CH4;HF>HCl;H2O>H2S;分子内存在氢键时,其熔点降低。
由于存在分子间氢键和分子内氢键这两种情况,且对物质的影响不同,所以答题时一定要指明是“分子间”还是“分子内”氢键。
(2)无氢键时,组成和结构相似的分子晶体,一般相对分子质量越大,分子间作用力范德华力越强,熔沸点越高。例如:SiH4>CH4、HI>HBr>HCl;I2>Br2>Cl2>F2。近年来的高考中也出现如S8与SO2、O3与O2等结构不相似的分子晶体直接利用相对分子质量大小比较范德华力的例子。
有氢键物质与无氢键物质同时存在,在比较时要综合考虑,如熔点:H2O>H2Te>H2Se>H2S。在各主族元素中沸点最低的氢化物一般是第三周期的氢化物,即PH3、H2S、HCl。
(3)相对分子质量相近,组成和结构不相似的物质,分子的极性越大,熔沸点越高。例如:CO>N2。
(4)有机物的同分异构体之间,一般是支链越多,熔沸点越低。例如:正丁烷>异丁烷。
(5)根据物质在常温下的状态比较熔沸点:固体>液体>气体。例如:S>Br2>O2。
常温常压下,为气态或液态的物质,通常为分子型物质,其晶体属于分子晶体(Hg除外)。但近年高考题中,也出现了常温常压下为液态的离子化合物的情况,这也说明化学中的规律是相对的。
(6)在水中的溶解度由相似相溶原理决定。例如:HCl>CH4。
二、★非金属气态氢化物的性质
分析非金属气态氢化物的思路:
(1)化学性质:还原性或热稳定性,由非金属性强弱决定,非金属性越强,其气态氢化物越稳定,热稳定性越强,还原性越弱,如还原性:HF<H2O<NH3<CH4、HCl<H2S<PH3。
(2)物理性质:比较方法见上述“方法建模一、分子(晶体)间熔沸点的比较”。
(3)氢化物的酸性与非金属性不一致,考试中常不能作为非金属性强弱的判断依据。(*同周期从左往右氢化物的酸性越来越强,同主族由上到下氢化物的酸性越来越强)。
(4)拓展中的注意事项
①氢化物还存在金属氢化物,金属氢化物是离子化合物,其熔点大于含有氢键的非金属简单气态氢化物,注意审题界定范围。
②氢键越多,沸点越高,所以沸点:H2O>HF、H2O>CH3OH,水是沸点最高的简单非金属氢化物。
三、答题信息的模仿
在考试中会对一些题的思维或答法表示方法进行示例,作答时应以示例为标准,如:有机物中的合成线路,结构中的大π键的分析与表示,氢键的表示等。
运用答题信息要注意以下几点:一是正确分析答案信息的符号和符号的意义;二是答题时,运用答题信息进行有效迁移。
四、含氧酸酸性的比较
(1)不同元素形成的含氧酸,非金属性越强,最高价含氧酸的酸性越强,互为前提(O、F除外)。
(2)用非羟基氧原子的多少比较含氧酸的酸性:将含氧酸中HnROm改写成ROm-n(OH)n,非羟基氧原子(m-n)越大,R的正价越高,正电性更高,导致R-O-H中O的电子更向R偏移,越易电离出H+,所以HnROm的酸性越强。
注意:①含氧酸的氧化性,一般没有简单的规律。
②不是含有几个氢原子的酸就是几元酸,如H3PO2是一元中强酸。
③含氧酸的结构:H2SO4: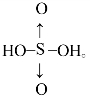
(3)同种元素的含氧酸,中心元素的化合价越高,酸性越强:例如酸性:HClO4>HClO3>HClO2>HClO;H2SO4>H2SO3等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




