【高考化学·考试大纲】(1)能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。(2)了解确定有机化合物结构的化学方法和物理方法(如质谱、红外光谱、核磁共振氢谱等)。(3)能正确书写有机化合物的同分异构体(不包括手性异构体)。(4)了解合成高分子的组成与结构特点,能依据简单合成高分子的结构分析其链节和单体。(5)了解加聚反应和缩聚反应的含义。(6)了解合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献。
【课程标准·学业要求】(1)能对单体和高分子进行相互推断,能分析高分子的合成路线,能写出典型的加聚反应和缩聚反应的反应式。(2)能说出测定有机化合物分子结构的常用仪器分析方法,能结合简单图谱信息分析判断有机化合物的分子结构。(3)能举例说明塑料、合成橡胶、合成纤维的组成和结构特点,能列举重要的合成高分子化合物,并说明它们在材料领域中的应用。(4)能参与营养健康、材料的选择与使用、垃圾处理等社会性议题的讨论,并作出有科学依据的判断、评价和决策。
●化学实验与波谱分析法
1.[15 全国Ⅱ,38]戊二酸的所有同分异构体在下列一种表征仪器中显示的信号完全相同的仪器是( )
A.质谱仪 B.红外光谱仪
C.元素分析仪 D.核磁共振仪
●有机分子式的计算
2.[14 全国Ⅰ,38]D属于单取代芳烃,其相对分子质量为106,该有机物的结构简式_______________,D的化学名称是__________________________。
3.[全国高考Ⅰ]芳香烃A的相对分子质量在100~110之间,1molA 充分燃烧生成72g水,A的化学名称________。
4.[全国高考]某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O。它可能的结构共有(不考虑立体异构)( )
A.4种 B.5种 C.6种 D.7种
●合成高分子化合物
5.[16 全国Ⅰ,38]
![]() 由F生成G的化学方程式为__________________________________________。
由F生成G的化学方程式为__________________________________________。
6.[16 全国Ⅲ,38]端炔烃在催化剂存在下可发生偶联反应,成为Glaser反应。
化合物![]() 也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为____________________________________。
也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为____________________________________。
该反应类型为______。若聚戊二酸丙二醇酯的平均相对分子质量为10 000,则其平均聚合度约为( )。
a.48 b.58 c.76 d.122
8.[15 全国Ⅰ,38]由A(C2H2)制备聚乙烯醇缩丁醛和顺式聚异戊二烯的合成路线如下:
(1)A的名称是,B中含有的官能团有________。
(2)①的反应类型是,⑦的反应类型是________。
(3)C和D的结构简式分别为_____、_____。
(4)顺式聚异戊二烯的结构简式为____________。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体(填结构简式)。_________________________________________。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线:________________________________________。
一、有机化学的检验
(1)过量浓溴水与C6H5OH(白色沉淀)溶液。
(2)FeCl3溶液:与酚类物质显出紫色或特殊颜色(颜色反应)。
(3)鉴别苯的同系物:同时做两个实验,不能使溴的四氯化碳溶液褪色(或不能使溴水反应褪色),能使酸性高锰酸钾溶液褪色。
(4)银氨溶液:含有-CHO的物质,除醛类外,还有甲酸、甲酸酯、甲酸盐、葡萄糖、麦芽糖等。
(5)新制Cu(OH)2:检验醛基(需加热煮沸,产生红色沉淀);羧基(沉淀溶解得蓝色溶液)。
(6)浓HNO3:遇(含苯环的)蛋白质显黄色。
(7)碘水:使淀粉溶液变蓝。
(8)溴水:能使烯烃、炔烃褪色;能与醛反应,氧化醛基,而不是加成。注意区分:溴水反应褪色与萃取褪色。
(9)NaHCO3与含有羧基的有机物反应生成羧酸钠,并放出CO2气体。
二、有机物的制取实验及注意事项
(1)乙烯的制取:①V(乙醇):V(浓硫酸)=l:3;②温度计水银球应插入液面下,保持170℃;③加沸石(防止暴沸)。④反应后溶液成黑色,这主要是浓硫酸使有机物脱水炭化所至,生成有刺激性气味的气体是因为:![]() 所致。
所致。
(2)石油分馏:①冷凝水下进上出(逆流原理);②温度计水银球插在蒸馏烧瓶的支管口(以测定生成物沸点);③加沸石(防止暴沸)。
(3)乙酸乙酯的制取:①小火加热(保证与CH3COOC2H5沸点接近的CH3COOH、C2H5OH能充分利用);②用饱和Na2CO3溶液吸收(便于CH3COOC2H5分层析出,且与CH3COOH反应并能溶解乙醇);③导管不插入液面下(防止倒吸)。
(4)银镜反应的实验:①银氨溶液的配制:向一定量2%的AgNO3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失②反应条件:碱性、水浴加热;③实验前、后试管的洗涤。
(5)乙炔的实验室制法:①不用启普发生器、长颈漏斗(反应放热,CaC2遇水会粉化,防止堵住管口);②注意水的流速(分液漏斗滴加,可用饱和食盐水代替水);③简易制法:试管口塞一团疏松的棉花(避免生成的泡沫从导管喷出)。
三、波谱法
(1)质谱仪法测相对分子质量:在质谱仪图谱中,相对丰度最大的质荷比的值,即为分子的相对分子质量。
(2)核磁共振氢谱(1H-NMR):常用于确定“等效氢原子数”,在核磁共振氢谱中,化学位移δ(即波峰数)为不同环境的氢原子数;不同波峰的面积比,表示不等效氢原子的数值比;分子中氢原子总数等于波峰比例之和的整倍数。
(3)红外光谱:获取分子中化学键与官能团的信息。
四、确定分子式的常用计算方法
(1)直接法:密度(相对密度)→摩尔质量→1mol分子中各元素原子的物质的量→分子式。
1mol分子中含A的物质的量:n(A)=![]()
(2)最简式法:元素的质量分数→最简式→结合Mr确定分子式。或由Mr和元素的质量分数直接确定分子中各原子的数目,进而确定分子式。
最简式的确定:![]()
(3)方程式法:根据化学方程式计算,确定有机物的分子式。利用燃烧反应方程式时,要抓住以下关键:①气体体积变化;②气体压强变化;③气体密度变化;④混合物平均相对分子质量等。
(4)*有机物中几种物质的数量关系
实验式(即最简式)相同的物质。
最简式相同的有机物,无论多少种、以何种比例混合,混合物中元素质量比值相同。当总质量不变,完全燃烧时消耗氧气的量恒定。
【考型1】有机物的物理性质与波谱分析
1.下列有关判断正确的是( )
A.[14 北京,10]室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷
B.[14 北京,10]用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.[14 浙江,10]CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
【考型2】有机实验与有机物的检验
2.下列判断错误的是( )
A.[15 天津,3]饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
B.[15 广东,22]向稀的苯酚水溶液滴加饱和溴水,观察到生成白色沉淀,说明产物三溴苯酚不溶于水
C.[14 北京,10]用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3
D.[14 四川,4]检验CH3CH2Br在NaOH溶液中是否发生水解的操作是将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀硝酸酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀(https://www.xing528.com)
【考型3】有机物的计算
3-1.[16 全国Ⅱ,38]A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰,A的化学名称为_______。
3-2.[15 全国Ⅱ,38]烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;则A的结构简式为_______。
【考型4】合成有机高分子
4-1.[15 北京,10]合成PPV的反应:
下列说法正确的是( )
A.合成PPV的反应为加聚反应
B.PPV与聚苯乙烯具有相同的重复结构单元
C.![]() 和苯乙烯互为同系物
和苯乙烯互为同系物
D.通过质谱法测定PPV的平均相对分子质量,可得其聚合度
4-2.按要求完成下列聚合反应
(1)[15上海,41]对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,写出该共聚物的结构简式_________。
(2)[14 天津,8]由CH2==CH-COONa在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为_____________________________。
(3)[14 山东,34]![]() 在一定条件下可以生成高聚物F,F的结构简式为_______________________________。
在一定条件下可以生成高聚物F,F的结构简式为_______________________________。
(4)[14 四川,10]C(HOCH2CH2OH)物质与CH2==C(CH3)-COOH按物质的量之比1∶1反应,其产物经加聚得到可作隐形眼镜的镜片材料I。I的结构简式是______________________。
一、★液态有机物的水溶解性及密度
实验中提示“密度”,常考虑用分液法;提示“溶解性”,常考虑用萃取法;提示“沸点”,常考虑用蒸馏法。
在选取溴的萃取剂时,与水互溶(乙醇),能与溴反应(己烯)的这类有机物,均不能作溴水中溴的萃取剂。
二、注意有机物检验的酸碱性环境
(1)卤代烃中卤素的检验:操作:取样,滴入NaOH溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO3溶液,观察沉淀的颜色,确定是何种卤素。
现象与结论:若观察到白色沉淀,说明有AgCl生成,即原卤代烃中含有氯原子。
生成其它卤化银的颜色,浅黄色(AgBr);黄色(AgI)。
★关键:卤代烃在碱性条件下水解后,一定要先加硝酸酸化后再用硝酸银溶液检验。
(2)淀粉在硫酸条件下水解后,一定要先加氢氧化钠中和酸后,再用银氨溶液检验。
(3)用新制的Cu(OH)2浊液检验醛基:向NaOH溶液中,滴加CuSO4溶液,生成蓝色沉淀,再滴入几滴醛,加热。
★关键:银镜反应和用新制的Cu(OH)2浊液检验醛基,都必须是碱性环境下进行。
三、★用分子量确定可能分子式的方法
(1)![]() =n(商)……m(余)。
=n(商)……m(余)。
写成烃的形式:CnH(2n+m)。
(2)进行等式量变化:![]() 变型为含氧衍生物[如:
变型为含氧衍生物[如:![]() 确定分子式。
确定分子式。
具体运用实例见考型,该方法避开了传统的计算,只要已知相对分子质量,一般都能快捷地确定出符合该相对分子质量的烃或烃的含氧衍生物的分子式。
四、聚合反应
加聚反应和缩聚反应统称为聚合反应。
1.加聚反应
(1)加聚反应的特点
①单体必须是含有双键、三键等不饱和键的化合物。例如:烯、二烯、炔、醛等含不饱和键的有机物。加聚物的命名是在单体前加“聚”字。
②加聚反应的过程中,没有副产物产生,聚合物链节的化学组成跟单体的化学组成相同。聚合物与加聚反应的单体所含各元素的质量分数相同,聚合物平均相对分子质量是单体相对分子质量的整数倍(n倍)。
(2)单体与链节的判断
主链链节只含有偶数个碳原子,通常就是加聚反应的产物。从高聚物找单体可采用弯箭头法。即用弯箭头从最左边将一条键转移,箭头处形成一个新键使单键变为双键,键尾处单键消失或双键变为单键。这种方法对有几种单体的共聚物也适用。
如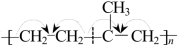 的单体是CH2==CH2和CH3CH==CH2。
的单体是CH2==CH2和CH3CH==CH2。
如 的单体是
的单体是![]()
 的单体是CH2==CH—CH==CH2和CH3CH==CH2。
的单体是CH2==CH—CH==CH2和CH3CH==CH2。
*(3)其它加聚
聚乙炔:![]()
注意:低聚物不属于高分子化合物:如三聚甲醛,三聚乙炔,三聚氰胺等。
2.缩聚反应
单体间相互反应生成高分子化合物,同时还生成小分子(如H2O、NH3、HX等)的反应。
(1)缩聚反应常见的是“聚酯类”和“聚肽类”反应,主链链节不全为碳原子,会出现O原子或者N原子。每个单体分子必含有两个可以增长分子链的官能团,如-OH、-NH2、-COOH等,当它们存在时,相互反应能增长分子链,成环或生成高聚物;4种能使链增长的官能团及反应。①R´-OH+R"-COOH→R"-COO-R´(酯基)②R´-OH+R"-OH→R"-O-R´(醚键)
③R´-NH2+R"-COOH→R"-CONH-R´(肽键)④*R´-COOH+R"-COOH→R"-COOCO-R´(酸酐)(2)缩聚反应与单体:找准结合点,反推单体,★“结合点必为分离点”。在结合点处断键,加入小分子(如H2O等)还原成单体。小分子遵守“从哪里来回哪里去”的原则。
如 的单体为HOCH2CH2OH和
的单体为HOCH2CH2OH和
3.酚醛树脂的生成
酚醛树脂的生成属于缩聚反应,但与前面的缩聚反应的原理相差较大,现独立分析,反应过程如下:
总反应:
*生成酚醛树脂的成键特点,常常在高考的信息题被拓展运用,如下列形式的反应:
L-H+HCHO→L-CH2-OH(醛基的加成反应)
L-H+HCHO+H-L→L-CH2-L+H2O
[相当于在(1)步反应后再取代。类似于酚醛树脂的反应]
所以甲醛或醛类常考醛基的加成。
4.聚合反应书写中的几点注意
(1)与加聚反应的书写不同,缩聚物的分子要标明端基原子或原子团,同时注意生成小分子的物质的量。由一种单体进行缩聚反应,生成的小分子物质的量应为(n-1);由两种单体进行缩聚反应,生成小分子的物质的量应为(2n-1)。如:
(2)在聚酯反应中,书写端基原子或原子团要注意“酸脱羟基醇脱氢”。
例如上例产物写成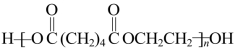 就是错误的。在“聚肽反应”中,是酸脱羟基氨脱氢。
就是错误的。在“聚肽反应”中,是酸脱羟基氨脱氢。
(3)*考试中链节的变式写法
在近年高考中,出现了链节的变式写法,即变化聚合度的值,使聚合物在写法和分析上出现新的变化。例如 变式写法为
变式写法为
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




