【高考化学·考试大纲】了解有机分子中官能团之间的相互影响,以及它们之间的相互转化。
【课程标准·学业要求】(1)能基于官能团、化学键的特点与反应规律分析和推断含有典型官能团的有机化合物的化学性质。根据有关信息书写相应的反应式。(2)能依据有机化合物分子的结构特征分析简单有机化合物的某些化学性质。
本专题是由“必修2”有机化学过渡到“选修5”中,主要目的是补齐有机物的类别和物质的性质
●有机物的性质
1.[14全国,12]香荚兰豆(C8H8O3)遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是( )
2.[16 全国Ⅲ,38]用1mol![]() 合成1,4-二苯基丁烷,理论上需要消耗氢气_____mol。
合成1,4-二苯基丁烷,理论上需要消耗氢气_____mol。
●与酸碱性溶液有关的有机反应
3.[15 全国Ⅱ,36]反应![]() CH3COCH3结束后,为中和反应中的H+(硫酸),加入的试剂最适宜的是( )
CH3COCH3结束后,为中和反应中的H+(硫酸),加入的试剂最适宜的是( )
A.NaOH B.CaCO3 C.NaHCO3 D.CaO
4.[14 全国,30] 试剂a是_____。
试剂a是_____。
一、卤代烃、酚、醛、酯的性质
1.卤代烃
(1)卤代烃与碱反应,溶剂不同,产物不同。
①★溴乙烷水解(与NaOH水溶液反应):
②★溴乙烷的消去反应(与NaOH醇溶液反应):
(2)卤代烃的生成
2.酚
醇与酚的区别:酚有酸性(苯酚俗名石炭酸,不能使紫色石蕊溶液变红,可与NaOH溶液反应)。
(1)苯酚的酸性
酸性:H2CO3>酚>HCO-3
①![]()
②![]()
③★苯酚钠溶液中通入二氧化碳:![]() (复分解反应,不能生成Na2CO3)
(复分解反应,不能生成Na2CO3)
(2)苯酚与过量浓溴水反应(用于检验酚羟基)
(3)酚与Fe3+相遇,显紫色(显色反应),常用于检验酚羟基。
*拓展性知识:①酚羟基不稳定,在空气中易被氧化成红色的复杂物质,在氧化反应中需要进行保护;
②酚羟基一般难于发生醇类式的酯化反应,这常常需要通过试题判断;
③温度大于75℃时,酚与水互溶;在常温下形成两层液体,即“水的酚溶液”和“酚的水溶液”,所以,分离方法是分液而不是过滤。
3.醛
(1)加氢制醇
(2)乙醛的银镜反应:
(注意记产物和系数:羧酸铵和水银氨,系数一加一二三,也可记为一羧酸铵和一水二银三氨)
*福尔马林是甲醛的水溶液。
甲醛的银镜反应:
(3)乙醛与新制氢氧化铜悬浊液
4.酯
(1)乙酸乙酯的制取:
①结构变化:酸脱羟基醇脱羟基氢。②可逆反应。
(2)乙酸乙酯的水解:
①酯在稀酸条件下水解。
②在碱性条件下水解,趋于完全:CH3COOC2H5+![]() CH3CH2OH(取代反应)
CH3CH2OH(取代反应)
【考型1】试剂、条件与反应
1.[15 山东,34]已知:
写出D和E反应生成F的化学方程式:________________________________________。
【考型2】羟基的酸性(氢的活性)
2.完成下列填空
(1)[15 天津,8] 中①、②、③3个-OH的酸性由强到弱的顺序是___________。
中①、②、③3个-OH的酸性由强到弱的顺序是___________。
(2)[15 天津,8]1molF(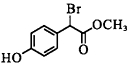 )在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为________mol。
)在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为________mol。
【考型3】与结构或位置有关的反应
3.[14重庆,10]G(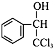 )的同分异构体L遇FeCl3溶液显色,与足量饱和溴水反应未见白色沉淀产生,则L与NaOH的乙醇溶液共热,所得有机物的结构简式为______________。(只写一种)
)的同分异构体L遇FeCl3溶液显色,与足量饱和溴水反应未见白色沉淀产生,则L与NaOH的乙醇溶液共热,所得有机物的结构简式为______________。(只写一种)
【考型4】反应方程式的书写(https://www.xing528.com)
4.[16 天津,8]![]() 中含氧官能团的名称是________,检验该官能团的化学反应方程式__________________________________。
中含氧官能团的名称是________,检验该官能团的化学反应方程式__________________________________。
一、★反应试剂、条件与有机反应的关系
从高考有机推断的实际出发,要求熟悉下列以反应条件为基础归纳的有机反应、官能团和反应类型,实现“看条件猜反应”的转变。
1.H2SO4(产物多有水生成)
(1)H2SO4(浓)/△或170℃:醇分子内消去成烯(消去反应)。
(2)H2SO4(浓)/△或140℃:醇分子间脱水成醚(取代反应)。
(3)H2SO4(浓)/△:羧酸和醇的酯化反应(酚羟基在一般情况下不能生成酯)(取代反应)。
(4)浓H2SO4与HNO3混酸/△:苯环上的硝化(取代反应)。
(5)H2SO4(稀)/△:酯的水解;淀粉的水解。
(6)H+(稀硫酸):出现在有碱参与的反应后,对生成的羧酸盐或苯酚钠进行酸化,酸化属于复分解反应,不属于取代反应。
H2SO4的作用各不同,在(1)中作催化剂和脱水剂;(2)(3)(4)中作催化剂和吸水剂;(5)中只作催化剂;(6)中作酸。
2.NaOH
(1)NaOH,醇/△:卤代烃发生消去反应生成烯烃。
(2)NaOH,H2O/△:卤代烃水解生成醇。
(巧记:卤代烃碱解,有水生成醇,有醇生成烯)。
(3)NaOH/△:酯的水解,糖类、油脂的水解(皂化反应);醚和醇不与NaOH反应。
(4)NaOH:羧酸的中和;氨基酸的中和反应。
(5)NaOH:与酚的反应。
特别注意NaOH存在条件下与卤代烃反应的两种条件:“水溶液”中发生取代反应、“醇溶液”中发生消去反应。
复杂结构中要认真分析,要找准酯基(消耗1molNaOH)。酚酯和溴苯水解后生成了酚羟基(消耗2molNaOH)。注意不是所有的6元环都是苯环,这在分析中也是常犯的错误。
耗碱量分析是考试的一个重点,常考复杂结构,当产物中有羧基、酚羟基、氢卤酸生成时一定要再中和写成钠盐的形式。为避免错误,可用二步分析法,先分析水解或消去反应,后分析中和反应。或是先由反应物定出消耗的NaOH的量,并写出生成的有机物的正确结构简式,配平时,可以以“氧原子”守恒,确定生成物中水的计量数。
例如:
3.X2(拓展 PBr3)
(1)Cl2/光:烷烃(或烯烃或C6H5-CH3分子中烷基上)的取代。
(2)Br2(液)/Fe或FeBr3:苯环上的溴代反应。
(3)过量Br2(浓):酚类苯环上酚羟基邻、对位上的取代反应。在苯环上酚羟基的邻、对位上氢原子发生取代反应,当这些位置被其它原子占位时,则取代数减少,这常用于溴的耗量分析。
(4)Br2/CCl4;Br2(水):不饱和烃的加成,一般不与醛基和苯环发生加成反应(溴水氧化醛基)。
4.H2/Ni或Pt,(拓展NaBH4)
H2只能发生加成反应,不能发生取代反应,在一定条件下能发生加成反应的官能团有![]() 苯环和—CO-、-CHO(后两者通常也称为还原反应),一般默认不能加成酯基(RCOOR)和羧基(-COOH)。
苯环和—CO-、-CHO(后两者通常也称为还原反应),一般默认不能加成酯基(RCOOR)和羧基(-COOH)。
*NaBH4是强还原剂,在信息反应中,甚至能将-COOH还能成-CH2OH。
5.氧化剂,[O]
(1)O2(Cu/Ag),△或CuO,△或O2/催化剂:醇催化氧化成醛或酮;醇氧化成酸。
(2)O2:苯酚在空气中被氧化而呈粉红色。
(3)氧化剂,[O]:烯的氧化。
(4)KMnO4(H+):不饱和烃的氧化;可将醇或醛氧化成酸;苯的同系物侧链被氧化成羧基;酚的氧化。(能使酸性高锰酸钾溶液褪色,但不能使溴水因反应而褪色的现象能鉴别苯的同系物。)
(5)Ag(NH3)2OH/水浴;Cu(OH)2/△:-CHO的氧化(不一定是醛类,常有甲酸、甲酸酯、甲酸盐、葡萄糖等含醛基的物质)。(注意新制Cu(OH)2悬浊液与甲酸混合,先是得到蓝色溶液,加热煮沸出现砖红色沉淀)
6.HX
(1)HBr/△:醇的卤代(取代反应)。
(2)HCl/催化剂△:不饱和烃的加成。
(3)HCl/HgCl2△:乙炔加成制氯乙烯。
7.H2O/催化剂
(1)乙烯加成制乙醇,乙炔水化制乙醛。
(2)能发生水解反应的有:卤代烃、酯、油脂、低聚糖、多糖、蛋白质、多肽、羧酸盐等水解。
二、羟基的酸性(氢的活性)与反应条件
无机试剂与有机官能团的反应常用于有机合成中分析官能团种类和确定其数目。(注意:分析羟基的性质,反应中注意酸与醇的结构)。
酸性:—COOH(羧基)>酚羟基>醇羟基
三、书写有机反应方程式的“三查”
一查反应符号:.一般反应过程用“—→”,酯化反应用“ ”,有机反应的默认写法是用“结构简式”,如果题目中已经用“键线式”示范,也可以用键线式书写。
”,有机反应的默认写法是用“结构简式”,如果题目中已经用“键线式”示范,也可以用键线式书写。
二查反应条件:学过的反应条件用已知条件注明;信息反应用信息中的条件注明;不清楚时,可写成“一定条件”。
三查小分子与配平:不忘产物中的无机小分子如:H2O、HCl等,并注意配平。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




